高考电化学试题分析及多方位解法探究
杜博博,尹娇阳, 胡小兵
(宝鸡文理学院化学化工学院,陕西宝鸡 721013)
1 高考电化学试题分析
1.1 建构电化学试题分析框架
高考电化学试题常常以生活实践情境或学术探索情境为真实情境载体, 融入所要考查的必备知识和关键能力,以解决实际问题为测试任务,按照评价体系设置不同层次、有难易梯度的试题,体现考查内容的基础性、综合性、应用性和创新性,凸显化学学科核心素养和核心价值。 因此,对于高考电化学试题的研究应该从试题情境、考查要求、考查内容、考查角度等方面进行试题研究[1~3]。
1.2 2020 年3 套全国卷理综电化学试题分析
电化学试题重点考查离子反应方程式、氧化还原反应、物质的量计算、元素化合物、电化学知识等基础化学内容,考查学生理解、吸收、整合化学信息的能力、分析和解决化学问题的能力[4]、化学思维和探究的能力等,以2020 年3 套全国理综卷电化学试题为例进行分析如表1 所示。

表1 2020 年全国卷高考电化学试题分析
2 高考电化学试题解题探究
通过文本法对2020 年全国卷电化学试题进行研究, 从试题情境与考查角度等方面入手分析探究电化学试题的解题方法和规律,见图1~图4。

图4
例1 解题思路探析:该题考查反应式的书写、定量计算、微粒浓度变化等内容,从题干信息“放电时, 温室气体CO2被转化为储氢物质甲酸等”中直接可以找出反应物和生成物并根据其化合价变化对电极做出判断,因此放电时通入二氧化碳的一极为正极,电极金属锌为负极,再根据图1所示发现Zn 失电子后结合OH-生成了Zn(OH)42-,因此负极反应为,A 项正确;放电时,正极上CO2生成了HCOOH,碳元素的化合价从+4 变成+2,可知有1molCO2参与反应生成HCOOH 时转移的电子的物质的量为2mol,B 项正确; 充电时阴极上Zn (OH)42-转化为Zn, 阳极上H2O 失电子生成了O2, 因此电池总反应为2Zn (OH)42-=2Zn+O2↑+4OH-+2H2O,C 项正确; 充电时阳极反应式为2H2O-4e-=4H++O2↑,因此正极区c(OH-)降低,D项错误。
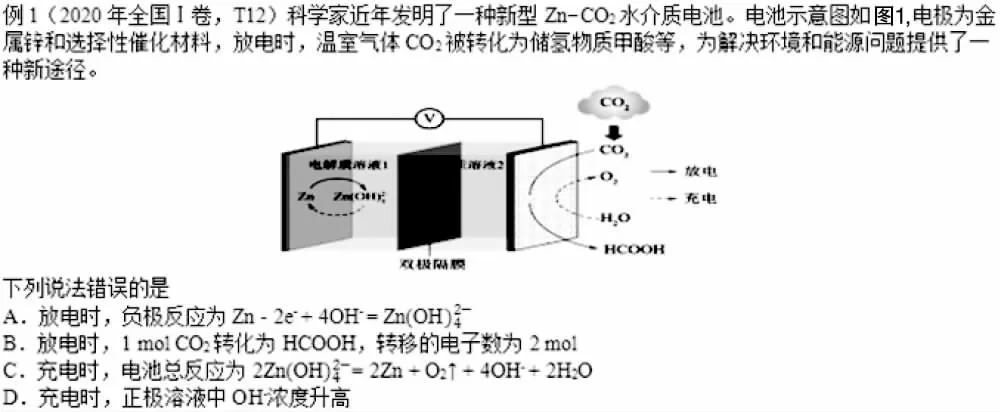
图1
例2 解题思路探析:该题考查电解原理的应用,从装置图可以判断出为电解池,由“当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3”可知Ag 失电子变成Ag+, 因此,Ag 电极做阳极,透明导电层做阴极,A 项正确;电解池工作时阳离子移向阴极,B 项正确; 从题干信息推知,WO3在阴极放电生成AgxWO3,W 元素化合价降低,C 项错误; 阳极反应式Ag-e-=Ag+, 阴极反应式xAg++WO3+e-=AgxWO3, 结合阴阳极反应式写出总反应WO3+xAg=AgxWO3D 项正确。

图2
例3 解题思路探析: 根据图3 可知该装置为电解池,通过球棍模型看出CO2转化成了CO,阴极反应式为CO2+2e-=CO+O2-。CH4转化成了CH2=CH2,C 的 化 合 价 从-4 降 低 为-2,CH4转 化 成 了CH3-CH3,C 的化合价从-4 降低为-3,若生成的乙烯和乙烷的物质的量分别为2mol、1 mol 时,阳极转移的电子的物质的量为[-2-(-4)]×2×2+[-3-(-4)]×2×1=10mol,根据原子守恒可知消耗CH4物质的量为6mol,此时阴极消耗CO25mol,因此若生成的乙烯和乙烷的体积比为2∶1, 则消耗的CH4和CO2体积比为6∶5。
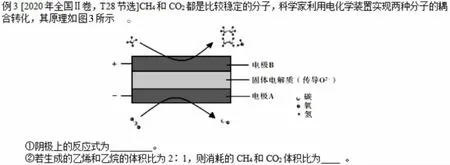
图3
例4 解题思路探析: 该题考查原电池原理,由题干信息可知VB2电极失电子作负极, 复合碳电极为正极,O2在正极得电子, 反应式为O2+4e-+2H2O=4OH-, 转 移0.04mol 电 子 时, 有0.01mol O2参与反应, 在标准状况下的体积为0.224L,A 项正确;负极消耗OH-,pH 降低,正极产生OH-,pH 升高,B 项错误; 结合正负极反应式, 电池总反应为4VB2+11O2+20OH-+6H2O=8B(OH)4-+4VO43-,C 项正确;电流从正极流出沿导线经过负载进入负极, 然后在通过电解质溶液回到正极,D 项正确。
3 高考电化学试题多方位解法
3.1 电池种类判断
在遇到电化学试题时,首先要搞明白该题考查的是电解池还是原电池。 原电池是把化学能转化为电能的装置, 属于自发进行的氧化还原反应;而电解池则与它相反,即为电能转换为化学能的装置,是在外接电源的作用下发生氧化还原反应。 在分析电化学试题时,我们要充分提取题干中有效信息,判断出题干所考查的内容是原电池还是电解池。 如题目所给的装置图中的电极材料若与“光伏电池”“直流电源”“电源”“+、-”等相连时,则判断为电解池;若电极材料与“负载”“用电器”等相连时,可判断为原电池。 题干描述中若出现“二次电池”,是指该电池既可放电也可充电,放电时用作原电池,充电时用作电解池。 通常,题干信息中出现“空气电池、微生物电池、燃料电池”等是指原电池,如果出现“电解法”“电解氧化法”“电渗析法”“外加电流的阴极保护法”等往往指电解池。
3.2 电极判断
在原电池中,两个电极名称分别是正极和负极,正极得电子,发生还原反应;而负极失电子,发生氧化反应。 原电池的负极一般为:1) 活性金属 材 料, 如Li、Mg、Al、Pb、Zn、Ag 等;2)C3H8O、C6H12O6、CH3COO-、CH3OH 等可失电子的有机物质所在的电极;3) 有Li+、Cu2+等阳离子流出的电极;4) 电子流出的电极。 原电池的正极一般为:1)有O2、Cl2等氧化性强的非金属单质所通入的电极;2)有MnO2、WO3、AgO、PbO2等高价态的金属氧化物的电极;3)AgCl、NiOOH、K2FeO4等具有氧化性物质的电极;4)电流流出的电极[4~6]。
在电解池中两个电极分别叫做阳极和阴极,阴极得电子,发生还原反应;阳极失电子,发生氧化反应。 对于阴阳极判断的依据有:1) 与电源负极相连的电极称作阴极,与电源正极相连的电极称作阳极;2)根据题干所给总反应式来判断,观察反应式中元素的化合价变化,有元素化合价降低的一极为阴极, 元素化合价升高的一极作阳极;3)根据生成物来判断,电极上若有O2、Cl2生成,则该电极为阳极,若有Zn、Pb、H2等生成,该电极为阴极。
3.3 反应式的书写
在书写电极反应式时, 需遵循原子守恒、得失电子守恒、电荷守恒。 按照程序性原则将电极反应式书写步骤一般分为五步:1) 写反应物,在题目所呈现的信息中找出各个电极的反应物;2)写生成物, 根据化学反应规律写出生成物;3)得失电子,根据化合价变化写出得到或失去电子的数目;4)配平电荷,依据电荷守恒,配出相关离子和数目;5)缺啥补啥,根据原子守恒补齐物质使反应式前后各原子数目相等。 总反应式在书写时可将正负电极或阴阳电极相加得到,需满足得失电子守恒,也可以根据氧化还原反应的规律直接写出总反应式[7~9]。
3.4 电流、电子、离子的移动方向
电流可以通过外电路,也可以通过内电路,而电子不能进入电解质溶液。 在无离子交换膜存在时, 一般阴阳离子迁移方向如表2 所示。若有离子交换膜存在, 则根据题目中隔膜、离子选择性膜做出具体判断,其中,只允许质子通过的膜为质子交换膜,允许阳离子通过的膜是阳离子交换膜,允许阴离子通过的膜是阴离子交换膜[10]。
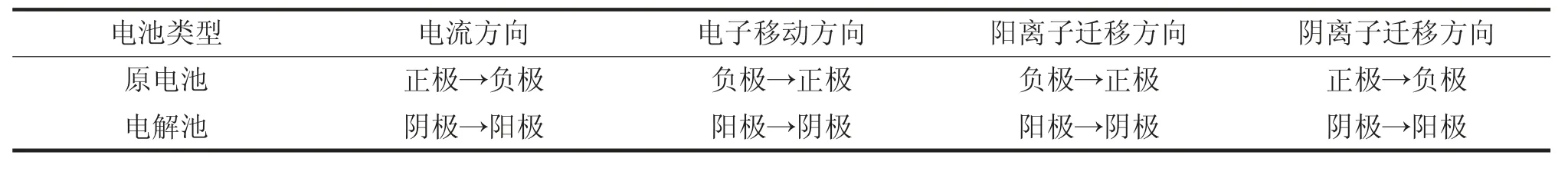
表2 电池中电流、电子、离子移动方向
3.5 定量计算
定量计算是按照题目所给定或规定的相关量,运用化学原理或方法将化学问题进行数学处理,计算出其他量。 电化学中的定量计算一般包括物质的量、气体体积、物质的量浓度、质量等,常见的类型有:1)根据放电或充电时反应物的化学计量变化,计算转移的电子数目;2)根据电路中转移的电子数目,计算放电或充电时产物的相关量;3)根据电路中转移的电子数目,计算电极的质量变化。 电化学试题中的定量计算可借助电极反应式,遵循得失电子守恒的思想来应对。
为了方便读者更好的理解和掌握电化学试题的多方位解法,现以下面几个具体实例加以说明(见图5~图7)。

图5
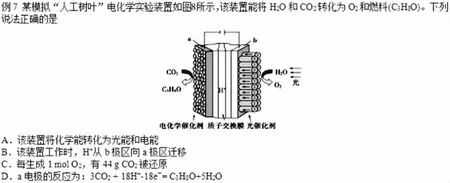
图7
例5 解法说明: 该题题干中出现了“电渗析法”“直流电场”“+、-”等关键字眼,因此判断该电池为电解池。 左边惰性材料与“-”相连,为阴极,右边惰性材料与“+”相连,为阳极。SO42-为阴离子,从正极区移向负极区。 阴极反应式书写步骤:先写出阴极反应物为H2O, 再写出生成物为H2,得到2e-,然后用OH-配平,最终为2H2O+2e-=H2↑+2OH-。 根据电子转移的数目进行定量计算,可知电路中通过1mol 电子时,生成0.25molO2生成。
例6 解法说明:该题干出现“微生物电池”“化学能转化为电能”,因此判断该电池为原电池。 左边反应物有C6H12O6为负极, 右边反应物是O2为正极。 质子交换膜只允许质子通过,质子从负极区移向正极区。 根据书写步骤写出负极电极反应式:第一步找出反应物为C6H12O6,第二步判断出生成物有CO2, 第三步根据化合价变化计算出每消耗1molC6H12O6失去24mole-,第四步依据电荷守恒,用H+配平反应式左右两端电荷,第五步采用原子守恒补充缺少的物质, 最终写的式子为C6H12O6-24e-+6H2O=6CO2+24H+;再根据同样的步骤写出正极的反应式为O2+4e-+4H+=2H2O; 综合正负极反应式及运用得失电子守恒,写出总反应式为C6H12O6=6CO2+6H2O。 也可通过氧化还原反应的规律直接写出总反应式。

图6
例7 解法说明:从题干可知,b 极H2O 转化为O2,a 极CO2转化为C3H8O,且图像中有“-||-”,可知该电池为电解池,a 极为阴极,b 极为阳极。 H+通过质子交换膜从阳极移向阴极。a 极电极反应式书写步骤:第一步写出反应物为CO2,第二步找出生成物为C3H8O,第三步根据化合价变化计算出每生成1molC3H8O 时得到18mole-,第四步根据电荷守恒用H+配平电荷,第五步根据原子守恒,补充缺少的物质H2O,最终得出的反应式为3CO2+18e-+18H+=C3H8O+5H2O。按照电极反应式书写步骤,写出b 极反应式为2H2O-4e-=O2↑+4H+,每生成1molO2转移4mol 电子,再结合a 极反应式,计算电路中有4 mol 电子转移时,被还原的CO2为

