miR-342对SKBr-3人乳腺癌细胞增殖凋亡的影响及其与赫赛汀协同作用的研究
何跃君 赵严冬 章密密 王建
[摘要] 目的 观察下调miR-342表达或联合赫赛汀对SKBr-3人乳腺癌细胞增殖、凋亡的影响,并探讨其可能机制。方法 采用小干扰RNA技术SKBr-3细胞瞬时转染miR-342 siRNA和无义siRNA,分别加或不加赫赛汀100 μg/ml培养,CCK-8细胞增殖测定、凋亡实验观察两组间的差异;Western blot法检测各组细胞中HER-2蛋白的表达。结果 ①细胞增殖实验:下调miR-342或联合赫赛汀,miR-342 siRNA组OD值低于阴性对照组(P<0.05);②细胞凋亡实验:下调miR-342后48 h不增加凋亡细胞比例(P>0.05);但联合赫赛汀作用下,凋亡细胞比例较对照组高(P<0.05);③RT-PCR示下调miR-342表达降低HER-2 mRNA的表达水平(P<0.05);Western blot示miR-342 siRNA组的HER-2蛋白降低,联合赫赛汀更显著(P<0.05)。 结论 下调miR-342表达降低SKBr-3细胞的增殖,与赫赛汀有协同抑制细胞增殖、促进细胞凋亡的作用,其机制可能与共同下调HER-2蛋白表达有关。
[关键词] 乳腺癌;miR-342;赫赛汀;HER-2蛋白;SKBr-3细胞
[中图分类号] R737.9 [文献标识码] A [文章编号] 1673-9701(2022)12-0028-03
[Abstract] Objective To observe the effects of inhibiting the expression of miR-342 or combining Herceptin on the proliferation and apoptosis of SKBr-3 breast cancer cells, and to explore its possible mechanism. Methods Small interfering RNA technology was used to transiently transform the cells with miR-342 siRNA and nonsense siRNA, with or without Herceptin 100 μg/ml treatment, and observed the difference between the two groups by cell proliferation assay and apoptosis experiment; Western blot was used to detect the expression of HER-2 protein. Results Cell proliferation assay: downregulation of miR-342 or combined with Herceptin, the OD value of miR-342 siRNA group was lower (P<0.05); ②Apoptosis test: 48 hours after downregulating miR-342, the proportion of apoptotic cells was not increased (P>0.05); but under the combined effect of Herceptin, the proportion of apoptotic cells in miR-342 siRNA group was higher (P<0.05); ③RT-PCR showed down-regulation of miR-342 expression decreased the level of HER-2 mRNA (P<0.05); Western blot showed the HER-2 protein in the miR-342 siRNA group decreased, which was more significant in combination with Herceptin (P<0.05). Conclusion Down-regulating miR-342 expression can reduce the proliferation of SKBr-3 cells, and has a synergistic effect on inhibiting cell proliferation and promoting cell apoptosis combined with Herceptin. The mechanism may be related to the joint down-regulation of HER-2 protein expression.
[Key words] Breast cancer; miR-342; Herceptin; HER-2 protein; SKBr-3 cell
HER-2基因過表达在乳腺癌患者中发生率为15%~20%,HER-2阳性乳腺癌恶性程度高、易复发转移,预后较差[1-2]。针对HER-2蛋白的靶向药物曲妥珠单抗(Herceptin,赫赛汀)的临床应用使其预后明显改善[3-4]。但部分患者仍会出现复发转移,可能与赫赛汀耐药相关[5]。MicroRNA调控多种基因的表达,某些microRNA的异常表达影响肿瘤对放化疗、靶向药物的敏感性[6-7]。本课题组前期研究显示,乳腺癌组织中的miR-342表达水平与HER-2的表达呈正相关[8]。本实验观察下调miR-342对SKBr-3细胞HER-2表达水平的影响,以及联合赫赛汀是否具有协同作用,为探索HER-2阳性乳腺癌可能的新靶点提供实验基础,现报道如下。
1 材料与方法
1.1 材料
赫赛汀产自罗氏公司,SKBr-3细胞购自上海生科院细胞资源中心,miR-342、HER-2及内参相关引物由上海生工合成,逆转录试剂盒、实时PCR试剂盒购自日本Takara公司,一抗、二抗购自美国Santa Cruz公司。ABI 7300 real-time PCR仪器(Ambion)。
1.2 RT-PCR检测miR-342的表达
按Trizol试剂说明书抽提总RNA,为增加微小RNA获得率,将步骤中异丙醇沉淀改成-20℃沉淀2 h以上。miR-342茎环反转录引物及内参U6的引物,miR-342:CTCAACTGGTGTCGTGGAGTCGGCAATTC-A GTTGAGACGGGTGC;U6snRNA:AACGCTTCACGA-ATTTGCGT。总RNA逆转录合成cDNA,反应条件:42℃ 60 min,85℃ 5 min。RT-PCR检测miR-342表达,miR-342引物上游:ACACTCCAGCTGGGTTCTCACACAGAAATC,下游:TGGTGTCGTGGAGTCG;U6 sn RNA引物上游:CTCGCTTCGGCAGCACA,下游:AACG-CTTCACGAATTTGCGT。反应条件:95℃,预变性10 min后,95℃ 15 s,60℃ 1 min,40个循环。
1.3 HER-2 mRNA的实时定量PCR
总RNA逆转录成cDNA,反应条件:37℃ 15 min,85℃ 5 s,4℃保持。实时定量PCR,HER-2引物上游:GGAGACCCGCTGAACAATACC,下游:AGAGCGGTT-GGTGTCTATCAGTG;β-actin引物上游:TTCTACAATGAGCTGCGTGTG,下游:CAGCCTGGATAGCAACGTACA。反应条件:95℃预变性30 s,95℃ 5 s,60℃ 31 s,40个循环。
1.4 细胞培养及转染
SKBr-3细胞置于37℃、5% CO2的培养箱中,10%胎牛血清DMEM培养基培养。采用小干扰RNA技术,将miR-342 siRNA及无义siRNA(上海吉玛),配成2×10-5 mol/L的工作液,按lipo2000转染剂说明书转染。
1.5 细胞增殖检测
CCK-8比色法检测细胞增殖,细胞接种于96孔板中,每孔含5000个细胞,设5个平行孔,培养箱中24 h,加或不加含100 μg/ml赫赛汀的培养基,设置培养液对照孔。孵育48 h更换含10% CCK-8的新鲜培养液,温箱孵育4 h,测450 nm处吸光度(OD)值。
1.6 细胞凋亡测定
细胞接种于6孔板中,细胞数1.5×105个/孔。温箱中24 h,弃去原液,加或不加含100 μg/ml赫赛汀的培养基48 h,不含乙二胺四乙酸(EDTA)的胰酶消化,离心、收集细胞。凋亡试剂盒进行避光染色,室温孵育30 min上流式细胞仪进行检测,实验重复3次。
1.7 Western blot检测HER-2蛋白的表达
细胞加或不加100 μg/ml赫赛汀处理48 h,按试剂盒说明提取总蛋白,一抗加兔抗人HER-2抗体,4℃孵育过夜、洗膜3次、加羊抗兔IgG(二抗)室温孵育2 h,洗膜3次,暗室中显影。β-actin作内参。Image J软件灰度分析:计算目的蛋白与对应的内参蛋白的灰度值比。
1.8 统计学方法
应用SPSS 17.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示。多组均数比较用单因素方差分析,两组均数比较用独立样本t检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 转染后miR-342及HER-2 mRNA表达的变化
SKBr-3细胞转染miR-342 siRNA后miR-342相对表达量为对照组的(0.00048±0.00031)倍,差异有统计学意义(P<0.05),下调miR-342的表达显著;HER-2 mRNA的表达量降低为对照组的(0.75±0.09)倍,差异有统计学意义(P<0.05)。
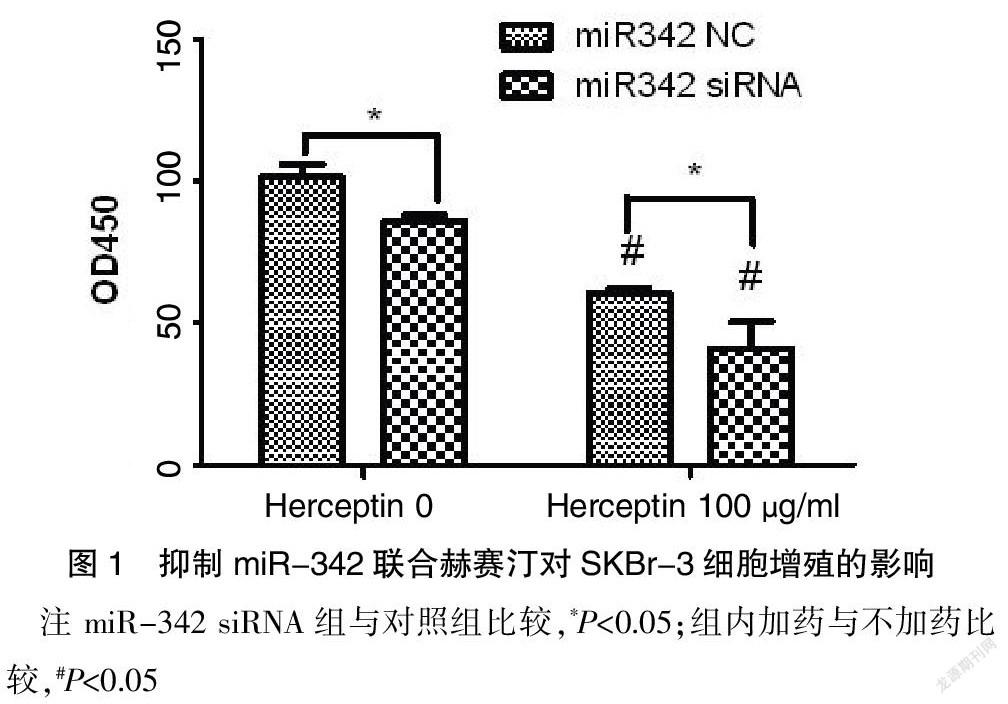
2.2 下调miR-342联合赫赛汀对细胞增殖的影响
细胞增殖实验,下调miR-342后48 h的OD值低于对照组(P<0.05),对细胞的增殖具有抑制作用;加赫赛汀100 μg/ml 48 h后,两组均表现明显增殖抑制作用(P<0.05);miR-342 siRNA组的抑制作用更为显著,OD值低于对照组(P<0.05)。见图1。
2.3 下调miR-342联合赫赛汀对细胞凋亡的影响
细胞凋亡实验,下调miR-342后48 h时的凋亡细胞比例与对照组比较,差异无统计学意义(P>0.05)。但加入100 μg/ml赫赛汀作用48 h,两组的凋亡细胞比例均较未加药组增加(P<0.05);其中,miR342 siRNA组的凋亡细胞比例增加更多(P<0.05)。见封三图1。
2.4 Western blot檢测Her-2蛋白的表达
Western blot结果显示,miR-342 siRNA组较对照组细胞中HER-2蛋白的表达水平降低(P<0.05);加入100 μg/ml的赫赛汀48 h后HER-2蛋白的表达水平均降低,其中miR-342 siRNA组降低更明显,差异有统计学意义(P<0.05)。见封三图2。
3 讨论
HER-2阳性乳腺癌恶性程度高,易复发转移,靶向药物赫赛汀可降低其50%的复发率,同时延长无进展生存期[2,9]。可是单用赫赛汀的有效率为12%~34%,中位缓解期约9个月,有66%~88%的患者在接受赫赛汀治疗1年内即产生耐药,导致肿瘤进展[10]。
赫赛汀耐药可能与HER-2基因扩增及蛋白高表达、HER-2结合位点受损、HER-2下游通路激活、HER家族成员间的相互作用有关[11-12]。既往已有关于HER-2蛋白表达与赫赛汀耐药的研究,其中一项研究通过对转移性HER-2阳性乳腺癌患者的HER-2蛋白表达定量检测发现,HER-2低表达(H2T<16.1 RF/mm2)患者的PFS比中度表达(16.1 RF/mm2≤H2T≤68.3 RF/mm2)患者显著延长;而HER-2高表达(H2T>68.3 RF/mm2)患者的PFS比中度表达者缩短5~6倍,结果显示HER-2蛋白高表达影响赫赛汀的疗效[13]。另一项Ⅲ期临床研究检测455例HER-2阳性乳腺癌患者的HER-2蛋白表达,结果显示赫赛汀联合拉帕替尼治疗组中HER-2蛋白高表达者的pCR及PFS均优于低表达者[14]。因此,目前关于HER-2蛋白表达量对赫赛汀疗效影响的研究结果并不统一。
microRNA参与调控多种靶基因的mRNA,广泛参与肿瘤的多重耐药,包括化疗药物、内分泌及靶向药物[15]。近年来microRNA在逆转药物耐药性及调节肿瘤药物敏感性的研究备受关注。本实验瞬时转染示下调miR-342后,细胞中HER-2 mRNA及HER-2蛋白的表达水平也相应降低;下调miR-342联合赫赛汀有协同抑制细胞增殖的作用;赫赛汀可以增強免疫细胞攻击作用,诱使免疫细胞杀伤肿瘤靶细胞并促进其凋亡[16]。细胞凋亡检测示,下调miR-342表达后48 h未见对细胞凋亡比例的影响,但与赫赛汀联合时发挥协同作用可促进细胞凋亡。
Li等[17]研究发现,针对HER3 mRNA或miR-125a/b的联合靶向治疗可以逆转乳腺癌曲妥珠单抗的耐药。本实验下调miR-342的表达与赫赛汀联用,能显著抑制SKBr-3细胞HER-2蛋白的表达水平,表明二者可能是通过共同下调HER-2蛋白的表达来协同抑制细胞增殖、促进凋亡。miR-342是否能通过改变HER-2表达或直接作用来调节HER家族其它成员的表达,从而影响赫赛汀的药物敏感性,需要进一步研究。
综上所述,本实验初步证实HER-2阳性乳腺癌细胞下调miR-342联合赫赛汀有协同抑制肿瘤增殖、促进细胞凋亡的作用,可能与共同下调HER-2蛋白表达有关。为HER-2阳性乳腺癌的治疗提供新靶点可能,也为后续进一步研究提供实验基础。
[参考文献]
[1] Scheuer W,Friess T,Burtscher H,et al. Strongly enhanced antitumor activity of trastuzumab and pertuzumab combination treatment on HER2-positive human xenograft tumor models[J].Cancer Res,2009,69(24):9330-9336.
[2] Cameron D,Piccart-Gebhart MJ,Gelber RD,et al. 11 years′ follow up of trastuzumab after adjuvant chemotherapy in HER-2 positive early breast cancer:Final analysis of the herceptin adjuvant (HERA) trial[J].Lancet,2017, 389 (10 075):1195-1205.
[3] Slamon D,Eiermann W,Robert N,et al. Adjuvant trastu-zumab in HER2-positive breast cancer[J].N Engl J Med,2011,365(14):1273-1283.
[4] 沈永康,张美华,陈文婷.曲妥珠单抗联合新辅助化疗治疗HER-2过表达乳腺癌的临床研究[J].中国医药科学,2020,10(6):69-72.
[5] De Melo Gagliato D,Jardim DL,Marchesi MS,et al. Mecha-nisms of resistance and sensitivity to anti-HER2 therapies in HER2+ breast cancer[J].Oncotarget,2016,7(39):64 431-64 446.
[6] Tormo E,Ballester S,Adam-Artigues A,et al. The miRNA-449 family mediates doxorubicin resistance in triplenegative breast cancer by regulating cell cycle factors[J].Sci Rep,2019,9(1): 5316.
[7] Yang F,FU Z,Yang M,et al. Expression pattern of micro- RNAs related with response to trastuzumab in breast cancer[J].J Cell Physiol,2019,234(9):16 102-16 113.
[8] He YJ,Wu JZ,Ji MH,et al. miR-342 is associated with estrogen receptor-α expression and response to tamoxifen in breast cancer[J].Exp Ther Med,2013,5(3):813-818.
[9] Sonnenblick A,Bailey A,Uziely B,et al. Autoimmunity and benefit from trastuzumab treatment in breast cancer:Results from the HERA trial[J].Anticancer Res,2019,39(2): 797-802.
[10] Slamon DJ,Leyland-Jones B,Shak S,et al. Use of chem-otherapy plus a monoclonal antibody against HER-2 for metastatic breast cancer that overexpresses HER-2[J].N Engl J Med,2001,344(11):783-792.
[11] 龔玉爱,舒诚荣,韩琦.曲妥珠单抗联合化疗在接受改良根治术并行术后化疗初治乳腺癌患者中的应用[J].中国当代医药,2020,27(22):83-86.
[12] Pogue-Geile KL,Song N,Jeong JH,et al. Intrinsic subtypes,PIK3CA mutation,and the degree of benefit from adjuvant trastuzumab in the NSABP B-31 trial[J].J Clin Oncol,2015,33(12):1340-1347
[13] Lipton A,Goodman L,Leitzel K,et al. HER3,p95HER2,and HER2 protein expression levels define multiple subtypes of HER2-positive metastatic breast cancer[J].Breast Cancer Res Treat,2013,141(1):43-53.
[14] Scaltriti M,Nuciforo P,Bradbury I,et al. High HER2 expression correlates with response to the combination of lapatinib and trastuzumab[J].Clin Cancer Res,2015,21(3):569-576.
[15] Hu W,Tan C,He Y,et al. Functional miRNAs in breast cancer drug resistance[J].Onco Targets Ter,2018,11:1529-1541.
[16] 张丽华,李静.曲妥珠单抗联合紫杉醇诱导过表达HER-2的乳腺癌裸鼠皮下移植瘤乳腺癌细胞凋亡的作用机制和效果研究[J].临床与实验医学杂志,2016,15(14):1373-1377.
[17] Li X,Xu YX,Ding Y,et al. Posttranscriptional upregulation of HER3 by HER2 mRNA induces trastuzumab resistance in breast cancer[J].Mol Cancer,2018,17(1):113-126.
(收稿日期:2021-08-04)

