西洋参根腐病抗性相关基因PqDELLA1的克隆及表达分析△
杨姗姗,王仪,刘紫祺,邵慧慧,高微微
中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
西洋参Panax quinquefoliusL.为五加科人参属多年生药用植物,其干燥根具有抗疲劳、提高免疫力的功能[1-2]。西洋参栽培过程中病害及连作障碍现象严重,已成为制约其种植产业发展的瓶颈问题。其中,由茄病镰刀菌(Fusarium solani)引发的根腐病是西洋参的主要根部病害,严重影响西洋参药材的产量和品质[3];该病原菌可在土壤中存活很多年,也是导致连作障碍发生的重要因素之一。目前生产上以化学防治为主的农药施用导致残留超标和抗药性等一系列问题。研究根腐病与西洋参之间的互作关系、解析西洋参的抗病机制、选育抗病能力强的品种是解决西洋参根腐病最为经济有效的策略。
转录因子在植物抵抗病原菌的过程中发挥重要作用。GRAS 蛋白是一类植物特有的转录因子家族,广泛存在于各高等植物中[4-6],在植物根发育、侧枝形成、光信号转导、赤霉素(gibberellin,GA)合成等方面发挥着重要作用[7-9]。GRAS 蛋白可分为SCL9、SCR、DELLA、SHR、LAS 等亚家族,其中DELLA 蛋白是GA 信号系统的一个重要的负调控蛋白。GA是植物主要激素之一,不仅可促进植物细胞生长发育,其在植物抗病方面也发挥着重要的作用[10-11]。与GA 合成相关的DELLA 蛋白作为转录因子在植物的生长发育及抵御各种胁迫的过程中均发挥着不可替代的重要作用[12]。然而,目前针对DELLA基因的研究多集中在种子萌发、茎伸长、根形成等[13-15]植物生长发育的作用方面,虽然有报道DELLA基因可提高拟南芥对丁香假单胞菌DC3000的敏感性[16],但该基因对植物抗病反应的影响报道很少。
为探究DELLA蛋白是否参与西洋参抗病原菌侵染过程,本研究在对西洋参进行转录组测序的基础上,经分析比对获得可响应茉莉酸诱导的F01_transcript_39804 转录本。以此为模板设计引物,以西洋参互补脱氧核糖核酸(cDNA)为模板,扩增获得西洋参DELLA基因,对其编码蛋白理化性质、蛋白结构、系统发育树等进行生物信息学分析,并对其表达部位及F.solani侵染下的表达模式进行分析,为通过基因工程手段提高西洋参抗根腐病提供参考。
1 材料
1.1 植物
2 年生西洋参根采自山东威海文登传福参业有限公司小英种植基地,于中国医学科学院药用植物研究所温室25 ℃、26 h 光照/8 h 黑暗条件下栽培。取西洋参根、茎、叶组织于液氮中速冻并于–80 ℃冰箱保存,用于检测基因组织特异性。西洋参接 种F.solani后第0、1、3、5、8、13 天取样,液氮速冻并于–80 ℃冰箱保存,用于检测F.solani对寄主西洋参基因表达的影响。
1.2 菌株与载体
F.solani(4171 菌株)为本实验室分离鉴定并保藏;大肠埃希氏菌DH5α感受态购自北京康润诚业生物科技有限公司;pYBA1132 植物表达载体为中国农业科学院植物保护研究所王国梁研究员实验室馈赠。
1.3 试剂
Q5®超保真DNA 聚合酶、限制性内切酶和质粒小提试剂盒购自北京江晨文轩生物科技有限责任公司;Clone Express®ⅡOne Step Cloning Kit 购自南京诺唯赞生物科技股份有限公司;Taq酶和StarPrep快速DNA 胶回收试剂盒购自北京康润诚业生物科技有限公司;dNTP Mixture、Reverse Transcriptase M-MLV(RNase H-)、Recombinant RNase Inhibitor、Recombinant DNase Ⅰ(RNase-free)和TB Green®Premix ExTaq™Ⅱ(Tli RNaseH Plus)购自北京六合通经贸有限公司;Trizol 购自Thermo Fisher Scientific公司。
1.4 仪器
Veriti DX 型聚合酶链式反应(PCR)仪(美国Applied Biosystems 公司);DYCP-31DN 型核酸电泳仪(北京六一生物科技有限公司);CFX96型实时荧光定量PCR(real-time quantitative PCR,qPCR)仪(美国伯乐公司);ND-1000 型超微量分光光度计(美国NanoDrop公司)。
2 方法
2.1 总RNA的提取及cDNA的合成
取西洋参各部分组织于液氮中迅速研磨,利用Trizol试剂法提取西洋参根、茎、叶等不同部位,以及F.solani侵染不同时间后的西洋参总RNA,用1%琼脂糖凝胶电泳检测RNA 的完整性,用超微量分光光度计测定其浓度和纯度,并利用反转录酶将其反转成单链cDNA。
2.2 PqDELLA1基因的克隆及载体的构建
2.2.1PqDELLA1基因的克隆 设计引物(1132-PqDELLA1-F:5'-CGCTCTAGAACTAGTGGATCCAT GGTTACAAAGAGAGATCGCG-3';1132-PqDELLA1-R:5'-GGGCCCCCCCTCGAGGTCGACTGGATCCTCG ACGGCGA-3'),以西洋参cDNA 为模板,扩增PqDELLA1序列。按如下比例配制反应体系:ddH2O 28.5 µL,5×Q5 Buffer 10 µL,dNTP mix(2.5 mmol·L–1)4 µL,1132-PqDELLA1-F、1132-PqDELLA1-R各2.5µL,Q5酶0.5µL,模板2µL;反应条件:98 ℃,30 s;98 ℃,10 s;60 ℃,30 s;72 ℃,1 min 30 s;35个循环;72 ℃,2 min;4 ℃,10 min。参照StarPrep 快速DNA 胶回收试剂盒说明书回收PCR产物。
2.2.2 pYBA1132 载体的酶切 提取pYBA1132 质粒,并用BamHI/SalI 进行双酶切,酶切体系及条件如下:pYBA1132 1µg,BamHI-HF、SalI-HF各1µL,10×CutSmartBuffer 5 µL,加ddH2O 至50 µL;酶切条件为37 ℃,4 h。
2.2.3 pYBA1132载体与PqDELLA1基因的连接 采用无缝克隆技术(in-fusion cloning)[17-18]将PqDELLA1基因连接到pYBA1132 植物表达载体上。连接体系如下:5×CEⅡBuffer 4 µL,双酶切后的pYBA1132 50~200 ng,PqDELLA120~200 ng,Exnase®Ⅱ2µL,加ddH2O 至20 µL;连接条件为37 ℃,30 min,冰浴5 min。
2.2.4 转化及测序 转化大肠埃希氏菌DH5α感受态,筛选阳性克隆,由北京六合华大基因科技有限公司测序。
2.3 PqDELLA1基因生物信息学分析
利用BioXM 2.6 分析PqDELLA1基因编码的氨基酸序列;利用NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析PqDELLA1 蛋白的保守结构域;利用ProtParam(https://web.expasy.org/protparam/)进行氨基酸理化性质的分析;利 用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测PqDELLA1蛋白信号肽;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测PqDELLA1蛋白跨膜结构;利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)检索PqDELLA1同源蛋白;利用DNAMAN 进行同源序列比对;通过MEGA 6.0 使 用Maximum Likelihood(RaxML)方法并将bootstrap 设为1000 次构建系统发育树;利用PSORT(http://psort1.hgc.jp/form.html)预 测PqDELLA1蛋白的亚细胞定位;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)和 SWISS-MODEL(https://swissmodel.expasy.org/interactive)在线软件对PqDELLA1蛋白的二级、三级结构进行分析。
2.4 qPCR分析
利用qPCR仪分析PqDELLA1基因在西洋参不同组织部位及F.solani侵染不同时间下的表达模式。利用Primer Premier 5.0 设计PqDELLA1荧光定量特异引物(5'-CACCGCTATTATCCCTTCCG-3'/5'-TTG CTCTCAAATCATACTCCGAA-3'),按 照SYBR®Premix EXTaq™Ⅱ试剂盒说明书操作。反应条件如下:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;40 个循环;95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。以西洋参持家基因之一PqGAPDH(5'-CAAAGACTGGA GAGGTGGAAGAG-3'/5'-TGCAGGTAGCACTTTAC CAACAG-3')为内参,利用2–ΔΔCt法计算PqDELLA1相对表达量。所有样品设置3 个技术重复和生物学重复,利用t检验进行显著性分析。
3 结果与分析
3.1 PqDELLA1基因的克隆
以cDNA 为模板,以1132-PqDELLA1-F/1132-PqDELLA1-R 为引物,扩增得到大小为1700 bp左右的单一特异条带(图1),利用无缝克隆技术获得重组载体pYBA1132-PqDELLA1,测序结果表明PqDELLA1基因的CDS 序列长1743 bp(此处扩增未加终止密码子,大小为1740 bp),与本实验室转录组数据库中序列一致。

图1 PqDELLA1基因PCR产物琼脂糖凝胶电泳
3.2 PqDELLA1基因生物信息学分析
3.2.1 序列分析 通过BioXM 2.6 软件分析获得PqDELLA1基因编码的氨基酸序列(图2A)。通过ProtParam 在线软件预测分析PqDELLA1 蛋白理化性质,结果表明该蛋白(C2795H4409N777O874S32)由580 个氨基酸组成,负电荷氨基酸75个,正电荷氨基酸51个,其相对分子质量为63 910,理论等电点为5.01,不稳定系数为48.70,为不稳定蛋白,平均亲水系数为–0.249。Blastp 结果发现,PqDELLA1 蛋白包含DELLA(41~103)及GRAS 保守结构域(216~573)(图2B)。

图2 PqDELLA1蛋白的氨基酸序列及保守结构域分析
使用SignalP 5.0 软件对PqDELLA1 进行分析,结果发现PqDELLA1 蛋白不含信号肽,为非分泌性蛋白(图3A)。使用TMHMM 在线预测结果表明PqDELLA1 不含跨膜区(图3B),说明PqDELLA1不是跨膜蛋白。以上预测结果说明PqDELLA1 符合其作为一个转录因子调控基因表达的基本特性。
图3 PqDELLA1蛋白信号肽及跨膜结构域分析
3.2.2 蛋白结构分析 用SOPMA 对PqDELLA1 蛋白进行二级结构预测,结果表明α螺旋是构成西洋参PqDELLA1 蛋白结构的重要组成部分,占比为45.69%;其次是无规卷曲和β转角,占比分别为37.41%和5.69%(图4A)。用SWISS-MODEL 对PqDELLA1 蛋白进行三级结构预测,结果与二级结构预测结果一致,含有大量的α螺旋、无则卷曲和β转角。PqDELLA1 蛋白的39~103 个氨基酸的三级结构与2zsh.1.B 模板相似度为64.52%,覆盖度为16%,为DELLA 蛋白GAI结构域,是DELLA 被GA受体识别的结构基础(图4B);PqDELLA1 蛋白的208~574 个氨基酸的三级结构与5hyz.1.A 模板相似度为34.07%,覆盖度为62%,为GRAS 转录因子家族所含结构域(图4C)。由此可推测PqDELLA1 蛋白为含有DELLA 结构域的GRAS转录因子,具有该蛋白家族相似的生理调控功能。PSORT 在线软件分析显示,PqDELLA1 蛋白最可能定位于植物细胞核中,符合转录因子的基本特征(图4D)。

图4 PqDELLA1蛋白结构及亚细胞定位分析
3.2.3 同源性及系统进化分析 将西洋参PqDELLA1与拟南芥DELLA、番茄SlDELLA、葡萄VvGAI1、水稻OsSLR1[19-21]的核苷酸及氨基酸序列进行系统进化及同源性分析,结果显示,西洋参PqDELLA1 与番茄SlDELLA 在核苷酸水平及氨基酸水平上均聚为一支,相似度最高,核苷酸相似度为64.89%(图5A),氨基酸相似度为67.93%(图5B)。
3.3 PqDELLA1基因组织表达特征分析
采用qPCR方法对西洋参根、茎、叶各组织进行PqDELLA1基因表达差异分析。结果表明,PqDELLA1在西洋参不同组织中均有表达,叶片中表达量最高,其次为茎,根中最少,茎和叶中的表达量与根中相比差异有统计学意义(P<0.05),分别增加83.17%和138.12%(图6)。以上结果说明PqDELLA1主要在叶中的表达量最高,远高于其他组织。
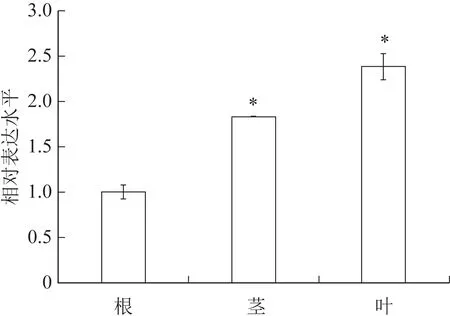
图6 PqDELLA1基因的组织特异性表达(,n=3)
3.4 F.solani对PqDELLA1基因表达的影响
F.solani侵染后西洋参中PqDELLA1基因的表达呈现先增加后降低的趋势,以F.solani侵染后0 d为参照,侵染后3 d基因表达量与其相比开始差异有统计学意义(P<0.05),5 d 基因表达量达到最高,是0 d 该基因表达量的2.26 倍,8 d 后基因表达量恢复到正常水平(图7)。以上结果说明PqDELLA1基因响应F.solani的侵染,西洋参PqDELLA1基因可能参与其抗病反应。
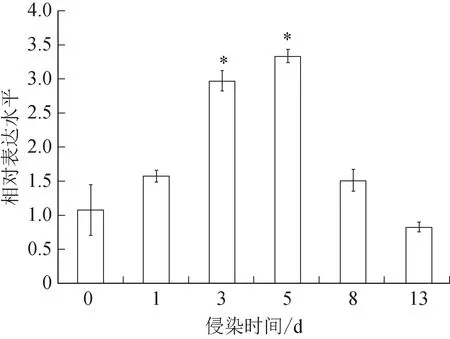
图7 PqDELLA1基因在F.solani侵染下的表达模式(,n=3)
4 讨论
DELLA蛋白是GA信号通路的一种重要抑制子,通过与不同的调控蛋白发生相互作用参与信号传导,从而抑制植物生长[19]。例如,葡萄DELLA基因突变导致葡萄节间缩短从而表现出极度矮化现象[22]。已报道人参中存在的DELLA 亚家族基因(PgGRAS44-04、PgGRAS48-01、PgGRAS50-01和PgGRAS68-01),参与GA信号途径,响应GA处理且不同GA浓度条件下表达量存在差异[23]。另外,DELLA 蛋白也与多种转录因子相互作用参与植物激素的信号调节,在植物生命活动中发挥重要作用,近年来有少量其参与植物抗病的报道。例如,拟南芥DELLA蛋白能够参与水杨酸信号途径,进而调控植物对病原菌的抗性[24]。Navarro等[16]研究发现AtDELLA蛋白通过平衡茉莉酸和水杨酸信号来控制植物的免疫反应,使得植物对不同致病菌的抗性发生改变,从而提高拟南芥对丁香假单胞菌DC3000 的敏感性。另外,李小林[25]通过烟草瞬时表达发现,MeDELLA蛋白可提高木薯胼胝质的累积和相关抗病基因的表达,从而增强木薯对枯萎病菌的抗性。
本研究首次从西洋参中获得DELLA 蛋白基因PqDELLA1,并对其进行了生物信息学及表达模式分析。组织表达特异性分析发现,PqDELLA1基因表达量在叶片中最高,其次为茎,根中最少,提示西洋参不同部位均发挥重要作用。面对F.solani的侵染,西洋参PqDELLA1基因表达模式出现较为有趣的现象,其表达在接种F.solani5 d内持续升高后下降。也进一步说明植物与病原的协同进化,植物产生各种抗病蛋白抵抗真菌的侵染,与此同时,真菌也会分泌效应蛋白来抑制抗性基因的表达,这是一个此起彼伏的动态变化过程[26]。因此,笔者推测在西洋参与F.solani互作初期,为了抵抗F.solani的侵染,西洋参PqDELLA1基因表达量上升,但是此时F.solani为了抵抗西洋参的防御反应分泌多种效应蛋白,其中某些效应蛋白可抑制西洋参免疫反应,影响PqDELLA1基因的表达,因此其表达量下降。这与之前报道的拟南芥和木薯中DELLA基因参与植物的抗病反应是一致的[16,25]。本研究发现了西洋参中PqDELLA1基因可能参与抗F.solani,这为解析西洋参抗根腐病的分子机制提供了参考。

