尼达尼布治疗特发性肺纤维化的长期疗效及安全性:单中心参与INPULSIS及INPULSIS ON的系列病例分析
丁 旻 李佳旻 洪群英 毛若琳 崔 博 马 圆 陈智鸿△
(1复旦大学附属中山医院呼吸与危重医学科 上海 200032;2江西丰城人民医院呼吸与危重医学科 丰城 331100)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一类病因不明,以进行性呼吸困难和肺功能恶化为特征的疾病。其临床特点是呼吸困难和肺功能进行性恶化,主要表现为限制性通气功能障碍和气体交换障碍,导致低氧血症甚至呼吸衰竭,其肺组织学和胸部高分辨率CT(high resolution computed tomography,HRCT)表现为普通型间质性肺炎(usual interstitial pneumonia,UIP),是一种临床病程多变、预后差的复杂疾病。回顾性研究提示,IPF 从确诊到死亡的中位生存期为2~3 年[1],5 年生存率为20%~40%[2]。除了肺移植以外,IPF 尚无有效的治疗方法,在目前国内供体稀缺及既往抗肺间质纤维化的药物疗效欠佳的情况下,我们希望找到更有效的药物治疗,使IPF 患者获益。尼达尼布为近年来基于IPF 新的发病机制研制的一种药物,它是一种小分子、多靶点的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),能够抑制血小板来源生长因子受体(platelet-derived growth factor receptor,PDGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)和血管内皮生长因子(vascular endothelial growth factor receptor,VEGFR),通过竞争性结合这些受体的ATP结合位点,干扰IPF 患者肺成纤维细胞的增殖、迁移和分化,具有较好的治疗效果。根据2015 年美国胸科学会/欧洲呼吸学会/日本呼吸学会/拉丁美洲胸科协会(ATS/ERS/JRS/ALAT)特发性肺间质纤维化治疗指南更新,尼达尼布首次被有条件推荐使用[3]。美国FDA于2014年10月15日批准尼达尼布用于IPF治疗;欧盟EMA 按照快速审批通道也于2015 年1 月15 日批准了尼达尼布用于IPF 适应证。2016 版《特发性肺纤维化诊断和治疗中国专家共识》将IPF 治疗药物分为酌情推荐和不推荐使用两大类,尼达尼布为酌情推荐使用的药物,且指出尼达尼布能显著延缓用力肺活量(forced vital capacity,FVC)的下降速度,可能在一定程度上降低死亡率[4]。复旦大学附属中山医院于2012年7 月起参加国际多中心尼达尼布治疗IPF 的为期52周的随机双盲Ⅲ期临床试验(INPULSIS)及其后的延展期临床试验(INPULSIS ON),持续进行了为期9 年的观察。随访后揭盲对比两组患者用力肺活量(FVC绝对值及FVC%pre)、一氧化碳弥散量(DLCO%pre)、圣乔治评分(St George's Respiratory Questionnaire,SGRQ)的变化、急性加重次数、生存情况、不良反应等方面,以进一步验证尼达尼布治疗IPF的疗效和安全性。
资料和方法
纳入和排除标准纳入标准:符合2011 年ATS/ERS/JRS/ALAT 诊断标准确诊为IPF 并处于稳定期的患者,男女不限,患者肺功能满足用力肺活量占预计值百分比(FVC%pre)≥50%,一氧化碳弥散量占预计值百分比(DLCO%pre)为30%~79%。排除标准:(1)有明显肺部感染需抗感染治疗;(2)有严重其他系统疾病和脏器功能不全;(3)患有恶性肿瘤;(4)有明显肝、肾功能损害,丙氨酸转氨酶(ALT)/天冬氨酸转氨酶(AST)>1.5 倍正常值上限。本研究经复旦大学附属中山医院伦理委员会审核通过(Ⅲ期临床试验伦理批件号:2012-10;延展期临床试验伦理批件号:2013-31),所有入组患者均签署知情同意书。
研究对象及一般情况纳入2012 年7 月—9 月间在复旦大学附属中山医院呼吸科门诊就诊的8 例IPF 患者,和2013 年9 月由其他中心转入的2 例IPF患者,共纳入10 例IPF 稳定期患者。其中男性8 例、女性2 例,年龄59~72 岁,平均年龄(66.3±3.8)岁;病程0.5~5.0 年,平均病程(2.9±1.8)年;10 例患者均有气促症状,伴干咳7 例,体重减轻6 例;有合并症8 例;有吸烟史4 例;FVC 平均值为(2.4±0.6)L;FVC%pre 平均值(71.9±15.2)%;DLCO%pre 平均值 为(44.0±12.4)% ;SGRQ 评 分 平 均 值33.1±15.7。揭盲后提示10 例患者按随机双盲原则分为试验组(6 例)与对照组(4 例)。两组患者性别、年龄、病程、吸烟情况、治疗前肺功能情况(FVC、FVC%pre、DLCO%pre)、SGRQ 评分情况等组间差异均无显著意义(P>0.05,表1)。
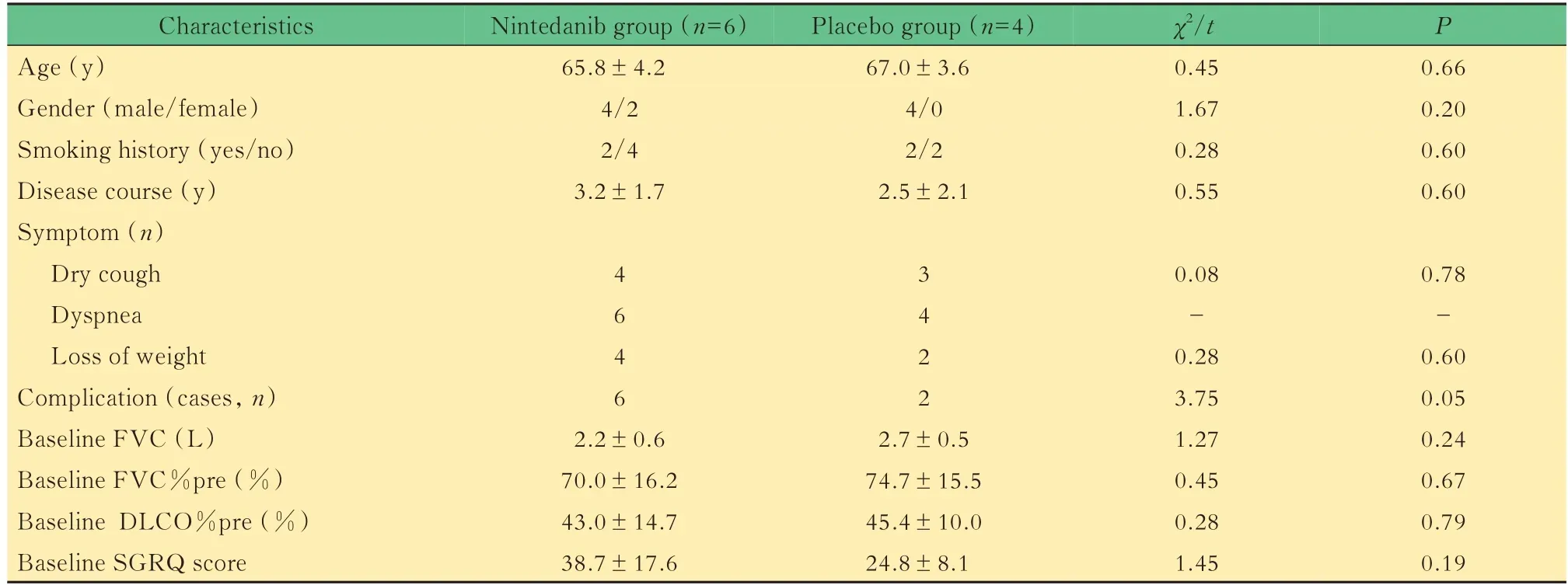
表1 尼达尼布组和安慰剂组IPF 患者基线资料比较Tab 1 Baseline characteristics of IPF patients in nintedanib group and placebo group IPF patients
治疗方法在Ⅲ期临床试验中对照组给予安慰剂治疗,试验组给予尼达尼布胶囊(规格:每粒150 mg,餐后服用,每次1 粒,每日2 次)。若有急性加重则立即予加用对症治疗。患者在该研究阶段第2、4、6、10、12、16、24、36、52 周到医院接受随访,观察患者症状体征变化,评估临床疗效,记录不良反应发生情况。主要评估指标为FVC、FVC%pre、DLCO%pre 和SGRQ评分,观察治疗前后评估指标的变化,并统计两组患者急性加重及不良反应发生情况。同时进行实验室检查,包括血、尿常规,肝、肾功能,血糖,电解质等。完成52 周治疗期和4 周后随访访视的患者进入延展期临床试验,延展期对照组及试验组均给予尼达尼布(150 mg 每日2 次,在服药过程中,允许通过降低剂量至100 mg 每日2 次或者中断治疗来管理不良事件;并允许将剂量重新递增至150 mg 每日2 次)治疗,每隔半年面诊或者电话随访,记录患者肺功能、症状变化、急性加重次数及生存情况。
统计学方法应用SPSS 19.0 软件进行统计学分析。正态分布的计量资料用±s表示,组间的比较采用t检验。计数资料的比较采用Fisher 精确检验。生存分析采用Kaplan-Meier 法,P<0.05 为差异有统计学意义。
结 果
临床结果在第一阶段中,试验组有1 例患者、对照组有2 例患者在1 年内退出试验,没有年度数据,但仍参与了生存访视。其余患者治疗后试验组FVC%pre 年下降率为2.1%,对照组为4.9%;试验组FVC 下降趋势相对较缓(图1A),DLCO%pre 的年下降率(图1B)及SGRQ 评分变化两组无明显差异。共发生6 例急性加重,试验组3 例,对照组3 例。试验组不良反应发生率为50.0%(3/6),多为腹泻、腹部不适,程度多为轻至中度,未出现因不良反应导致停药或减量的情况(表2)。

表2 尼达尼布组和安慰剂组IPF 患者临床结局比较Tab 2 The clinical outcome of IPF patients in nintedanib group and placebo group IPF patients
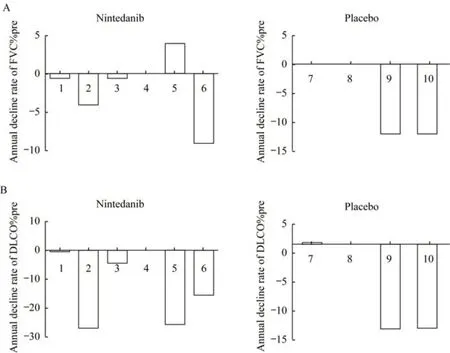
图1 尼达尼布组和安慰剂组IPF 患者FVC% pre 和DLCO% pre 年下降率Fig 1 FVC% pre annual decrease rate and DLCO% pre annual decrease rate of nintedanib group and placebo group
随访情况 在为期9 年的随访中,10 例患者有8例死亡,其中试验组4 例(4/6),对照组4 例(4/4)。死亡原因包括IPF 急性加重、肺腺癌、急性脑梗死、ANCA 相关性血管炎。其中合并ANCA 相关性血管炎患者在入组时ANCA 检测阴性,当时诊断IPF入组该试验,但在后续随访中疾病进展时出现ANCA 检测阳性,治疗中未使用免疫抑制剂。用Kaplan-Meier 生存曲线分析发现试验组有生存优势(图2),但差异无统计学意义。
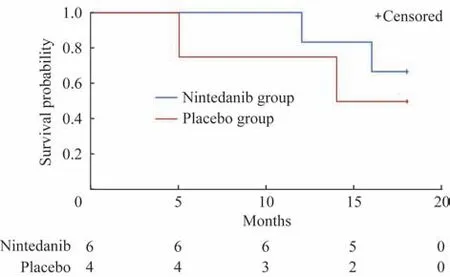
图2 尼达尼布组和安慰剂组IPF 患者Kaplan-Meier 生存分析Fig 2 Kaplan-Meier survival analysis of IPF patients in the nintedanib group and placebo group
有2 例长期生存的受试者(表3),均为试验组患者,且均为女性。1 例服用尼达尼布至今,1 例服用尼达尼布1.5 年后因腹泻退出研究。长期追踪2 例患者的肺功能发现,长期服用尼达尼布者FVC 及FVC%pre 更稳定,1 例患者第8 年时复 查FVC%pre下降程度达到25.2%(图3)。停药患者在随访过程中出现5 次急性加重,住院治疗1 次,目前只能居家活动,24 h 持续吸氧。而坚持服用尼达尼布的患者未发生急性加重,日常生活能力正常。且该患者对尼达尼布耐受良好,未出现需要药物减量或停药的不良反应。
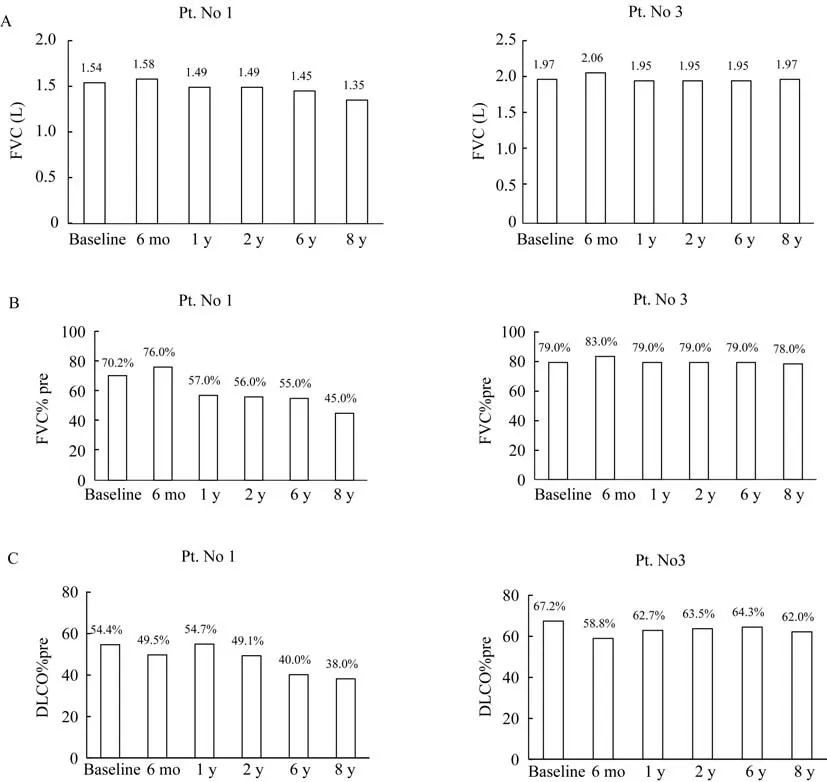
图3 2 例长期生存的IPF 患者8 年间肺功能变化Fig 3 Changes of pulmonary function in 8 years of two long-term survival IPF subjects
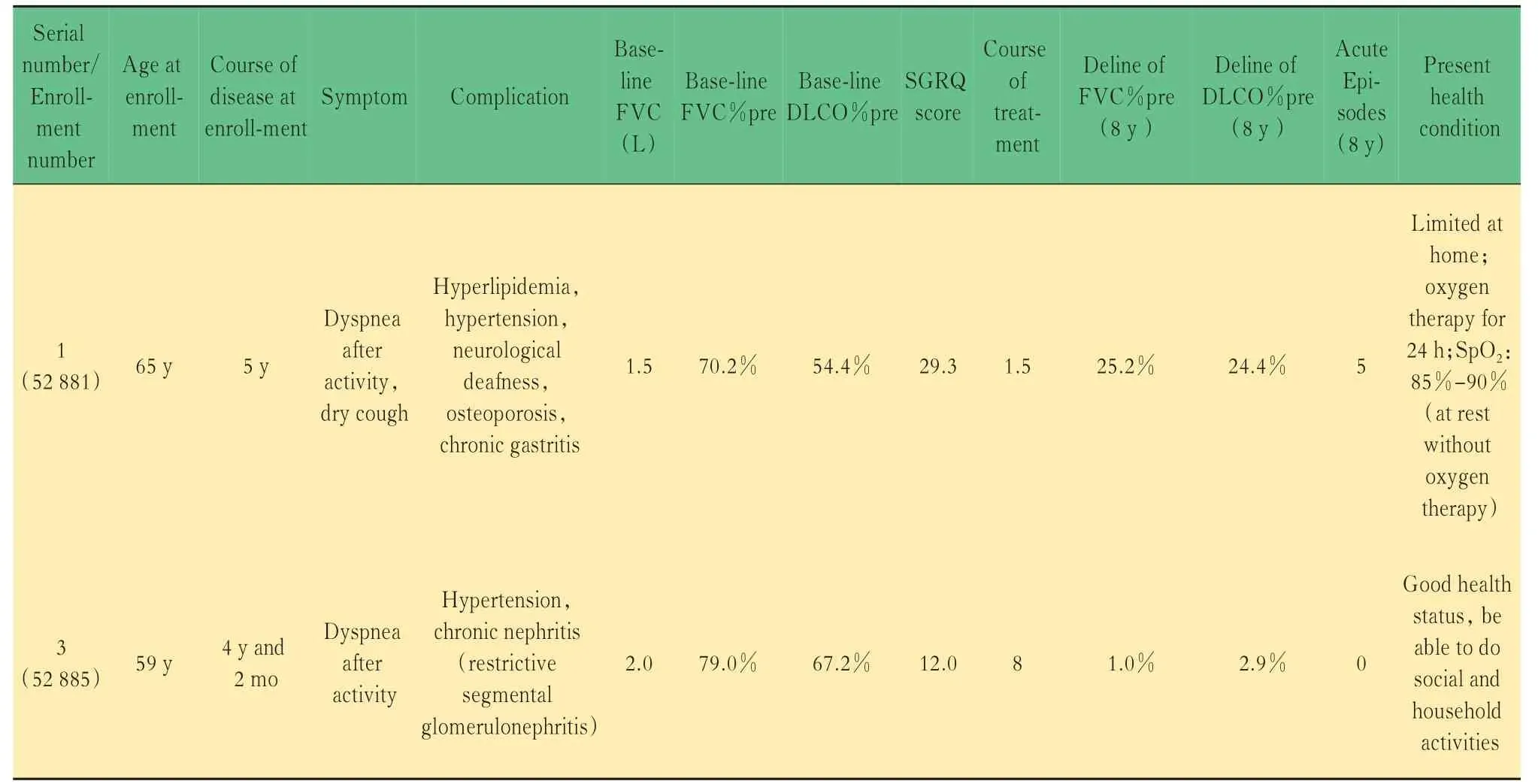
表3 2 例长期生存的IPF 患者基本情况比较Tab 3 Comparison of two long-term survival IPF subjects
讨 论
IPF 是一种复杂的多因素所致的疾病,患者肺部随着时间的推移出现瘢痕性改变,实质为上皮细胞损伤和成纤维细胞活化所致的炎症反应等共同作用的结果,它导致肺功能不可逆持续性下降,主要表现为限制性通气功能障碍,肺活量减少。IPF患者一旦出现急性加重,会显著增加死亡风险。IPF 的发病机制迄今为止仍不明确,且治疗措施有限,为目前的医疗难题之一,我国也缺乏相关的创新性研究。国外关于IPF 的临床研究主要以FVC为主要观察指标,提示FVC 绝对值或FVC%pre 的下降率与IPF 急性加重、死亡率、更多的医疗资源使用有关,如果能缓解FVC%pre 的下降率,将改善IPF 的预后。在本研究中,入选患者FVC%pre 为52%~85%,根据澳洲及新西兰胸科学会推荐,FVC%pre>50%者为 “轻-中度IPF”[5]。本研究中使用尼达尼布治疗后试验组FVC 下降较对照组减少,FVC%pre 年下降率试验组低于对照组,提示尼达尼布有延缓IPF 患者FVC 下降的作用,这与2014和2016 年发表的INPULSIS-1 和INPULSIS-2 两项Ⅲ期研究结果相一致[6-7]。 2011年发表的TOMORROW 研究显示,使用任何尼达尼布治疗剂量的IPF 患者,急性加重的次数均较低[8],而在本研究中,长期生存患者坚持服用尼达尼布者急性加重次数显著减少。来自Ⅱ期TOMORROW 研究和两项Ⅲ期INPULSIS 研究联合数据汇总分析显示:与安慰剂组相比,接受尼达尼布治疗的患者全因死亡风险下降30%[9],在本研究的随访中,试验组更有生存优势。另外在本研究中,两组患者DLCO 及SGRQ 问卷评分治疗前后变化无显著差异,可能与入组人数偏少有关,也反映FVC 的下降率是临床预后更为有效、可行的判断指标。
在安全性方面,尼达尼布在消化系统常见的不良反应包括腹泻、恶心、呕吐、胃肠功能紊乱及肝脏酶学增高,相关研究发现试验组与对照组在消化系统的不良反应发生率会增加,尤其是腹泻,但大多轻度、可逆[10]。本研究中试验组患者出现的不良反应与已发布的INPULSIS 研究中报告的类似,多为轻至中度,患者多可耐受,未出现需要药物减量或停药的不良反应,提示尼达尼布在IPF 患者中耐受性良好。且到目前为止,尚无实验或临床证据发现尼达尼布耐药的发生[11],因此长期使用尼达尼布治疗IPF 是可以接受的。
综上所述,目前常规治疗对IPF 效果欠佳,而尼达尼布在减缓IPF 患者疾病进展和预防急性加重方面具有有益的作用,安全性可接受,在轻-中度IPF患者的早期治疗将带来更多的好处和更好的预后,是治疗IPF 安全有效的药物,值得临床推荐。当然,从现有临床试验结果看,尼达尼布仅延缓肺功能下降速度,并不能完全阻止疾病进展,更不能逆转疾病,且尼达尼布对严重的疾病(FVC%pre<50%)或疾病急性加重患者的疗效尚不清楚。
本研究入组的小样本试验组有延缓IPF 患者FVC 下降的结果与两项国际多中心Ⅲ期研究结果相一致。我们的长期追踪观察发现IPF 作为一种不可逆的罕见病,预后仍然很差,但女性患者具有一定生存优势,尼达尼布长期口服耐受性较好。本单中心所揭示的数据尽管没有统计学差异,但与IMPLUSIS 研究总体人群结果的趋势均一致,提示我们在罕见病研究中可以先设计一些小样本试验,得到一些有启示效应的结果,为将来开展大规模临床研究提供思路和方向,因此对罕见病而言仍不能忽视单中心的力量。
作者贡献声明丁旻,李佳旻 数据整理和分析,论文撰写和修订。毛若琳,崔博,马圆 数据收集。洪群英,陈智鸿 研究设计,数据收集,论文修订。
利益冲突声明所有作者均声明不存在利益冲突。

