FibroScan-AST评分对具有显著活动性和纤维化的非酒精性脂肪性肝炎患者的诊断效能
赵钢德, 郭斯敏, 谢 青, 桂红莲
上海交通大学医学院附属瑞金医院 感染科, 上海 200025
非酒精性脂肪性肝病(NAFLD)已成为全球性的公共卫生问题之一,荟萃分析显示其在中国的流行率达29.2%[1]。其中非酒精性脂肪性肝炎(NASH)因其进展为肝硬化、肝细胞癌的风险更高而受到临床关注。影响肝脏相关临床结局的主要组织学因素包括NASH活动性和纤维化分期[2],前者由NAFLD活动性积分(NAS)评估。鉴于整个疾病状态由这两者组合而成,识别具有NAS≥4和F≥2的NASH(以下简称高危NASH)患者具有重要的临床意义。肝活检目前仍是诊断NASH的“金标准”,但其存在有创性、依从性差、取样误差和评价误差等局限性。因此,针对NAFLD患者如何建立有效的无创模型识别高危NASH,减少非高危患者不必要的肝活检,一直是临床亟需解决的问题。
近期英国研究者采用瞬时弹性扫描仪(FibroScan)测量肝脏硬度值(LSM)和受控衰减参数(CAP),结合AST建立的新模型FibroScan-AST(简称FAST)可有效识别高危NASH患者[3]。但目前尚缺乏更大范围的外部验证和比较研究,也不明确某些代谢危险因素如肥胖或糖尿病等是否影响其效能。因此,本研究旨在外部验证FAST的诊断效能,与其他已用于NASH肝纤维化的无创诊断包括NAFLD肝纤维化评分(NFS)、FIB-4指数和AST-血小板(PLT)比值(APRI)评分[4-5]进行比较,并采用亚组分析明确人口学数据和代谢因素对其效能有无影响。
1 资料与方法
1.1 研究对象 回顾性纳入2015年1月—2020年12月在本科室住院并经肝组织病理学证实为NAFLD/NASH患者84例。每例患者临床、生化及血液学数据均采集自肝活检当天或1周内,且每例患者病史资料记录完整,并排除合并病毒性肝炎、自身免疫性肝病、酒精性肝病、药物性肝炎等其他急慢性肝病。
1.2 肝脏组织病理学检查 所有肝脏组织标本均由经验丰富且对LSM和CAP检测结果不知情的病理医师按照NASH临床研究网络病理委员会(NASH-CRN)制定的NAS分级系统进行病理学诊断,包括NAS积分(总分0~8)和肝纤维化分期(F0~4)[6]。根据病理诊断,将“高危NASH”定义为NAS≥4伴F≥2;“边缘高危NASH”定义为NAS=3伴F≥1,或NAS≥3伴F=1;“非高危NASH”定义为任何NAS积分伴F=0,或NAS≤2伴任何F分期。
1.3 FibroScan检查 所有检测均由持有操作资格证书的人员在肝活检当天或1周内完成。探测10个有效结果,有效检测次数/总检测次数≥60%,结果用中位数表示,并要求四分位数/中位数比值≤30%。仪器采用法国ECHOENS公司生产的FibroScan 502,探头为M型。
1.4 无创诊断模型 FAST由LSM、CAP和AST计算而来,既往研究确定的低、高分界值分别是0.35和0.67[3]。NFS包括年龄、BMI、是否有胰岛素抵抗或糖尿病、AST、ALT、PLT和血清白蛋白;FIB-4包括年龄、AST、ALT和PLT;APRI则由ALT和PLT计算而来。需要特别指出的是,FAST为排除和/或确诊高危NASH而专门设计;NFS、FIB-4和APRI则用于诊断肝纤维化(F≥3),其低、高分界值依次分别是-1.455和0.676,1.30和2.67,0.57和0.84[4-5]。
1.5 分类准确性指标定义 为明确分类准确性,参考既往研究[7],在排除区间,将“正确分类”定义为NAS≤3伴任何F分期,或F≤1伴任何NAS积分;“交界分类”定义为NAS≥4伴F=2,或NAS=4伴F≥2;“错误分类”定义为NAS≥5伴F≥3。在确诊区间,将“正确分类”定义为NAS≥4伴F≥2;“交界分类”定义为NAS≥3伴F=1,或NAS=3伴F≥1;“错误分类”定义为任何NAS积分伴F=0,或NAS≤2伴任何F分期。
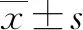
2 结果
2.1 研究人群基本特征 84例NAFLD患者中,女54例,男30例,平均年龄(45.3±14.6)岁,超重/肥胖(BMI>24 kg/m2)者59例,肥胖(BMI>28 kg/m2)者20例,合并2型糖尿病14例。CAP和LSM分别为282(193~376)dB/m和8.7(4.0~28.0)kPa。
2.2 肝活检结果 所有标本可供评估的小叶范围都达到10个以上。所有患者NAS是5.5(3.0~7.0),NAS≥4者81例;肝纤维化分期(F0~4)分布依次为13、28、22、16和5例,F≥2者43例。同时满足NAS≥4和F≥2的高危NASH患者43例。
2.3 FAST与肝纤维化分期的相关性分析 所有患者FAST为0.54(0.04~0.93),F0~4不同肝纤维化分期的FAST依次为0.26(0.06~0.73)、0.48(0.04~0.82)、0.61(0.13~0.75)、0.64(0.09~0.93)和0.82(0.75~0.89),尽管各肝纤维化分期的FAST值互有重叠,但差异仍有统计学意义(H=23.236,P<0.001)。FAST与肝纤维化分期呈正相关(r=0.491,P<0.001)。NFS、FIB-4和APRI与肝纤维化分期均呈正相关(r值分别为0.230、0.346和0.281,P值均<0.05),但较FAST相关性减弱。
2.4 FAST对高危NASH患者的诊断效能 FAST评估高危NASH的AUC为0.725(95%CI:0.617~0.834,P<0.001),其诊断效能和准确性分类分析见表1和表2。按既往研究确定的低分界值FAST≤0.35可使21例(25%)患者以71%的NPV来排除高危NASH,这部分患者被正确、交界和错误分类的分别是15例(包含8例F=0、7例F=1)、4例(包含3例NAS≥5伴F=2、1例NAS=4伴F=3)和2例(都是NAS=5伴F=3)。按高分界值FAST≥0.67可使19例(22.6%)以74%的PPV来确诊高危NASH,这部分患者被正确、交界和错误分类的分别是14例(包含4例F=2、5例F=3和5例F=4)、4例(都是NAS≥5伴F=1)和1例(NAS=7伴F=0)例。44例(52.4%)患者FAST介于0.35~0.67,处于不确定区间(灰区),这部分患者属于高危、边缘高危和非高危NASH的分别是23、17和4例。所以,按低高分界值排除和/或确诊高危NASH,可使40例(47.6%)患者避免进行肝活检,并且与肝活检结果相符的患者为29例,即这部分不进行肝活检的患者的诊断准确率为73%。
2.5 其他血清学模型对高危NASH患者的诊断效能 NFS和FIB-4诊断高危NASH的AUC分别为0.633(95%CI:0.513~0.753)和0.686(95%CI:0.570~0.803),P<0.05,其诊断效能和准确性分类分析见表1和表2。而APRI对高危NASH无诊断效能,AUC为0.622(95%CI:0.499~0.744,P=0.055)。

表1 FAST及其他模型排除或确诊高危NASH的效能

表2 FAST及其他模型排除或确诊高危NASH的准确性
2.6 亚组分析 FAST及其他模型的亚组分析结果如表3所示,总体而言,各亚组FAST诊断效能最佳,且不受患者年龄、性别、BMI、AST和有无糖尿病的影响。而其他模型如NFS和FIB-4在年龄≥45岁亚组的AUC明显高于年龄<45岁亚组;NFS在AST≥40 U/L亚组的AUC也显著高于AST<40 U/L亚组。

表3 FAST及其他模型诊断高危NASH的亚组分析
3 讨论
从临床实践角度而言,NAS和纤维化的组合来定义高危NASH的标准是十分重要的,因为一方面存在NASH定义的炎症和升高的NAS对于确定哪些患者可以从抗炎治疗中受益很重要;另一方面,仅存在纤维化本身也并不足以符合临床试验。本研究显示FAST这一被专门设计和优化用以评估NAFLD患者是否存在高危NASH的无创模型表现良好,且其效能不受患者年龄、性别、BMI、AST和有无糖尿病的影响。
与FAST不同的是,其他模型如FIB-4和NFS虽具有良好特异性,但其极低的灵敏度导致排除区间和灰区仍有大量高危NASH患者,即应用FIB-4评估时有32例(74%)高危NASH处于排除区间和灰区,而NFS评估时有41例(95%)。可见这些模型并不是为了鉴别高危NASH而开发——本研究提供了额外的证据证明这些模型在检测高危NASH的表现不如专门设计的FAST。
众多研究[8]已证明CAP和LSM在NAFLD患者中广泛应用,失败率低,在确定肝脏脂肪变性和纤维化程度方面表现良好,易于临床推广。最初研究者在生成FAST模型时曾试图增加其他元素(如代谢综合征参数),但这些参数表现不如增加AST,且没有证据表明增加其他元素可提高FAST的表现[3]。此外FAST评估准确性不受探头类型的影响[9]。
通常来说,临床诊断的最佳配置和相关决策阈值需针对三方面进行优化:优化下限以减少假阴性来实现可靠的排除诊断;优化上限以减少假阳性来实现可靠的明确诊断;最少数量的灰区以最大限度地实施临床决策。与其他任何预测模型一样,FAST以平衡的方式处理这些标准,但其表现更大程度上取决于所应用的人群:目标患者的偏差将影响模型的灵敏度、特异度和预测值[10]。在本研究队列中,NAS≥4者占96%,F≥2者占51%,高危NASH患者达到51%。FAST低分界值排除了诊断准确率高、假阴性分类率低的非高危NASH患者,但考虑到疾病自然史的高度可变性,结合患者个人需求、疾病进展的危险因素等,在适当的时间间隔(如1年)重复检测似乎是合理的。FAST高分界值提供了足够的高危NASH患者,这可使部分患者不必肝活检而进行治疗干预。
本研究中,FAST≥0.63或≤0.36可使一半的患者做出临床决策,但临床医生面临的最大挑战就是如何对待处于灰区的患者,这将受到个体特征、是否接近分界值(低或高)等多方面影响。在多数情况下在适当的时间间隔(如3~6个月)重复检查可能是合适的,而在其他情况下考虑一种替代方式或进行肝活检可能是有用的——此时患者自身的选择就成为关键的决定因素。值得注意的是,有证据[11]表明使用多种无创模型进行组合可以获得更好的总体分类和大幅度减少不确定结果。未来的工作将探索FAST与NFS、FIB-4或APRI相结合以进一步优化诊断流程。此外,随着血清蛋白组学等运用,新的模型如NIS4评分[7]等相继问世有望最终解决这一难题。
总之,笔者外部验证了FAST用于检测伴或不伴代谢危险因素的高危NASH(即NAS≥4伴F≥2)。应用这种无创模型将有助于更有效地从大量NAFLD患者中确定适合临床试验和新兴疗法的高危NASH患者,并减少不必要的肝活检。目前FAST评分可在免费应用程序中快速获取,且与肝活检相比更具成本效益,更容易获得患者的接受。
伦理学审查:本研究方案于2021年4月2日经由上海交通大学医学院附属瑞金医院伦理委员会审批,批号:(2021)临伦审第(79)号。
利益冲突声明:本研究不存在研究者、伦理委员会委员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:桂红莲、谢青对研究的思路或设计有关键贡献;赵钢德、郭斯敏、桂红莲参与研究数据的获取分析解释过程;赵钢德、桂红莲参与起草或修改文章关键内容。

