电针百会、神庭、足三里对胫骨骨折小鼠术后学习记忆能力的影响
陈振华,曹 莉,杨建新,孟治寿,丁仲诺
(1 山西医科大学麻醉学教研室,太原 030000;2 山西医科大学第二医院麻醉科;*通讯作者,E-mail:yangjxin66@163.com)
随着我国步入老龄化社会,老年人群骨折发生率也呈递增趋势。老年患者生理机能处于退化阶段,骨折手术后围术期神经认知障碍(postoperative cognitive dysfunction,PND)的发生率极高[1,2]。研究表明,外周炎性反应释放大量炎性物质可改变血脑屏障通透性并引发中枢炎症反应是导致PND的发病机制之一[3-5]。本课题组的前期研究发现,电针刺激人体特定穴位可降低骨折患者术后认知障碍,但相关机制并不明确[6]。为进一步探究电针刺激降低骨折术后患者认知障碍的相关机制,本研究从中枢炎症反应入手,以α7-烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor, α7nAChR)为研究对象,主要原因在于大脑内α7nAChR广泛分布于小胶质细胞表面,而小胶质细胞是脑内主要的免疫细胞,它能释放抗炎因子,减弱炎症对机体的影响,帮助修复受损组织,参与一系列以神经炎症为主要特征的神经退行性病变[7]。除此以外,小胶质细胞表面的α7nAChR在疾病进程中所起的作用日益受到关注,被认为是治疗神经系统疾病和炎症的潜在作用靶点[8,9]。本研究拟通过穴位电刺激对胫骨骨折内固定模型小鼠逃避潜伏期、穿越平台次数、相关抗炎因子(IL-4,IL-10)、促炎因子(IL-1β,TNF-α)及α7nAChR含量的影响,探讨穴位电刺激对术后认知功能障碍的相关作用机制,为临床治疗提供理论依据。
1 材料与方法
1.1 动物及其分组
6月龄SPF级成年雄性健康C57BL/6J小鼠75只,体质量(30 ±5)g,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。采用数字表法随机分为5组:对照组、胫骨骨折组(模型组)、穴位电刺激+胫骨骨折组(电针组)、α7nAChR激动剂(PNU282987)+胫骨骨折组(PNU组)及穴位电刺激+α7nAChR拮抗剂(MLA)+胫骨骨折组(MLA+电针组),每组15只。75只小鼠参与水迷宫定位巡航训练1周后对模型组、电针组、PNU组和MLA+电针组小鼠做胫骨骨折+LPS腹腔注射联合处理(LPS于术前1 h腹腔注射,剂量为200 μg/kg)。造模后第1天开始对各组小鼠加用各种刺激及药物干预如电针刺激、α7nAChR激动剂和拮抗剂等,直至处死当天。小鼠分笼饲养,12 h昼夜交替环境,温度(21 ±2)℃,湿度50%~60%。
1.2 主要试剂及仪器
α7nAChR激动剂PNU282987,α7nAChR拮抗剂MLA购于太原市正合生物科技有限公司;小鼠ELISA检测试剂盒IL-1β、IL-6、IL-4、IL-10(生产批号:202102)均购于江苏麦莎实业有限公司;α7nAChR一抗Anti-CHRNA7 antibody(生产批号:AI10143370);Morris水迷宫(成都泰盟科技有限公司);华佗牌电子针疗仪(苏州医疗用品厂有限公司);华佗牌无菌针灸针0.25 mm×13 mm(苏州医疗用品厂有限公司);脱水机(DIAPATH);包埋机(武汉俊杰电子有限公司);病理切片机(上海徕卡仪器有限公司);组织摊片机(浙江金华市科迪仪器设备有限公司);微波炉(格兰仕微波炉电器有限公司);脱色摇床(Servicebio);涡旋混合器(Servicebio);正置荧光显微镜(日本尼康)。
1.3 模型制作及各组处理
1.3.1 模型制作 结合以往的胫骨骨折模型方案[10,11]进行改良,需手术小鼠用4%水合氯醛0.01 ml/g腹腔注射,待其翻正反射消失后,备皮、消毒小鼠右下肢,在右膝关节下切开约0.5 cm纵行切口,胫骨中上1/3处分离肌肉及筋膜,用锯片横向锯断胫骨骨干后用0.9%NaCl溶液冲洗胫骨表面,由断端近端腔隙插入27G髓内针并穿透骨质,断端对合后将髓内针自穿透骨质处插入断端远端腔隙,去除暴露在外的髓内针,即完成内固定术。逐层缝合切口,制成小鼠右胫骨骨折内固定模型。术后单笼饲养,常规给水及饮食,定期紫外线消毒与排风。
1.3.2 各组小鼠的处理 造模后,参考《实验针灸学》[12],选取小鼠百会、神庭和双侧足三里穴,给与电针组和MLA+电针组的小鼠穴位电刺激。百会穴位于头顶正中线与两耳尖连线的交叉处,神庭穴位于额顶骨缝交界线前方,前正中线上,两穴均斜刺2 mm;足三里穴位于双侧腓骨小头下3.5 mm处,直刺3 mm。引发小鼠抽动反应后接电针仪,疏密波,频率2/15 Hz,强度1~3 mA。每次30 min,每天1次,直至处死当天。造模后,参考相关文献[13],PNU组小鼠腹腔注射PNU282987(4 mg/kg),MLA组小鼠腹腔注射MLA(10 mg/kg),每天1次,直至处死当天。
1.4 检测指标及方法
1.4.1 Morris水迷宫试验 该实验分训练阶段和实验阶段。训练阶段为期5 d,包括1 d的环境适应及4 d的定位航行实验,使小鼠对平台位置形成牢固记忆并使5组小鼠记忆能力处于同一水平。训练第1天将5组小鼠分别放入水迷宫自由游泳2 min,使其适应环境并剔除假死小鼠,并用备用鼠代替。训练第2~5天,从划分好4个象限的盆壁中点顺序将小鼠面向盆壁放入水中,如果小鼠在60 s内爬上平台,并停留3 s以上,则认为小鼠找到平台,此为逃避潜伏期。取4个方向逃避潜伏期的平均数作为该日数据。实验开始第6天(即术前1 d)及造模后第1,3,7天,每个时间点每组各处死3只,术后7 d额外处死3只,于每个时间点处死之前将每组余下小鼠进行实验,取平台象限的对角象限为入水点将小鼠面向盆壁放入水中,记录小鼠登陆平台所需时间。于术后第7天撤去平台,记录小鼠在目标象限内的平台穿越次数。
1.4.2 免疫荧光实验检测α7nAChR表达 术后第7天各组取3只小鼠处死,断头取出脑组织并保存于4%多聚甲醛溶液中。24 h后石蜡包埋,在小鼠海马处连续切取约6 μm厚组织切片,经脱蜡、水化后,置于盛满EDTA抗原修复缓冲液(pH8.0)的修复盒中于微波炉内行抗原修复,自然冷却后将玻片置于PBS(pH7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍干后用组化笔在组织周围画圈(防止抗体流走),甩干PBS,滴加BSA,封闭30 min。轻轻甩掉封闭液,在切片上滴加1 ∶200稀释好的一抗Chrna7,并置于湿盒内4 ℃过夜。玻片重复上述洗涤3次,每次5 min。在圈内滴加1 ∶300稀释好的荧光二抗CY3山羊抗兔覆盖组织,避光室温孵育50 min,重复上述洗涤步骤。在圈内滴加DAPI染液,避光室温孵育10 min,重复上述洗涤步骤。在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min。切片稍干后用抗荧光淬灭封片剂封片。荧光显微镜下观察切片并采集图像。
1.4.3 酶联免疫吸附剂测定IL-1β,IL-4,IL-10,TNF-α 各组于术前1 d,术后1,3,7 d各随机取3只小鼠麻醉断头取海马组织,立即冻于-80 ℃冰柜中,待标本全获取后按IL-1β、IL-4、IL-10、TNF-α的ELISA试剂盒说明书进行操作,绘制标准曲线,计算出相应的浓度值。
1.5 统计学处理
2 结果
2.1 各组小鼠不同时间点水迷宫定位巡航实验逃避潜伏期比较
术前1 d各组间逃避潜伏期无明显差异(P>0.05);与模型组相比,其余四组术后1,3,7 d逃避潜伏期均明显延长(P<0.05);与模型组相比,电针组、PNU组和MLA+电针组术后1,3,7 d逃避潜伏期均低于模型组(P<0.05);术后1,3,7 d电针组与PNU组之间逃避潜伏期无明显差异(P>0.05),术后1,3,7 d电针组与PNU组逃避潜伏期明显低于MLA+电针组(见表1)。

表1 各组小鼠4个时间点逃避潜伏期Table 1 Escape latency of mice in each group at four time points
2.2 各组小鼠术后第7天水迷宫穿越平台次数比较
与对照组相比,其余四组术后第7天穿越平台次数明显降低(P<0.05);与模型组相比,电针组,PNU组术后第7天穿越平台次数明显多于模型组(P<0.05);电针组与PNU组之间无明显差异(P>0.05);MLA+电针组与模型组之间无明显差异(P>0.05,见表2)。

表2 各组小鼠术后第7天穿越平台次数Table 2 Times of crossing the platform of mice in each group at day 7 after operation
2.3 各组小鼠不同时间点各细胞因子含量比较
结果显示术前1 d各组IL-1β、TNF-α、IL-4和IL-10含量无明显差异(P>0.05)。术后1 d与对照组相比,其余4组IL-1β、TNF-α含量均明显升高,IL-4含量均明显降低(P<0.05),IL-10含量无明显变化(P>0.05);术后1 d与模型组相比,电针组和PNU组IL-1β、TNF-α含量低于模型组,IL-4含量高于模型组(P<0.05);术后1 d,PNU组IL-4含量高于电针组(P<0.05),其余3个指标无明显差异(P>0.05);术后1 d,MLA+电针组TNF-α含量低于模型组(P<0.05),其余指标无明显差异(P>0.05)。术后3 d,与模型组相比,电针组、PNU组和MLA+电针组IL-1β、TNF-α含量远低于模型组(P<0.05),电针组和PNU组IL-4、IL-10含量远高于模型组(P<0.05);术后3 d,PNU组TNF-α含量低于电针组(P<0.05),其余3个指标无明显差异(P>0.05)。术后7 d,电针组、PNU组和MLA+电针组IL-1β、TNF-α含量明显低于模型组(P<0.05),IL-10含量高于模型组(P<0.05),电针组和PNU组IL-4含量高于模型组(P<0.05),MLA+电针组IL-4含量无明显差异(P>0.05);术后7 d电针组和PNU组之间4项指标无明显差异(P>0.05);术后7 d,MLA+电针组IL-1β含量明显高于电针组和PNU组(P<0.05),IL-4和IL-10含量明显低于电针组和PNU组(P<0.05,见表3~6)。

表3 各组小鼠四个时间点海马IL-1β含量Table 3 IL-1β content in hippocampus of mice in each group at four time points

表4 各组小鼠4个时间点海马TNF-α含量Table 4 TNF-α content in hippocampus of mice in each group at four time points

表5 各组小鼠4个时间点海马IL-4含量Table 5 IL-4 content in hippocampus of mice in each group at four time points
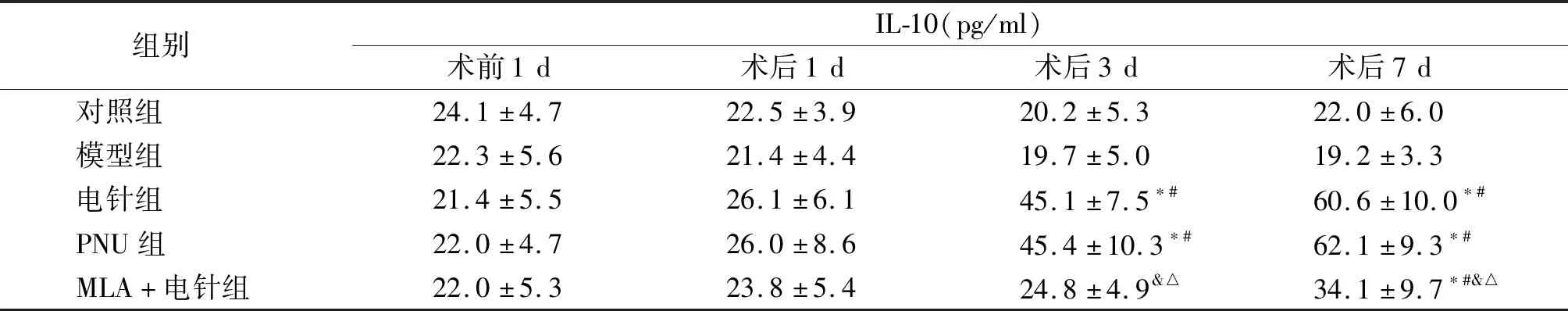
表6 各组小鼠四个时间点海马IL-10含量Table 6 IL-10 content in hippocampus of mice in each group at four time points
2.4 各组小鼠术后7 d海马内α7nAChR的表达情况
术后7 d与对照组相比,电针组、PNU组和MLA+电针组IOD及面密度均不同程度增高,模型组IOD及面密度下降(P<0.05);与电针组相比,PNU组IOD及面密度增高(P<0.05);MLA+电针组IOD及面密度远低于电针组和PNU组(P<0.05,见表7、图1)。

图1 各组小鼠术后7 d海马α7nAChR表达情况 (免疫荧光染色,×200)Figure 1 The α7nAChR expression in hippocampus of mice in each group at day 7 after operation (immunofluorescence staining,×200)

表7 各组小鼠术后7 d海马α7nAChR表达情况Table 7 The α7nAChR expression in hippocampus of mice in each group at day 7 after operation
3 讨论
老年人处在生命过程的衰老阶段,体能的退化使该类人群骨折数量每年呈递增趋势,且内科合并症较多,在骨折前部分患者已存在认知功能受损[14]。患者在经历骨折、手术和麻醉等因素刺激后,PND的发生率极高。老年患者如何平稳度过围手术期,保护其认知功能不受损害成为临床亟待解决的问题。该实验选用6月龄C57BL/6J小鼠作为研究对象是因为自然衰老小鼠培养周期长,由于个体及环境差异等原因,导致小鼠全身各脏器衰老程度达不到高度统一性,且老年小鼠对胫骨骨折内固定术耐受力弱,术后认知障碍的发生存在一定概率,故本研究在已有文献的支持上采用腹腔注射脂多糖(LPS)的方法[15],人为模拟老年小鼠胫骨骨折内固定术所致中枢炎症损伤及短期记忆能力受损,并探讨其相关机制及保护措施。造模过程中我们参照文献尝试了多种胫骨骨折内固定术[16],发现不同的手术方式对技术设备的要求、小鼠存活率、术后记忆能力的影响程度各不相同,多次尝试后,综合各方面因素,我们选取了一种有效的造模方法,即小鼠胫骨稳定性骨折模型。为排除手术对小鼠运动能力的影响,我们在正式试验之前进行过相关预实验,预实验分对照组和模型组两组,于术前1 d,术后1,3,7 d从水迷宫同一象限丢入小鼠,观测指标为1 min小鼠的运动距离及平均速度。预实验结果经统计学分析后无明显差异,表明手术对小鼠运动能力无影响。通过对各组逃避潜伏期及术后第7天穿越平台次数数据的分析,我们发现胫骨骨折内固定术联合LPS可使小鼠逃避潜伏期明显延长,穿越平台次数明显降低。而应用α7nAChR激动剂可使术后小鼠逃避潜伏期明显缩短,穿越平台次数降低幅度较小。穴位电刺激能发挥与α7nAChR激动剂相似的作用,穴位电刺激与α7nAChR拮抗剂联合应用也会使术后小鼠逃避潜伏期降低,但降低程度有限。随着术后时间的延长,各组小鼠的逃避潜伏期逐渐缩短。这表明穴位电刺激可能通过作用于海马内的α7nAChR发挥脑保护的作用,又从侧面反映出穴位电刺激不单单是通过α7nAChR这一条途径来产生作用。
中枢神经系统中的海马体承担了机体学习记忆等认知功能,患者围术期发生的神经认知功能障碍和海马体功能紊乱密切相关,相关机制可能与大脑内细胞因子分泌失衡有关,而在个体表现上则出现学习和短期记忆等认知能力的下降[17-19]。中枢神经系统具备一个含量丰富的小胶质细胞吞噬网络,它可通过吞噬作用调节神经突触的形成,还可调节细胞凋亡改善神经元网络[20-22]。此外,它在中枢炎症过程中也展现出促炎和抗炎的双向特征,在手术应激等刺激条件下,静息态的小胶质细胞会向M1型转换,同时释放促炎因子,如IL-1β、IL-6等,部分小胶质细胞会向M2型转换,同时释放抗炎因子,如IL-4、IL-10等[23,24]。该实验通过ELISA测定小鼠海马内各种抗炎和促炎因子的含量变化反映电针等干预措施对其的影响。实验结果表明胫骨骨折内固定术联合LPS可使小鼠脑内的促炎因子增多,损伤小鼠海马的相关功能;穴位电刺激可增加小鼠海马内抗炎因子的含量,同时降低脑内促炎因子含量,起到调节小鼠海马内细胞因子的作用,α7nAChR激动剂可发挥与穴位电刺激相似的作用;α7nAChR拮抗剂联合穴位电刺激可在一定程度上发挥调节小鼠海马细胞因子的作用。由此可以推测出电针刺激可通过α7nAChR改变小胶质细胞的亚型,使M1型小胶质细胞减少,M2型小胶质细胞增多,从而使抗炎与促炎因子的含量发生变化,但具体情况有待于后续研究。有研究表明烟碱可通过nAChR影响小胶质细胞,其表面α7nAChR是烟碱发挥免疫调节效应的关键。α7nAChR的激活与失活对调控其生理功能有着重要作用[25,26]。为探究电针刺激等刺激条件是否引起α7nAChR含量的改变,该实验通过免疫荧光分析海马内α7nAChR的含量变化,实验结果表明电针刺激能够引起小鼠海马内α7nAChR含量的增加,其作用弱于应用α7nAChR激动剂。
根据以往研究[27,28]来看,电针在促进机体恢复认知功能方面有着其独特优势,其机制可能与调控机体不同细胞因子的分泌有关。针对以上论述,在基于老年的前提下,探索电针对海马体内小胶质细胞的影响显得十分重要。针刺参数是影响电针疗效的重要因素,针刺频率、电流强度、波形及穴位配伍的设置对电针的治疗效果均有不同的影响[29-33]。本实验采用2/15 Hz疏密波刺激小鼠神庭、百会和双侧足三里,持续至处死当天,每天于固定时间刺激30 min。关于针刺时间的选择,我们考虑到小鼠的个体差异和为排除电针治疗效果对实验的干扰,我们在需要电针的各组小鼠建模后,通过水迷宫筛选出有记忆力受损的个体进行电针刺激。
α7nAChR参与小胶质细胞炎性调节的机制涉及到JAK-2/STAT-3信号通路、TLR-4/NF-κB信号通路、PLC-IP3-Ca2+信号通路等[34-36],而电针发挥这一作用所参与的具体机制及是否涉及其他新的相关机制仍有待于进一步深入研究。
综上所述,电针刺激可有效改善小鼠胫骨骨折术联合LPS所导致的学习记忆能力的下降,主要是通过增加海马内α7nAChR含量并使其活化,使得中枢促炎因子释放减少,抗炎因子释放增多;此外,电针还可通过其他途径缓解小鼠的记忆损伤,相关机制有待于进一步研究。

