儿童肝移植中他克莫司浓度个体内变异
吴浩翔, 吕子成, 侯宇宸, 张子杰, 乔子耘, 冯 浩,2, 夏 强,2
(1.上海交通大学医学院附属仁济医院肝脏外科,上海 200127;2.上海市器官移植研究所 上海市器官移植与免疫工程技术研究中心,上海 200127)
他克莫司(tacrolimus,Tac)是从链霉菌属发酵液中分离出的钙调神经磷酸酶抑制剂(calcineurin inhibitor,CNI),其发现于1984年,不久进入临床使用,目前Tac已作为肝、肾等实体器官移植的一线用药,应用率达90%以上[1-2]。Tac半减期约为12 h,存在较大的个体差异,这在很大程度上是由供者与受者细胞色素P450等药物代谢酶的基因多态性造成[3]。由于其狭窄的治疗浓度范围和药代动力学差异,需对病人进行治疗药物监测(therapeutic drug monitoring,TDM)[4],并行个体化剂量调整。药物浓度低于治疗范围可造成排斥反应,高于治疗范围可引起肾毒性、感染等不良反应。药物谷浓度是目前Tac TDM的主要指标,但仅以某一时间点的Tac瞬时浓度作为药物暴露程度和治疗反应的评估指标,其作用有限。
目前,关于Tac的最佳TDM目标尚未达成共识。近年来,除病人间变异外,针对病人的Tac浓度个体内变异 (Tac intra-patient variability,Tac-IPV)逐渐成为新型标志物,可用于识别有不良预后风险的移植受者。Tac-IPV通常指一段时间内个体全血Tac谷浓度在药物剂量稳定前提下的波动情况,描述个体Tac谷浓度随时间变化的程度[5],被视作对一段时间内药物暴露程度的综合测量,可更好地评估个体因Tac暴露过度或不足而面临的不良结局风险,通常使用标准差、变异系数(coefficient of variation,CV)和治疗范围内的时间等指标来计算和衡量。本研究回顾性分析上海交通大学医学院附属仁济医院儿童肝移植受者移植后随访的临床数据,探究Tac-IPV在儿童肝移植中的应用。
资料与方法
一、临床资料
本研究纳入2010年1月至2020年10月于上海交通大学医学院附属仁济医院肝脏外科接受肝脏移植手术且术后在仁济医院行肝穿刺的392例患儿。
纳入标准为:①移植时年龄<18岁;②首次肝移植;③术后采用以Tac为基础的免疫抑制治疗方案;④移植后随访时间>1年;⑤有我院肝穿刺活检病理诊断;⑥临床资料完整。
排除标准为:①多脏器联合移植;②未使用Tac作为起始免疫抑制剂;③第1年内撤换Tac;④随访时间<1年;⑤术后随访每年记录的Tac浓度值次数<3次;⑥移植术后3个月内移植物丢失或再次移植;⑦2次移植。
二、方法
患儿服用的Tac为口服制剂,每天早晚各1次。术后24 h予Tac, 起始给药量定为0.10~0.15 mg/(kg·d),后续根据Tac血药谷浓度实时调整给药剂量。移植术后第1个月内患儿的目标血药谷浓度为8~12 μg/L,第 2~6 个月为 7~10 μg/L,第 7~12 个月为5~8 μg/L,此后则维持在 5 μg/L 左右。 根据患儿移植术后病情的变化,适时加用吗替麦考酚酯类药物、西罗莫司、糖皮质激素。患儿服药后12 h(一般为早晨服药前空腹)静脉抽血约2 mL,利用化学发光微粒子免疫分析技术测定Tac血药谷浓度。
IPV主要通过计算Tac血药谷浓度的CV和Tac浓度变异评分(Tac variability score,TVS)得到,主要计算移植术后1~12个月和4~12个月的Tac血药谷浓度变异。对于Tac血药谷浓度的IPV,CV的计算方法为:CV=σ/μ×100%(σ 表示所有取样浓度的标准差,即方差的平方根;μ表示所有取样浓度的平均值)。根据Forbes等开发的方法计算TVS[6-7]。首先计算每例患儿从第1~12个月Tac血药谷浓度的标准差。全部患儿标准差均值约为2.497 μg/L,因此选择以2.497 μg/L计算TVS。然后,计算连续Tac血药谷浓度相差≥2.497 μg/L的次数,再除以总的比较次数。如总共提供12个Tac血药谷浓度,就会产生11个差值,如差值≥2.497 μg/L的个数为 3,TVS 即为 3/11。
选取术后随访时间>1年,且有穿刺病理诊断及未更换免疫抑制剂的患儿,计算术后1年内的Tac-IPV,按照不同的病理诊断对患儿进行分组,比较不同组别患儿Tac-IPV的差异,探究不同计算方法得到的Tac-IPV与相关术后临床并发症的关联。
三、统计学方法
采用SPSS(23.0版)和GraphPad Prism(8.0版)软件进行统计学分析。通过正态图和Shapiro-Wilk检验评估分布。连续变量符合正态分布用均数±标准差表示,组间数据比较使用独立样本t检验。不符合正态分布的用中位数和四分位间距表示,组间数据比较使用Mann-Whitney U检验。分类变量表示为数字(百分比)。使用Friedman检验比较术后Tac浓度值和CV的年度变化。P<0.05为差异有统计学意义。
结 果
一、一般资料
本研究共纳入522例有肝穿刺病理诊断的患儿。130例被排除,其中35例随访少于1年,82例起始免疫抑制剂为环孢素,13例随访由于不良反应等换成环孢素。共收集392例受体的数据,研究队列的基线特征见表1。本研究患儿的基础诊断包括胆道闭锁、代谢性疾病、肿瘤及其他(见表1)。
表1 病人的基本信息[n(%)/±s]

表1 病人的基本信息[n(%)/±s]
LDLT:活体肝移植(living donor liver transplantation);DCD:心脏死亡器官捐献(donation after cardiac death);GRWR:移植物与受体重量比 (graft to recipient weight ratio);GC:糖皮质激素(glucocorticoid);MMF:吗替麦考酚酯(mycophenolate mofetil)。
项目 类别 值男性 1 7 5(4 4.6 4)女性 2 1 7(5 5.3 6)移植时月龄(月) / 2 4.7 3±3 6.5 8体重(k g) / 1 0.5 7±7.8 9诊断 胆道闭锁 3 2 5(8 2.9 1)代谢性疾病 2 3(5.8 7)肿瘤 2(0.5 1)其他 4 2(1 0.7 1)手术类型 L D L T 2 8 8(7 3.4 7)D C D 1 0 4(2 6.5 3)G R W R / 3.3 1±1.1 5免疫抑制方案 T a c 1 1(2.8 1)T a c+G C 9 5(2 4.2 3)T a c+M M F 1 5(3.8 3)T a c+G C+M M F 2 7 1(6 9.1 3)性别
二、肝移植术后Tac-IPV的变化
为分析移植术后Tac-IPV的逐年变化情况,选取术后 1、2、3、4、5 年内有完整随访记录的患儿,分别为 392、379、325、256、179 例。每年随访数据中共得到的Tac浓度记录值个数分别为13 525、3 702、2 090、1 313、664。移植术后的Tac浓度平均值分别为 7.95 μg/L(术后第 1 年内)、4.93 μg/L(术后第 2年内)、4.41 μg/L(术后第 3 年内)、4.10 μg/L(术后第4~5年内)(见图1)。移植术后的Tac-CV中位数分别为0.386 3(术后第1年内)、0.317 0(术后第2年内)、0.291 3(术后第 3 年内)、0.296 1(术后第 4~5年内)(见图2)。结果显示,前3年内,Tac的平均浓度值逐年下降(P<0.01),以CV为表征的Tac-IPV也逐年下降(P<0.01),但到第4~5年则趋于稳定。
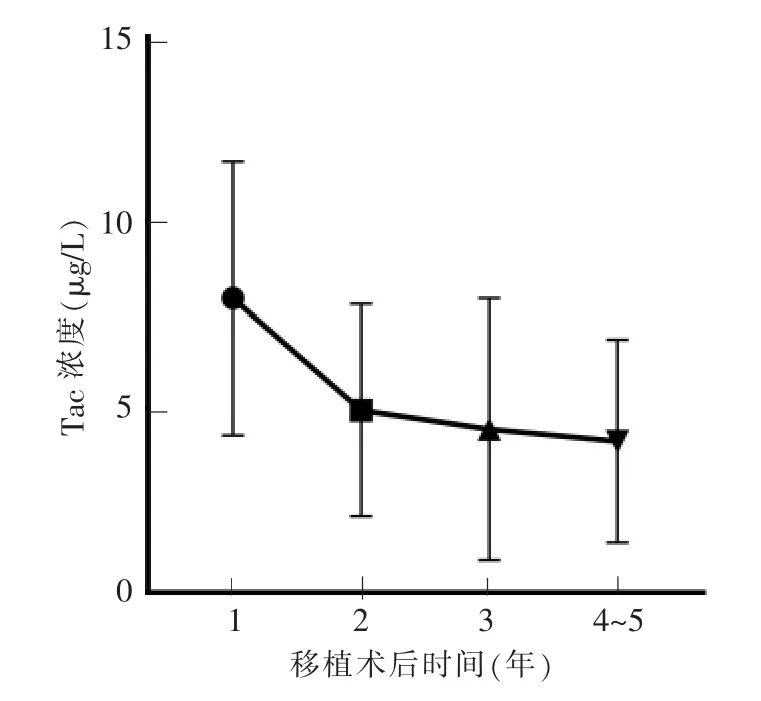
图1 每年的Tac平均浓度变化
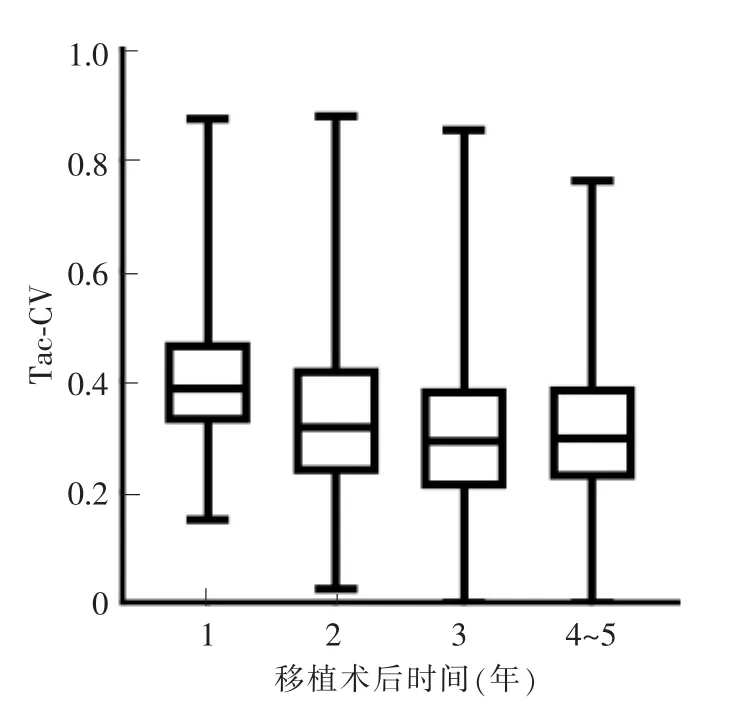
图2 每年的Tac-CV变化
三、肝移植术后Tac-IPV对临床并发症的影响
392例患儿共有558次穿刺结果,其中术后1年内的穿刺结果312次 (180例),1年后的穿刺结果246次(202例)。对于这202例,按照肝脏穿刺活检标本的病理诊断结果,分为正常恢复组、急性排斥组、慢性排斥组、肝纤维化组、EBV感染组、药物性肝损伤组、胆道并发症组。将各并发症组病人的CV和TVS分别与正常恢复组比较。针对采用CV计算的IPV,排斥反应、肝纤维化等并发症组与正常恢复组的差异无统计学意义。针对采用TVS计算的IPV,术后肝纤维化组1~12个月 TVS(P=0.011)和4~12个月TVS(P=0.001)与正常恢复组的差异有统计学意义,其余并发症组和正常恢复组差异无统计学意义(见图3)。
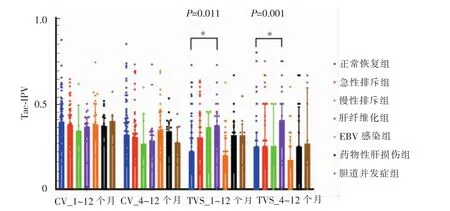
图3 Tac-IPV对临床结局的预测分析
讨 论
一、Tac-IPV计算方式
本研究同时计算移植术后1~12个月和4~12个月的Tac-IPV。发现无论是CV还是TVS,术后1~12个月的变异一般大于4~12个月。移植术后早期,由于手术缘故,病人肠道、肝脏以及全身生理状态尚不稳定。此外,术后早期联合使用糖皮质激素、抗菌药等药物较多,且常会根据实时病情频繁调整给药剂量,所以期间的Tac浓度波动较大。这也是许多关于Tac-IPV的研究一般会舍弃早期Tac浓度值的原因。对肝移植病人而言,术后3个月内所需平均血药浓度偏高[8],且此阶段为防治感染等并发症,可能会加服多种与Tac存在相互作用的药物[9-1 0],这使术后早期Tac浓度的波动增加。Tac-CV在前3年逐年下降,但到第4~5年时,则无明显下降。这可能源于3年之后随访的病例数和Tac浓度记录值较少,也可能因Tac-IPV在3年后达到稳定水平。
本研究采用CV和TVS两种方式来计算IPV。其中CV在各临床结局组中差异不大,而TVS在组间的差异较大,特别是肝纤维化组。因CV对异常值非常敏感,且易受Tac浓度平均水平的影响。研究发现,移植病人用CV计算的Tac-IPV与Tac浓度不达治疗水平的相关性较弱(R=0.253)[11]。Yin等[7]基于Tac浓度显著变化频率开发一种TVS,在1 343例肾移植病人中验证结果发现,TVS是比CV更好的预后指标,方便计算,且与移植物存活率的相关性更高。
二、Tac-IPV在成人肝移植中的研究
在成人肝移植中,关于受者术后的Tac-IPV,现有研究主要关注的是其与排斥反应、移植物存活率、新生抗供者特异性抗体(de novo donor-specific antibody,dnDSA)等临床结果是否存在关联。Lieber等[12]针对359例成年肝移植病人,计算术后6~18个月的Tac浓度标准差,发现标准差大于中位数2.1 μg/L的人群移植物丢失的风险更大。Christina等[13]纳入150例成年肝移植病人,选择移植术6个月后的血液Tac浓度值计算标准差。发现活检证实排斥病人的标准差显著高于无排斥病人 (分别为3.8和2.3,P=0.003)。近年关于成人肝移植Tac-IPV的研究大多计算的是移植术后Tac浓度的CV值。Del Bello等[14]纳入116例成年肝移植病人的研究发现,术后2年内的Tac-CV虽与移植物存活无关,但有助于识别移植排斥反应高风险人群。CV>35%的人群更可能出现活检证实的急性排斥反应(biopsy-proven acute rejection,BPAR)(OR=3.07,P=0.03),移植后2年内dnDSA形成的风险也更大(OR=4.83,P=0.01)。在一项326例成年肝移植病人的队列中,van der Veer等[15]发现肝移植后6~18个月内高Tac-IPV与免疫介导的移植物损伤无关。该研究所关注的主要复合终点包括第6个月后免疫介导的移植物损伤(慢性排斥、活检证实和疑似的迟发急性排斥)。次要终点则是肾功能下降和巨细胞病毒血症。研究显示,中位随访时间为5.2年,70例(21.5%)达到主要终点,根据CV中位数28%区分的高Tac-IPV与低Tac-IPV受者主要复合终点方面差异无统计学意义(24.4%比18.5%,P=0.068)。有趣的是,在次要终点方面,研究表明,基线时高Tac-IPV且低肾功能的病人,后续每年随访时,肾功能下降更多(P=0.007)。这提示高Tac-IPV导致肾功能损害可能不是通过免疫介导损伤,而是药物肾毒性的结果。另一项包含812例成年肝移植病人的研究中,Rayar等[16]使用术后第8~30天之间的Tac浓度计算CV,结果发现高CV组(>40%)病人的移植物存活率明显低(HR=1.42,P=0.03),且神经系统并发症、心血管并发症和需透析的急性肾功能衰竭更多。此外,该研究还发现移植前较高的终末期肝病模型(model for end-stage liver disease,MELD)评分和Child-Pugh分级是高Tac-IPV的危险因素。Di Maira等[17]计算移植术后前15 d内Tac和环孢素两种CNI的药物浓度CV。结果显示,两种免疫抑制剂的高IPV均与移植物丢失风险增加无关 (HR=0.911,P=0.835),但在高Tac-IPV亚组中显示急性排斥风险增加(HR=3.038,P=0.039)。
三、Tac-IPV在儿童肝移植中的研究
与成人相比,因移植适应证和病人生理特点的差异,儿童肝移植中Tac的应用稍有差异。儿童肝移植受者中,Tac的代谢和清除更快,因而所需的给药剂量更大。Tac-IPV在儿童肝移植中主要用于预测排斥反应。Venkat等[18]针对101例儿童肝移植受者,回顾性分析迟发排斥反应(late allograft rejection,LAR)的预测因素时,发现Tac浓度标准差每增加1个单位,LAR风险增至原来的3.49倍 (P=0.012)。Shemesh等[19]一项多中心的MALT(medication adherence in children who had a liver transplant)研究中,400例儿童肝移植受者入组并随访2年,结果发现当术后的Tac浓度标准差>2.5时,后期发生BPAR风险更大(OR=2.54,P=0.02)。针对此项研究的进一步分析显示,不良结局的发生率还跟变异的持续时间有关。2年随访中标准差均<2的受者排斥率为4.4%,仅第1年标准差>2的为22.9%,2年标准差均>2的为34.9%[20]。同样是计算标准差,de Oliveira等[21]在<12岁的高Tac-IPV儿童肝移植受者中观察到更高的丙氨酸转氨酶升高率,而高标准差与低标准差组间急性排斥反应发生率差异无统计学意义。但该研究的样本量较小,仅50例受者。Riva等[22]在评估儿童肝移植受者移植后2年内的BPAR时,根据BPAR诊断前7~10 d的Tac浓度计算CV和迂曲度,发现高Tac-IPV是AR的风险因素。Defrancq等[23]纳入41例儿童肝移植受者的研究发现,移植后1年内,BPAR组的Tac-CV显著高于无BPAR组(56.7%比40.9%,P=0.04)。但1年后BPAR组与无BPAR组的Tac-CV差异无统计学意义。这可能与总体Tac-CV随时间推移不断减小有关。第1、2、3年病人Tac-CV的中位数分别是41.6%、30.9%、28.5%。
四、肝移植中Tac-IPV研究的争议性
本研究发现,儿童肝移植术后发生肝纤维化的患儿Tac-IPV要比正常恢复的患儿高。肝脏的纤维化是肝脏应对慢性损伤的一种修复过程,高Tac-IPV提示移植受者存在更多的Tac浓度水平超出治疗范围,药物过度暴露和暴露不足的交替会导致器官损伤和排斥反应。所以,高Tac-IPV可能是儿童肝移植术后肝纤维化的潜在危险因素之一。已有许多研究表明,肾移植高Tac-IPV与dnDSA的发展、急性排斥发生率升高、慢性组织学病变进展、移植物丢失等不良结局显著关联[24-29]。与肾移植相比,目前肝移植关于Tac个体间药代动力学差异的研究很多,但关于Tac-IPV的研究相对较少,且在Tac-IPV的具体计算过程、结局指标和终点类型的选定等方面各不相同,研究结论尚未达成共识。部分研究选择的是术后早期或术后稳定期的Tac浓度值。肝移植中Tac-IPV研究有其特殊之处:肝移植受者具有较低的同种异体反应性,产生较少的抗供者特异性抗体,可耐受较低浓度的免疫抑制药物。目前证据表明,与肾脏同种异体移植物相比,肝移植物的整体同种免疫反应性较低[30],在特定病例中甚至可完全停用免疫抑制剂。这种免疫耐受的特殊性进一步减轻Tac浓度波动对肝移植受者的潜在不利影响。所以,与肾移植人群相比,肝移植受者定义高Tac-IPV的临界值可能更高,具有相对较高Tac-IPV的肝移植受者才会出现相关不良结局。此外,在肝移植受者中,Tac的代谢过程更复杂,肠道吸收(受体决定)、肝脏消除(供体决定)等多种因素相互作用,这也给肝移植中Tac-IPV相关研究增加难度。
五、本研究的局限性和进一步研究方向
本研究存在以下局限:①本研究是单中心、回顾性研究;②本研究肝纤维化等相关临床结局的例数比较少,可能会导致统计上的偏差;③本研究主要将肝穿刺的病理诊断作为临床结局的参考,未考虑未经肝穿刺证实的临床结局。
需进一步研究包括以下:①更多前瞻性、多中心、大样本的对照研究来验证Tac-IPV对相关临床结局的预测效果;②哪些因素会对Tac-IPV造成影响,进而指导临床;③对于环孢素等其他类型的免疫抑制剂,是否也能分析研究IPV对临床疗效的影响;④本研究主要关注的是儿童肝移植病人,将来可进一步拓展至成人。
六、小结和展望
Tac是实体器官移植应用最广泛的免疫抑制剂,但术后Tac浓度监测管理不甚完善,血药浓度值与临床结局关联度不高。Tac-IPV已成为预测移植结果、评估移植病人风险的一个重要新指标,有助于识别不良移植物结局(包括排斥和移植物丢失等)的高风险病人,且计算简单、易于操作,便于临床应用。对接受Tac维持治疗的器官移植病人,可在随访检测Tac谷浓度的同时关注病人的Tac-IPV。当Tac浓度出现较大的波动异常值时,及时找到波动原因并加以纠正。在计算Tac-IPV的时候,不管是标准差、CV或其他方法,需特别注意Tac浓度的采样时间、采样次数、排除异常值等问题。考虑到影响Tac-IPV的多种因素,应从改善病人服药依从性、优化免疫抑制治疗方案等方面入手。采取加强病人教育、转换Tac剂型、Tac-IPV在线报告等措施,降低Tac-IPV,改善移植的长期预后。目前已开展针对Tac-IPV在肝移植中应用的研究,但还较少。在试验设计、终点选择等方面尚未达成共识。未来针对肝移植领域,可结合更多的临床试验和数据,找到Tac-IPV更合适和实用的计算和评估方法,明确和量化其对移植结果的影响,并建立目标Tac-IPV水平,或与Tac谷浓度、浓度/剂量比等临床指标相结合,提升其对肝移植临床诊疗的辅助价值。

