有机酸对桑椹花色苷的辅色作用 及其热降解动力学规律
陈湘粤,高群玉,李倩,廖森泰,邹宇晓
(1.华南理工大学食品科学与工程学院,广东广州 510640)
(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东广州 510610)
桑椹,别名乌椹、桑椹子、桑枣等,为桑树的成熟果实。桑椹在食用方面可以为人体提供多种营养,同时因含有芦丁、花青素等活性物质可作为药材使用。桑椹是第一批由国家卫生部认定为“药食同源”的植物[1],其中富含的花青素约是蓝莓的两倍,因此对桑椹进行深加工是开发利用资源的重要渠道之一[2]。植物来源的花色苷是具有优良应用前景的天然着色剂[3],具有抗氧化[4]、抗炎[5]、清除自由基[6]、保护视力[7]、降血糖[8,9]、降血脂[10]和抗动脉硬化[11]等生理活性功能。但天然的花色苷在食品加工和贮藏过程中容易受到pH值、温度、光照、金属离子、氧气微生物等外界因素的影响而发生降解,生成无色的查尔酮或其同分异构体α-二酮[12],目前提高花色苷稳定性的途径主要有:分子辅色作用、化学结构修饰、生物工程技术等[13]。而花色苷分子辅色作用方式主要包括分子内辅色、分子间辅色、金属络合和自聚合作用4种,常用的辅色剂有酚类化合物、生物碱、金属离子以及有机酸等[14]。
已有研究表明有机酸对花色苷有明显的增色效应与红移效应,然而以桑椹花色苷为对象,考察有机酸对其辅色作用的研究还较少,且桑椹汁等加工制品在加工过程中容易因花色苷的不稳定而失去美观色泽。常用的有机酸包括咖啡酸、p-香豆酸、阿魏酸等,但由于其在水溶液中的低溶解性不适用于食品体系,因此选用对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸5种可溶于水的有机酸作为辅色剂,从有机酸自身结构特点出发,探究有机酸苯环结构上所连羟基数不同以及酚酸与脂肪酸对花色苷辅色效果的差异。此外,这几种酸都具有功能性,其中,没食子酸、绿原酸是桑属植物重要的酚类物质,常见于水果、蔬菜、谷物中,具有抗菌、降压、增高白血球、抗氧化等多种功效,是具有开发价值的潜在天然抗氧化剂[15]。此研究将对开发天然植物辅色剂具有重大的实际意义。
1 材料与方法
1.1 材料与试剂
桑椹花色苷购于天津市尖峰天然产物研究开发有限公司(花色苷含量250 mg/g)。对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸(分析纯)均购于上海瑞永生物有限公司;磷酸、无水乙酸钠、氢氧化钠均为分析纯。
1.2 仪器与设备
数显恒温水浴锅,金坛市富华仪器有限公司;UV-9100紫外可见分光光度计,北京瑞利分析仪器公司;FA2004N赛多利斯精密电子天平,上海精密仪器科学有限公司;Ekspert超高效液相色谱-Triple TOF 5600高分辨率精确质量四极杆飞行时间质谱联用仪。
1.3 实验方法
1.3.1 色谱-质谱条件
参考Khalifa等[16]的方法并做修改,液相条件:色谱柱C18(2.1×100 mm2,1.7 μm,Waters,USA);流动相:A相为0.1%甲酸水溶液,B相为纯甲醇,洗脱程序0~10 min:5%~20% B,保留5 min;15~30 min:20%~25% B,保留5 min;35~40 min:25%~33% B;40~42 min:33%~5% B,保留5 min;42~47 min:5% B;流速为0.3 mL/min;柱温30 ℃;进样量2 μL;进样前平衡5 min。
质谱条件:ESI源;正离子模式;氮气作为气帘气(CUR),35 psi;离子源气体(GS1和GS2),50 psi;离子化温度,500 ℃;喷雾电压,5500 V(+);碰撞能量(CE),45(+);扫描范围,50~1000m/z。
1.3.2 pH值对桑椹花色苷溶液的影响
配置磷酸缓冲溶液(0.02 mol/L乙酸钠溶液、0.06 mol/L磷酸溶液),用1 mol/L的NaOH溶液调节缓冲溶液pH值(2.28~10.29),用不同pH值的缓冲溶液配置成浓度为2.5×10-4mol/L的桑椹花色苷溶液。在400~700 nm范围内,扫描反应溶液的紫外可见光谱。
1.3.3 pH值对辅色反应的影响
分别用pH值2.5、3.5、4.5、5.5的磷酸缓冲溶液配成桑椹花色苷溶液以及五种辅色剂溶液,最终辅色反应体系中桑椹花色苷溶液浓度为2.5×10-4mol/L,辅色剂质量浓度为960 mg/L。将混合溶液置于室温下黑暗中反应30 min,在400~700 nm范围内,扫描反应溶液的紫外可见光谱。
1.3.4 温度对辅色反应的影响
用pH值为3.5的磷酸缓冲溶液配置桑椹花色苷与辅色剂的混合溶液,花色苷浓度为2.5×10-4mol/L,辅色剂质量浓度为960 mg/L。混合均匀后,分别置于20、30、40、50 ℃水浴中避光反应30 min。在400~700 nm范围内,扫描反应溶液的紫外可见光谱。
1.3.5 辅色剂浓度对辅色反应的影响
辅色实验参考Molaeafard等[17]的方法,配置磷酸缓冲溶液(0.02 mol/L乙酸钠溶液、0.06 mol/L磷酸溶液),用1 mol/L NaOH将溶液pH调至3.5。用磷酸缓冲溶液配成浓度约为2.5×10-4mol/L的花色苷溶液,分别加入对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸五种辅色剂,每种有机酸质量浓度分别为120、240、480、960 mg/L。将混合均匀后的辅色反应体系置于室温下黑暗中反应30 min。在400~700 nm范围内,扫描反应溶液的紫外可见光谱。
1.3.6 热力学参数计算
根据式(1)进行直线拟合求出平衡常数(K)、化学计量比(n)。
式中:
A——添加不同浓度的辅色剂的花色苷溶液在室温下暗反应30 min后515 nm处的吸光值;
A0——未添加辅色剂的花色苷溶液在室温下暗反应30 min后515 nm处的吸光值;
n——辅色剂与花色苷的化学计量比;
[CP]0——辅色剂的浓度。
根据式(2)计算吉布斯自由能ΔG°
式中:
R——气体摩尔常数,8.314 J/(mol·K);
T——开尔文温度,K;
K——平衡常数。
1.3.7 辅色剂对桑椹花色苷热降解过程的影响
将样品在恒温水浴锅中加热250 min,每隔50 min取一次样,测定溶液最大吸收波长处的吸光值Aλmax,计算降解速率常数k和半衰期T1/2。
式中:
At——t时刻后溶液中花色苷的Aλmax;
A0——加热前溶液的Aλmax;
t——加热时间。
1.3.8 可见吸收光谱的测定
可见吸收光谱采用紫外-可见分光光度计进行测定。取样品3 mL,在400~700 nm范围内扫描,扫描间隔为1 nm,以蒸馏水调零,比色皿长度为1 cm。
1.3.9 统计分析
每个样品设置3个平行,采用Excel和SPSS软件进行比较分析。测定结果以平均值±标准差表示。实验数据采用ANOVA进行turkey差异分析,以p<0.05为差异显著。
2 结果与讨论
2.1 桑椹花色苷UPLC-MS/MS分析
由图1和表1可见,样品中鉴定出4种花色苷单体,a中碎片离子为m/z465.10和303.05,母离子m/z627.16脱去一分子葡萄糖(162)得到碎片离子m/z465.10,脱去第二个葡萄糖分子(162)得到碎片离子m/z303.05,因此推断a为飞燕草素-3,5-葡萄糖苷[16];b中碎片离子为m/z 303.15,母离子m/z465.10脱去一分子葡萄糖(162)得到碎片离子m/z303.15,因此推断b为飞燕草素-3-葡萄糖苷[17];c中碎片离子为m/z287.06,母离子m/z449.11脱去一分子葡萄糖(162)得到碎片离子m/z287.06,因此推断c为矢车菊素-3-葡萄糖苷[18];d中碎片离子为m/z287.06,母离子m/z595.17脱去一分子葡萄糖(162)得到碎片离子m/z287.06,因此推断d为矢车菊素-3-芸香糖苷[19]。

表1 桑椹花色苷的二级质谱结果分析 Table 1 UPLC-MS/MS on mulberry anthocyanins
2.2 pH值对桑椹花色苷吸收光谱的影响
桑椹花色苷溶液在不同pH值下的颜色变化规律见图3。pH=2.28时,花色苷溶液的颜色为亮红色。pH从2.28变化到10.29过程中,溶液颜色由亮红变为粉红,再变为紫红色,最后变为深紫色,原因是溶液pH值的变化引起花色苷分子结构变化从而引发溶液的颜色变化[20]。不同pH值桑椹花色苷溶液在400~700 nm范围内的紫外可见光扫描图见图2。pH=2.28时,溶液在514 nm处呈现一个很强的吸收峰,最大吸收波长处吸光值达到1.89,对应图3中亮红色。pH值从2.28变化到3.26时,吸收光谱强度明显下降,最大吸收波长未发生明显偏移。当pH上升到6.28时,最大吸收波长处吸光值下降到0.35,且吸收峰明显变宽,最大吸收波长红移至547 nm。当pH=7.25时,溶液最大吸收波长红移至563 nm,pH=8.25时,溶液最大吸收波长红移至575 nm。当pH从8.25上升到10.29过程中,吸收峰逐渐变窄且吸收强度逐渐增强,最大吸收波长未发生明显偏移。
2.3 pH值对辅色反应的影响
不同pH值(2.5、3.5、4.5、5.5)下对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸与桑椹花色苷发生辅色反应的紫外可见光吸收谱图见图5。当pH=2.5时,花色苷主要以黄烊盐阳离子形式存在,且与空白组相比仅有轻微的增色效应和红移效应。随着pH值的升高,体系最大吸光值都明显下降,说明pH值是影响辅色反应的重要因素。其原因是pH值的变化改变了溶液中花色苷的存在形式,使平衡向形成无色物质移动,且五种辅色剂的添加减缓了平衡向生成无色物质移动。5种有机酸均在pH值为3.5~4.5之间时有较好的辅色效果。当pH=3.5时,对羟基苯甲酸、原儿茶酸、没食子酸、苹果酸、绿原酸Aλmax分别比空白组高15.89%、20.07%、23.15%、49.26%、41.50%。前期研究表明,辅色反应在弱酸条件下,pH值约为3.6时有更好的辅色效果[21]。在酸性环境下,溶液平衡向形成无色物质移动,而辅色剂的添加使得平衡向生成有色基团转变,从而阻止了桑椹花色苷的降解[22]。
在pH=3.5时,其有机酸“护色”效果依次为苹果酸>绿原酸>没食子酸>原儿茶酸>对羟基苯甲酸。有机酸与花色苷辅色反应后生成酰基,其空间位阻阻碍了消色差假碱基和查尔酮结构的形成[23],且不同有机酸参与的辅色反应均有其最适反应pH,如绿原酸反应的最佳pH范围为3.2~3.7[22]。因此最终“护色”效果受到有机酸结构及最适pH条件两方面影响。
2.4 温度对辅色反应的影响
在pH值为3.5,辅色剂质量浓度为960 mg/L的条件下,研究了在20、30、40、50 ℃下辅色反应。由图7可见,温度对辅色反应有影响。随着温度的升高,辅色效果逐步下降。如温度从20 ℃升高到30 ℃,空白组与对羟基苯甲酸、原儿茶酸、没食子酸、苹果酸、绿原酸组Aλmax分别下降了8.80%、9.50%、10.04%、10.17%、7.79%、9.36%;温度升高至40 ℃,六种体系Aλmax分别下降了15.30%、16.57%、16.22%、15.73%、10.51%、14.35%;体系温度升高至50 ℃,六种体系Aλmax分别下降了19.39%、25.32%、24.78%、24.00%、16.00%、17.89%。由以上结果可以推断桑椹花色苷与五种辅色剂的反应属于放热反应,高温会减弱辅色效果。在此研究中,五种辅色剂均在20 ℃时对桑椹花色苷有较好的辅色效果。
2.5 辅色剂质量浓度对辅色反应的影响
辅色剂浓度对辅色效果的影响见图8,对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸这5种有机酸均对桑椹花色苷有增色作用,且随着辅色剂质量浓度从120 mg/L升高到960 mg/L,体系的Aλmax逐渐增大,辅色作用增强。当辅色剂质量浓度为120 mg/L时,与空白组相比,添加对羟基苯甲酸、原儿茶酸、没食子酸、绿原酸、苹果酸的体系Aλmax分别增加了2.17%、2.84%、2.72%、6.61%、8.11%。质量浓度为960 mg/L时,体系Aλmax分别增加了17.86%、20.79%、24.84%、37.10%、45.04%。增色效应伴随红移效应,溶液λmax发生1~4 nm的偏移,且随着浓度的升高,偏移越多。这与Zhu等[24]的文章描述一致。
在花色苷混合体系中存在以上三种平衡,其中AH+为黄烊盐离子,CP为辅色剂。无色的辅色剂溶液与花色苷的黄烊盐离子结合导致平衡朝着生成黄烊盐离子方向移动。随着辅色剂浓度升高,生成的增色复合物越多,体系的Aλmax越大。因更高浓度的辅色剂中有更多羧基与花色苷母核发生酰化反应,从而式(7)中平衡朝生成增色复合物的方向移动,产生增色效应。
由表2可见,当质量浓度为120 mg/L时,对羟基苯甲酸、原儿茶酸、没食子酸组与空白组相比,Aλmax没有差异(p≥0.05),绿原酸与苹果酸组与空白组的Aλmax有差异(p<0.05),说明绿原酸与苹果酸辅色作用优于三种酚酸。当辅色剂质量浓度为960 mg/L时,5个辅色组与空白组的Aλmax都有差异(p<0.05),说明在此质量浓度下5种辅色剂对桑椹花色苷均有辅色效果,且5个辅色组间也有差异(p<0.05)。辅色剂的化学结构对辅色反应有很大影响[25],对于4种酚酸,苯环上的π-π共轭是酚酸与花色苷分子间发生辅色反应的内在驱动力,此外苯环上的羟基可与花色苷分子相互作用形成氢键或发生电荷转移[17],因此羟基最多的绿原酸辅色效果最好,对羟基苯甲酸辅色效果最弱。苹果酸是短链脂肪酸,在5种酸中辅色效果最佳,据文献报道[13]有机酸与花色苷分子形成的结合物由于疏水作用使花色苷母核和酰基平面残基形成了上下垂直的多层重叠结构,形成类似“三明治”的“夹心”结构,折叠的酰基紧紧缠绕在2-苯基苯并吡喃骨架的表面,通过空间位阻效应保护了夹在两个有机酸分子间的花色苷母核,而苹果酸较好的辅色效果可能与此结构有关。

表2 不同质量浓度的辅色剂与桑椹花色苷辅色后的Aλmax Table 2 The Aλmax of the co-pigmentation of mulberry anthocyanin with different concentration and co-pigments at 20 ℃ and pH 3.5
2.6 辅色反应的热力学参数
根据方程(1)(2),拟合ln[(A-A0)/A0]与ln[CP]0的方程(R2>0.90),lnk为拟合方程的截距。计算得到辅色反应的化学计量比n、平衡常数K、吉布斯自由能ΔG°如表3所示。化学计量比n代表桑椹花色苷黄酮阳离子连接每个色素的分子数[26],平衡常数K表示辅色剂与花色苷之间发生辅色反应的强度[27],ΔG°表示发生辅色反应所需的能量[17]。表中所有的ΔG°都小于0,说明五种辅色剂与花色苷的反应都是自发反应。辅色剂的分子结构和带电性质的不同可能导致反应的平衡常数K与ΔG°产生差异[25],平衡常数K值和ΔG°与辅色剂辅色效果表现出一致性,即辅色效果越好的酸其反应平衡常数越大,ΔG°值越小,说明其与花色苷反应强度越大,辅色反应所需的能量越小。反应的n值在0.78~1.06之间,与前期研究结果相一致[21,28]。
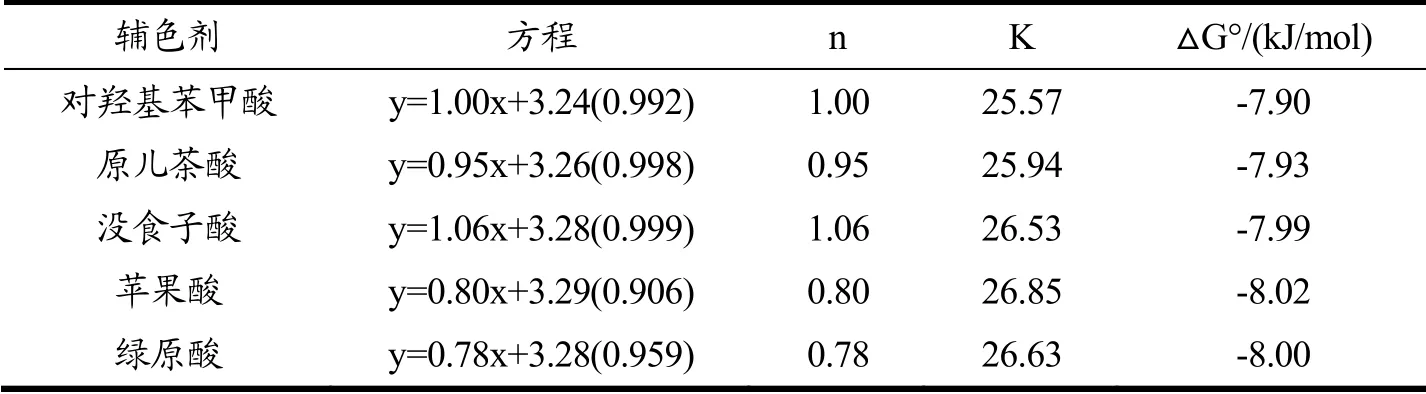
表3 各辅色剂参与辅色反应的热力学常数 Table 3 Thermodynamic properties for the co-pigmentation reactions of mulberry anthocyanin with different co-pigments
2.7 辅色剂对桑椹花色苷热降解过程的影响
分别将空白组与添加辅色剂的样品置于60、70、80 ℃水浴中加热250 min,每隔50 min取样,比较空白组与加入辅色剂组的热降解特性。在加热过程中,空白组与添加辅色剂组的最大吸收光值随着加热时间增加而降低,原因是高温易导致花色苷发生降解,使花色苷含量降低,这与前面2.3中结果一致。其热降解动力学参数符合一级动力学方程。
根据式(3)(4)可以计算得出表4数据,分析可知,温度对花色苷的降解有重要影响,随着温度升高,对照组与实验组的降解常数(k)值都升高,而半衰期(T1/2)都随之降低。这表明温度升高,热降解速率增加,最终导致花色苷的半衰期减小。这一结果得到Qian等[29]的研究验证。除此之外,实验组的降解速率都小于对照组,半衰期都大于对照组。由此可以推断以有机酸作为辅色剂,可以一定程度上改善花色苷的热稳定性。Kanha等[26]选用阿魏酸、多巴胺、儿茶素作为辅色剂,研究了其对C-3-g热稳定性的影响,发现辅色剂可以明显改善C-3-g的热稳定性。
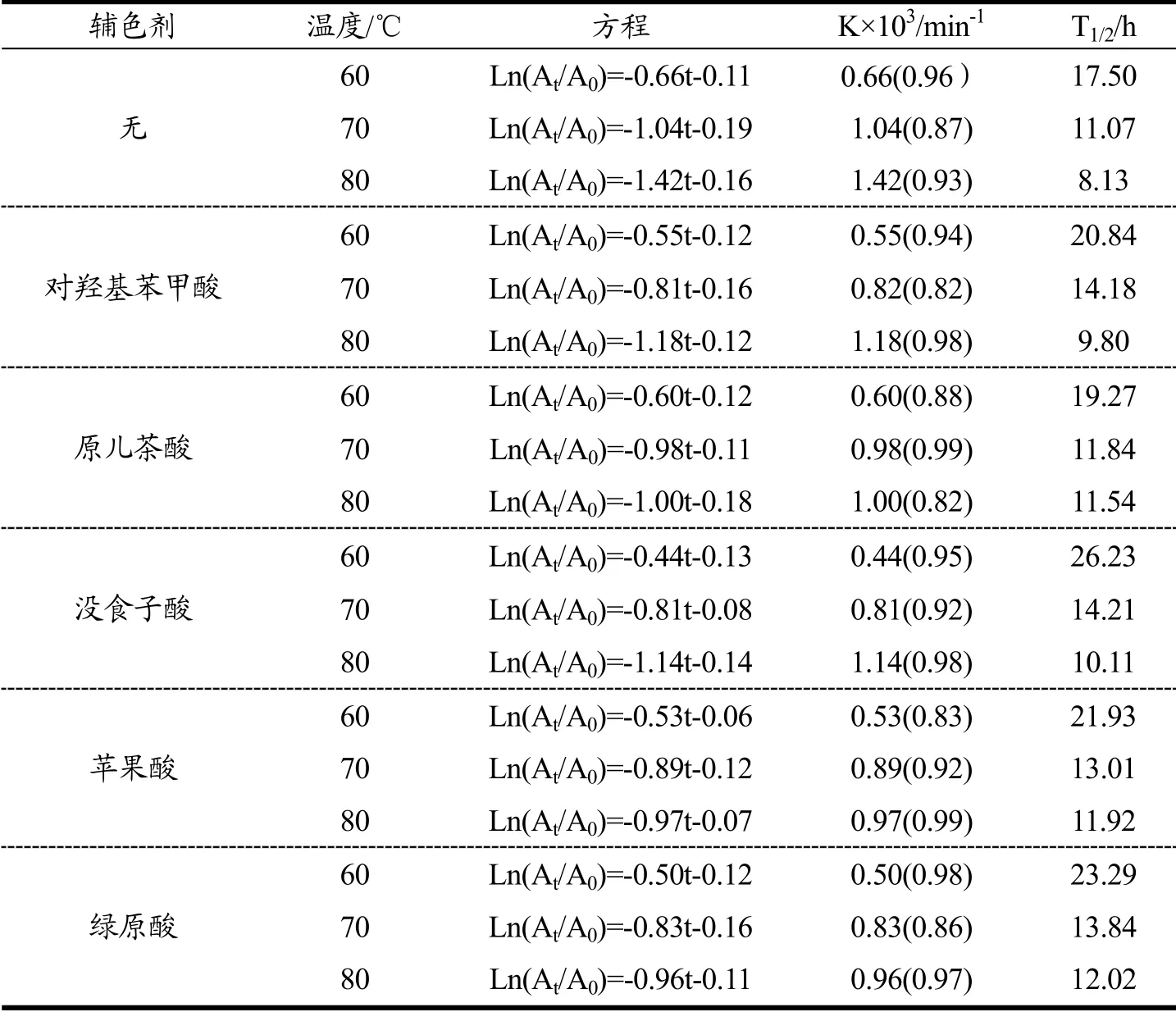
表4 辅色剂(960 mg/L,20 ℃,pH=3.5)与桑椹花色苷辅色后在60、70、80 ℃下的热降解动力学 Table 4 First-order kinetic parameters for thermal degradation of the co-pigmentation reaction of mulberry anthocyanin with different co-pigments
3 结论
桑椹花色苷中主要含有四种花色苷单体,分别是飞燕草素-3,5-葡萄糖苷、飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷。五种有机酸均可以通过辅色作用提高桑椹花色苷溶液的颜色强度,溶液pH、温度、辅色剂浓度及其结构均是辅色反应的重要影响因素。其中苹果酸在pH=3.5、20 ℃、960 mg/L浓度下增色效果最佳,比空白组Aλmax增加45.04%,且有机酸苯环结构上所连羟基越多辅色效果越强。此外,有机酸可以降低花色苷溶液降解常数(k),延长半衰期(T1/2),从而提高桑椹花色苷的热稳定性。因此在桑椹花色苷溶液中添加适量有机酸是缓解花色苷因pH值、高温等外界因素发生降解的有效方法,是一种安全有效的改善桑椹饮品颜色品质的方法,对改善果酒及果汁饮品生产厂家利用天然色素调节产品色泽具有重要的理论和实际意义。

