赤灵芝中三萜类活性成分的提取筛选和质谱分析
周旭,庄思远,李彦杰,刘箬瑶,刘春明,李赛男,张语迟
(长春师范大学中心实验室,吉林长春 130032)
灵芝(Ganoderma lucidum),又名三秀、神芝,为多孔菌目(Polyporales)、灵芝科(Ganodermataceae)、灵芝属(Ganoderma),其味甘能补、性温,具备扶正固本、补益肺气、保肝护肝和镇静安神等功效[1]。现代研究发现,灵芝含三萜[2,3]、多糖[4-6]、生物碱、氨基酸和蛋白质等多种活性成分[7,8],其中三萜类化合物是重要的活性组分,临床上常用于慢性支气管炎、冠心病等症的治疗以及癌症化疗之后的辅助治疗[9,10]。
传统提取方法主要有溶剂法和蒸馏法等,其中水煮法、浸渍法、超声波提取技术和连续回流提取技术均隶属于溶剂法。传统的浸渍法,得率较低、耗时耗能且易产生废气污染。超声波提取作为新式提取方法,具备节能、省时、运行成本低和得率高等优点,普遍用于动植物、细菌学和中草药等科学研究领域[11]。响应面分析法(Response Surface Methodology,RSM)作为一种重要的综合设计确定性试验和数学函数关系的优化方法,已普遍应用于中草药提取工艺优化等方面,该方法是将影响提取试验结果的因素进行设计,然后按照设计方案进行试验得到试验结果[12],分析试验因素和试验结果之间的数学关系,进而得到最优的试验条件[13]。本研究利用超声波技术提取赤灵芝中的三萜类成分,以赤灵芝总三萜的得率为指标,结合响应面法筛选赤灵芝总三萜提取条件,最终得到最佳提取工艺参数。
脂肪氧化酶(Lipoxygenase,LOX)俗称脂氧合酶,该酶是一种包含非血红素铁的过氧化物酶,其专门催化多元不饱和脂肪酸(含有顺、顺-1,4-戊二烯结构)发生加氧反应,从而形成含共轭双键的不饱和脂肪酸氢过氧化物,呈球型,可溶,无色,其分子量在动物中为75 ku~80 ku,植物中为90 ku~104 ku,LOX一般遍布于动植物中,主要涉及植物的生长、发育、衰老、脂质过氧化及其它胁迫反应等[14-18],LOX抑制剂通常作为抗炎活性研究的主导。炎症是指机体被外来物质、侵染或其他缘由导致损伤后作出的一种反应,形成炎症的首要因素是炎症介质和相关细胞之间的互相反应。测定某种物质对脂肪氧化酶的抑制率水平可在特定环境下体现该物质的抗炎活性[19]。灵芝在炎症治疗领域有一定的特色,能够有效治疗急性肠炎、乳腺炎、肝炎等炎性疾病,对各种原因导致的皮肤炎症也具有较好的治疗作用。灵芝三萜提取物通过抑制脂氧合酶的活性可以有效防止炎症,例如对角叉菜胶诱导的急性炎症和福尔马林诱导的慢性炎症导致的爪水肿有显著疗效[20]。通过查阅相关文献,赤灵芝中活性成分对抗炎的相关研究报道较少,因此,赤灵芝中的活性物质对应相关炎症治疗作用机制仍需深入探究。
超滤质谱技术是近年来常用的一种新的研究手段,它结合了超滤和质谱两种方法。亲和超滤质谱(Affinity Ultrafiltration Mass Spectrometry,AUF-MS)技术是利用药物配体和靶蛋白之间特异性结合的特性,将具有活性成分的混合物与靶蛋白充分混合,得到结合的复合物和未结合的配体,滤掉未结合的配体,保留配体与靶分子结合的复合物,加入有机试剂将复合物变性分解,释放出结合配体,进而通过液相色谱-质谱(HPLC-MS)法分析鉴定化合物的活性成分。此技术能够高效筛选特定疾病的靶蛋白,筛选的药物配体靶向鲜明、药理活性明显,为当代医药学提供开发利用的价值[21]。本研究采用液相色谱-超滤-质谱联用技术,首先选取脂肪氧化酶作为与炎症相关的生物靶分子,将受体酶和药物配体混合在体外进行孵化,形成与脂肪氧化酶结合的复合物和未结合的配体,超滤膜滤掉未结合的配体,加入有机试剂使复合物解离变性,释放出结合配体,再通过质谱技术对其结合配体进行分析鉴定。研究结果表明,超滤质谱技术适用于从传统中药中筛选脂肪氧化酶抑制剂,该方法快速、灵敏、具有高通量的特点,为天然抗炎药的筛选和开发提供科学有效的技术支持。
1 材料与方法
1.1 材料与试剂
赤灵芝药材购自吉林省长春市北京同仁堂药店,经长春师范大学中心实验室刘春明教授鉴定确认为多孔菌科药用真菌灵芝(Ganoderma lucidum)。
脂肪氧化酶,杭州安沃生物科技有限公司;齐墩果酸(纯度≥92.8%),中国食品药品检定研究院;香草醛,上海生工生物工程有限公司;灵芝酸C2、灵芝酸D2、灵芝酸B、灵芝酸F、灵芝酸A,均纯度≥98%,上海源叶生物科技有限公司;PBS缓冲溶液,Bueke公司;超纯水为实验室自制,美国Millipore公司;甲醇、乙腈均为色谱纯,美国ThermoFisher公司;95%乙醇、冰乙酸均为分析纯,北京化工厂。
1.2 仪器与设备
UPLC-Q-Extractive超高效液相色谱-高分辨质谱联用仪,美国Thermo Scientific公司;Waters 2695高效液相色谱仪、Waters 2998 DAD检测器、分析型SunFireTMC18色谱柱(250 mm×4.6 mm,I.D. 5 μm),美国Waters公司;Evaluation600型紫外-可见分光光度仪,美国ThermoScientific公司;恒温水浴锅,北京泰克仪器公司;高速多功能粉碎机,武义海纳电器有限公司;离心机,美国Sigma公司;超滤离心管,德国Merck公司。
1.3 试验方法
1.3.1 赤灵芝总三萜的提取
称取赤灵芝药材10 g,用30倍量的75%乙醇浸渍40 min,通过加热装置回流提取3次,每次1.5 h,提取液经抽滤滤去药渣并将清液浓缩至干,备用。称取赤灵芝粗提物50 mg,溶于50%的甲醇水溶液中,配成50 mg/mL的样品溶液,待用。
1.3.2 总三萜提取的单因素实验
设计各单因素试验中不同考察情况见表1。除说明考察变量条件不同外,其他影响因素均设置为料液比(乙醇)1:30、乙醇浓度75%、提取时间1.5 h、提取次数3次。

表1 总三萜提取的单因素试验设计表 Table 1 Single factor test design table for total triterpene extraction
1.3.3 总三萜得率响应面优化试验
基于单因素试验,进一步优化赤灵芝中总三萜提取的各影响因素。利用Design-Expert11.0软件设计中心组合试验,进行分析,研究赤灵芝总三萜的最佳提取工艺。试验中赤芝总三萜得率的四因素与其对应水平编码设计见表2。
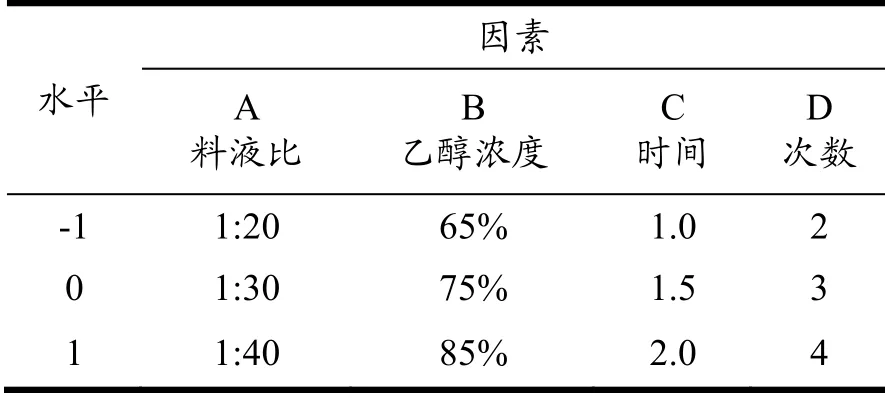
表2 响应面分析试验因素水平编码表 Table 2 Response surface analysis test factor level coding table
1.3.4 三萜含量的测定
1.3.4.1 标准曲线绘制
称2 mg齐墩果酸对照品于10 mL容量瓶,加甲醇至刻度线定容,制得齐墩果酸标准溶液,备用。分别取0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL标准溶液于10支干燥试管,将其95 ℃水浴蒸干,分别向10支试管内加入0.3 mL现制5%香草醛-冰乙酸,再分别加入1.0 mL HClO4,待混合均匀后,置于75 ℃水浴锅加热15 min,使其均匀反应;用冰乙酸补充至10.0 mL容量瓶刻度线处,在λ=560 nm处,检测紫外吸收。测定并绘制齐墩果酸标准曲线,建立回归方程,如图1,该回归方程为y=71.811x-0.0563(R2=0.9991)。
1.3.4.2 样品的测定 将赤灵芝样品以75%乙醇为溶剂配成溶液,按照“1.3.4.1项”下操作步骤测吸光度值,依据回归方程可计算三萜浓度。
1.3.4.3 总三萜得率计算
式中:
ρ——三萜浓度,mg/mL;
V——溶液体积,mL;
m——样品总质量,g。
1.3.5 高效液相色谱条件
C18色谱柱(SunFireTM,250 mm×4.6 mm,Waters),以乙腈(A)和超纯水(C)作为流动相,梯度程序为:0~5 min,2% A,5~22 min,2%~22% A,22~24 min,22% A,24~60 min,22%~40% A;流速0.2 mL/min;进样体积为8.0 μL;检测波长:230 nm、257 nm、268 nm;柱温:30 ℃。
1.3.6 UPLC-Q-Extractive条件
UPLC选择二元线性梯度洗脱:流动相A为乙腈,流动相C为超纯水,流动相梯度程序:0~5 min,2% A,5~20 min,2%~40% A,20~60 min,40%~80% A;流速:0.3 mL/min;样品进样量:10 μL;检测波长:230 nm、257 nm、268 nm;柱温:30 ℃。液相色谱光电二级阵列管检测器通过三通阀和质谱相连接,离子源:电喷雾离子源(ESI);分析模式:负离子模式;扫描范围m/z:100~1000;离子阱条件:离子源喷雾电压4.5 kV,鞘气辅助气为氮气,流速为20 L/min,离子阱压力3.1×107Pa;金属毛细管温度350 ℃,金属毛细管电压3.5 V。
1.3.7 超滤试验筛选脂肪氧化酶抑制剂
30.0 μL赤灵芝样品溶液(100.0 mg/mL)分别与90.0 μL不同活度的脂肪氧化酶(0.5、1.0、10 U/mL)混合,各加100.0 μL PBS缓冲溶液,于37 ℃水浴锅中孵育30 min,通过100 KD滤膜分离未结合的小分子配体和结合的大分子复合物。加入100.0 μL 50%甲醇水(50:50,V:V)冲洗膜上结合的大分子复合物,在室温下离心(12000 ×g)10 min,若膜上还残留有结合的复合物则重复上一步骤。空白实验组用相同体积的PBS缓冲溶液替代酶,其他条件与实验组相同,最后得到的溶液用“1.3.5项”下条件检测。
样品对脂肪氧化酶的结合强度(%)按下式计算:
式中:
A0——原提取液中该化合物的初始峰面积;
A1——与脂肪氧化酶结合的复合物的峰面积,结合强度反映了三萜类化合物与脂肪氧化酶结合能力的大小[22]。
利用紫外-可见分光光度法检测赤灵芝提取物对LOX的抑制率可在一定程度上反映其抗炎活性。在234 nm波长处检测反应液的吸光度(A)值[23]。
样品对脂肪氧化酶活性的抑制率(%)按下式计算:
式中:
A空白——不加待测样品反应后的吸光值;
A样品——加入待测样品反应后的吸光值;
A背景——只加待测样品的吸光值。
1.3.8 数据处理
响应面分析在Design Expert 11.0软件上进行;统计分析作图均在Office Excel 2019 software软件上进行;测试平行3次,显著性差异采用SPSS 19.0 Duncan’s multiple range test分析(p<0.05)。
2 结果与讨论
2.1 单因素实验
2.1.1 料液比对总三萜得率的影响
研究表明不同料液比对于赤芝有效成分的得率具有不一致的影响。分别设置料液比为1:10、1:20、1:30、1:40、1:50五组试验,考察其结果,如图2所示。
由图2可知,五组试验的总三萜提取得率呈现先上升后下降的趋势。这可能是因为总三萜的溶出量随着提取剂的增加而逐渐增多,直至三萜溶解达到饱和;由于溶出物浓度、杂质溶解度等方面的影响,得率会在一定料液比的范围内出现峰值;但提取剂过多时,原料中其他物质如甾体等也大量溶解在提取剂中,对三萜起到吸附作用,从而引起总三萜得率下降。
2.1.2 乙醇浓度对总三萜得率的影响
三萜类物质成分复杂,可溶于乙醇等极性较大的试剂中。不同的三萜化合物其极性具有差异,利用有机溶剂提取三萜类物质,需要根据三萜类化合物与杂质极性不同进行选择。三萜类化合物极性不同,在不同极性的提取剂中的得率也不同。试验考察条件为乙醇体积分数,分别为65%、75%、85%、95%、100%五组,试验结果如图3。
由图3可知,当提取剂乙醇的体积分数为75%时,赤芝总三萜得率达到最大值。当乙醇体积分数在75%前时,总三萜得率随体积分数的增大呈现上升趋势;然而,当体积分数大于75%后,其得率又出现依次递减的趋势。主要原因可能是增大乙醇浓度可以促使细胞溶胀,有利于提取剂向细胞内部的渗透,从而提高了总三萜的得率;但乙醇浓度过高,导致溶液体系的极性下降,使赤灵芝中的醇溶性、脂溶性杂质与脂溶性三萜竞争溶剂,由于一部分水溶性三萜类成分不溶于高浓度的乙醇溶剂,致使总三萜得率呈现出降低的趋势。
2.1.3 提取时间对总三萜得率的影响
三萜的提取是一个物质转移的过程。相同条件下的不同时间阶段,三萜的析出程度不同,导致三萜的得率也有所不同。相关研究表明,三萜得率与提取时间并非呈现正相关的关系。分别设置1.0、1.5、2.0、2.5、3.0 h五组试验,考察其影响,结果见图4。
由图4可知,在1.0~1.5 h区间内赤芝总三萜得率与提取时间呈正相关的关系。当提取时间大于1.5 h时,赤芝的总三萜得率下降。推测这是因为提取时间过长,导致如甾体类、多糖类等其他组分溶出,或部分三萜类化合物被氧化,从而引起总三萜得率下降。
2.1.4 提取次数对总三萜得率的影响
由图5可见,提取次数对赤芝总三萜提取得率的影响较大,当提取次数为1~3次时,总三萜提取得率随次数的增多而不断升高,而当提取次数超过3次时,三萜成分得率随提取次数增加而发生缓慢降低的趋势。推测这是因为刚开始提取到第三次提取完成,提取溶剂能够逐渐与赤灵芝充分地接触,故总三萜得率逐渐升高,当提取次数为三次时,药材中的总三萜已基本提取完全,当继续增加提取次数时,可能会导致如甾体类等其他组分的溶出,从而引起总三萜得率缓缓下降。
2.2 响应面法优化提取工艺
2.2.1 回归模型的建立及方差分析
利用DesignExpert 11.0软件针对上述各影响因素设计Box-Benhnken试验,采取响应面分析法(4因素3水平),将响应值定为赤灵芝总三萜的得率,以此进行提取工艺条件的优化,如表3为试验设计方案及结果。

表3 Box-Benhnken设计方案及试验结果 Table 3 Box-Benhnken design scheme and test results
结论:经过数据处理,可知赤芝总三萜得率的回归方程:Y(%)=1.09+0.02A+0.01B+0.01C+0.02D- 2.50×10-3AB-3.75×10-3AC-5.00×10-3AD-5.00×10-3BC -1.25×10-3BD+0.00CD-0.15A2-0.13B2-0.15C2-0.17D2
方差分析结果见表4。由表4可知,该回归方程p<0.05,表明该数学模型显著,失拟项p>0.05,表明失拟差异很小,这说明该数学模型与赤灵芝总三萜的实际得率情况拟合良好。对各因素进行综合分析表明,一次项B、C不显著,A、D极显著,说明料液比和提取次数两个因素的影响较小,对总三萜得率影响最显著的因素是提取时间,次显著为乙醇体积分数;各因素之间交互项不显著,表明这4个因素之间的交叉变化作用不大。
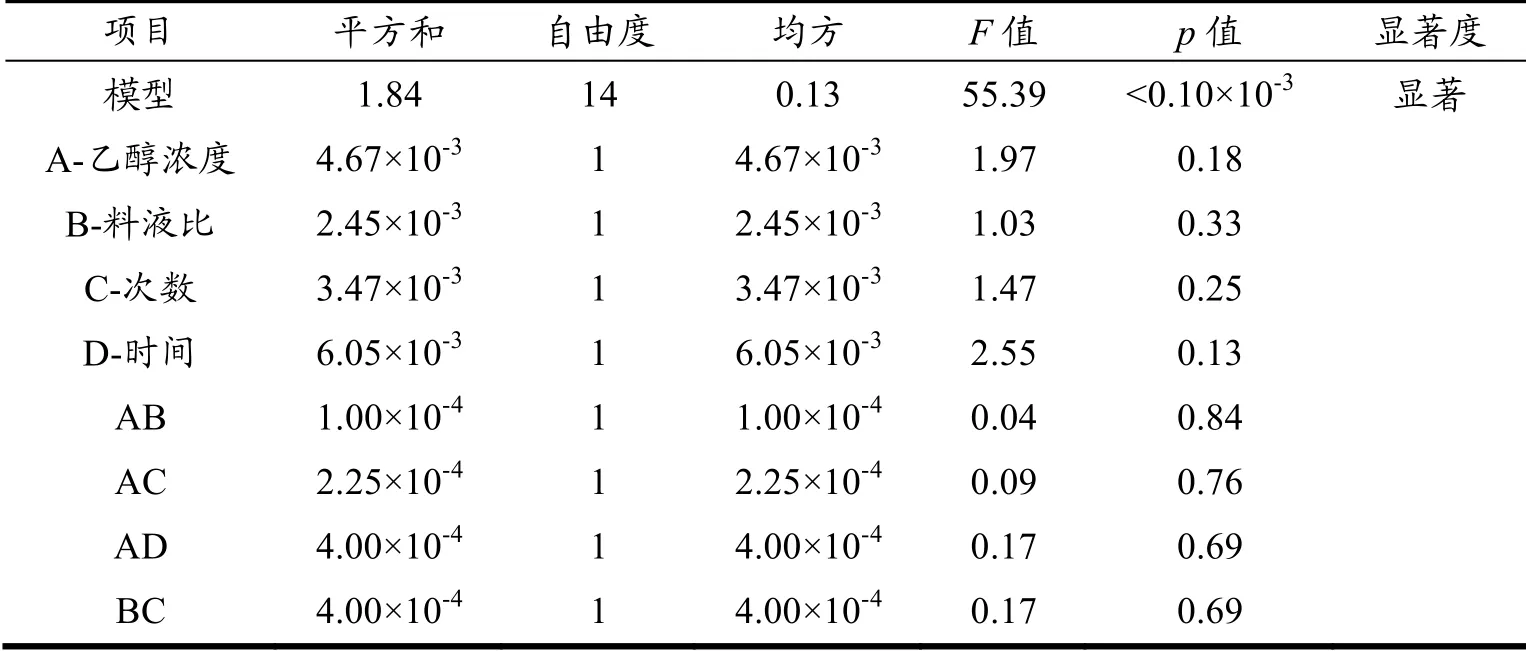
表4 总三萜得率回归方程方差分析 Table 4 Variance analysis of regression equation for extraction rate of total triterpenes
根据图6的曲面图可知,各响应曲面图的开口全部向下,而且等高线图的最小椭圆形中点处于已取试验因素条件区间内,说明赤灵芝总三萜得率在各因素设置的范围内具有最大值。等高线越集中则标志着该因素对总三萜得率的作用越大。由此可分析得出,根据图6a、6e、6f可以得出,提取次数对得率的作用较为突出,伴随提取次数逐次递增,赤灵芝总三萜得率呈抛物线型关系,并存在极大值,此时极大值为3次;图6a、6b、6c显示总三萜的得率受乙醇体积分数的影响显著,随着乙醇体积分数的不断增大,呈现出提取得率先升后降的情况;由图6c、6d、6f显示提取时间对得率存在一定影响,当时间为1.5 h左右时得率最大;由图6b、6d、6e结果显示总三萜得率受料液比的影响较小,但总体趋势呈现先上升而后下降,当料液比达到1:30时,总三萜提取得率达到了最大。三维曲面图反映的效果与上述回归系数的显著性分析结论相吻合。

续表4
2.2.2 最佳提取工艺的预测和试验验证
根据Design-Expert 11.0建立的数学模型确定了优化后的赤灵芝总三萜提取工艺条件为料液比1:30、提取时间1.5 h、乙醇浓度75%、提取次数3次。在此条件下,模型推测得率为1.05%。进行验证试验后结果显示,赤灵芝总三萜得率为1.04%,符合预期结果。
2.3 赤灵芝提取物中的化学成分与脂肪氧化酶生物亲和作用
取30 μL赤灵芝提取物(100 mg/mL)分别与90 μL脂肪氧化酶及相同量失活的脂肪氧化酶作用后的HPLC图如图7所示,当赤灵芝提取物中化学成分与脂肪氧化酶发生特异性结合后,脂肪氧化酶捕获的配体所对应的峰面积均大于其空白对照。图7表明,赤灵芝提取物中有5个化合物可与脂肪氧化酶结合。图7表明,赤灵芝提取物中有5种化合物可以与0.5、1.0和10 U/mL脂肪氧化酶结合。分别比对图7中各液相色谱峰面积,考察化合物与脂肪氧化酶的结合能力,空白组峰面积值:1061、1194、322、551、359 mV·s;与0.5 U/mL脂肪氧化酶结合组峰面积值:1483、1807、353、716、402 mV·s;与1.0 U/mL脂肪氧化酶结合组峰面积值:1488、1823、357、723、405 mV·s;与10 U/mL脂肪氧化酶结合组峰面积值:1466、1802、351、713 s、400 mV·s。化合物1、2、3、4、5与不同浓度脂肪氧化酶的结合强度数值如表5所示。

表5 赤灵芝提取物与脂肪氧化酶结合强度表 Table 5 Ganoderma lucidum extract and lipoxygenase binding strength table
结果表明,加脂肪氧化酶的样品组与空白对照组相比,化合物1、2、3、4和5的液相色谱峰面积明显高于空白对照样品,证明这5种化合物与脂肪氧化酶存在亲和关系,推测化合物1、2、3、4、5具有潜在的脂肪氧化酶抑制作用。为实现对化合物1、2、3、4、5的活性验证,以及对此五种化合物对脂肪氧化酶抑制作用的数据分析,利用紫外-可见分光光度法进行了检测和分析。灵芝酸C2、灵芝酸B、灵芝酸A、灵芝酸D2和灵芝酸F的抑制率均超过80%。通过上述方法检测赤灵芝提取物对LOX活性的抑制率,证明赤灵芝提取物具有脂肪氧化酶的抑制作用。
综上,赤灵芝提取物中1、2、3、4、5化合物与脂肪氧化酶具有生物亲和能力,对脂肪氧化酶有一定抑制作用,具备潜在抗炎活性。各化合物1、2、3、4、5对LOX抑制效果强弱顺序为:(2)灵芝酸B>(1)灵芝酸C2>(4)灵芝酸D2>(5)灵芝酸F>(3)灵芝酸A。
2.4 应用UPLC-Q-Extractive分析赤灵芝中脂肪氧化酶抑制剂
采用“1.3.5”项高效液相色谱分离条件,赤灵芝提取物中的三萜化合物得到较好的分离,如图8,为赤灵芝提取物的高效液相色谱图。采取液质联用技术和标准品比对的方法,对HPLC中主要化合物色谱峰相对应的质谱数据进行了分析测定,结果如表6所示。
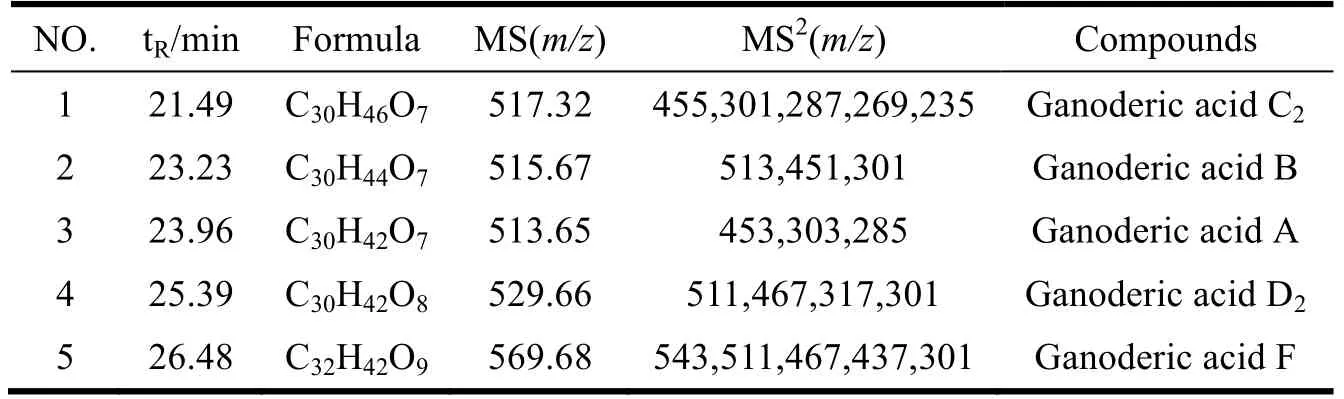
表6 赤灵芝中脂肪氧化酶抑制剂的UPLC-Q-Extractive分析 Table 6 UPLC-Q-Extractive analysis of lipoxygenase inhibitors in Ganoderma lucidum
化合物1保留时间为21.49 min,一级质谱母离子[M-H]-m/z517.32,通过多级谱图观察到该准分子离子脱1分子H2O,进而脱掉1分子CO2生成离子碎片m/z[M-H-H2O-CO2]-=455.32;同时,观察到Ganoderic acid C2电离之后通过电子转移和分子重排得到的碎片信息m/z[M-H-C11H20O4]-=301.19、m/z[M-H-C12H22O4]-=287.17、m/z[M-H-C15H20O3]-= 269.18和m/z[M-H-C15H20O3-CH4-H2O]-=235.14。这些碎片信息与文献中报道的Ganoderic acid C2质谱碎片信息一致,此外,化合物1的保留时间与灵芝酸C2标品一致,因此推测该化合物为Ganoderic acid C2[24]。利用上述相同的方法,推测化合物2、3、4和5分别为Ganoderic acid B、Ganoderic acid A、Ganoderic acid D2和Ganoderic acid F[25-28]。
液质联用技术广泛应用于各类药用真菌中,如张勇利用液质联用技术对药用真菌桑黄和桦褐孔菌中的有效成分进行分析鉴定,以黄嘌呤氧化酶为作用靶点,快速从药用真菌粗提物中筛选潜在酶抑制剂。液质联用技术的发展为药用真菌特色资源的研发提供了一定的理论依据[29]。
3 结论
3.1 以单因素试验为前提,利用响应面分析法对赤灵芝总三萜提取工艺优化进行一系列试验设计,设立了可准确评估赤灵芝总三萜提取得率的数学模型;各变量因素的影响强度顺序从大到小依次为:提取时间、乙醇体积分数、提取次数和料液比。赤灵芝总三萜的最佳提取工艺为:料液比1:30、提取时间1.5 h、乙醇体积分数75%、提取次数3次,总三萜得率可达到1.04%。
3.2 利用超滤质谱技术探究赤灵芝提取物对脂肪氧化酶活性的抑制作用,证实了该技术是一种便捷灵敏高效的分析方法。赤灵芝中5种三萜类化合物与脂肪氧化酶均具有生物亲和能力,可以抑制脂肪氧化酶生物活性。结果表明,以脂肪氧化酶作为靶点,利用超滤质谱结合高效液相色谱对天然产物进行活性物质筛选具有简单快速、操作性强等优势,为开发抗炎症药物提供有效实验依据。本研究为赤灵芝资源的开发提供新的思路,并可从中寻找天然抗脂肪氧化酶活性的成分。

