血管紧张素转化酶2参与臭氧暴露导致的小鼠肺部炎症及气道重塑
臭氧是一种常见的二次空气污染物,现代社会的快速工业化和城市化导致化石等矿物燃料的燃烧大量增加,臭氧已成为城市环境的主要污染物。世界上超过92%的人口经常暴露在臭氧中。流行病学研究表明,臭氧暴露可引起人群呼吸系统疾病的死亡率和住院率增加。毒理学研究显示,急性臭氧暴露导致呼吸道上皮破坏,蛋白质泄漏和中性粒细胞在支气管肺泡空间募集,导致小鼠肺部炎症和气道高反应性。慢性臭氧暴露会导致慢性肺部炎症、肺气肿和间质纤维化,并导致人和啮齿动物的肺功能降低。虽然臭氧污染带来的健康风险已受到普遍关注,但其毒理学机制仍不清楚,仍然需要深入研究。
近年来,作为SARS-CoV-2的主要受体,血管紧张素转换酶2(ACE2)在肺部疾病发病机制中的作用越来越受到关注。ACE2是一种跨膜蛋白酶,存在于肺泡上皮细胞和毛细血管内皮细胞中,在肺中有丰富的表达。它的主要作用是从血管紧张素II(Ang II)生成Ang1-7,后者通过Mas受体作用于肺,发挥有益作用,包括血管舒张和抑制炎症和纤维化。在博莱霉素、脂多糖或细颗粒物(PM2.5)诱导的急性肺损伤动物模型中,使用重组人ACE2 或ACE2激活剂可显著改善肺功能并减少肺部炎症及纤维化。因此,ACE2 在肺损伤的发病机制中起关键作用,能够为肺损伤提供保护,是解决炎症和纤维化的主要因素之一。目前,ACE2在臭氧所致肺部炎症中的作用尚未阐明。
在本研究中,我们通过构建臭氧暴露导致的小鼠肺损伤模型来探究ACE2在此过程中的作用,这项工作将有助于揭示臭氧诱导肺部炎症的机制。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组 6~8周龄SPF级野生型(WT)C57BL/6J小鼠16只,体质量20~25 g,雌雄各半,购自郑州大学医学实验动物中心;6~8周龄SPF级ACE2 敲除(KO)小鼠16只,体质量20~25 g,雌雄各半,购自北京唯尚立德生物科技有限公司。动物均常规饲养于郑州大学公共卫生学院动物房。32只小鼠随机分为4组,8只/组,分别暴露在过滤空气或臭氧(0.8 ppm)中,每天暴露3 h,连续暴露5 d。所有实验过程均符合单位和国家有关实验动物管理和使用的规定。
1.1.2 试剂和仪器 动式染毒柜(天津合普,HOPEMED 8050);便携式臭氧发生器(广州创环,CH-KTB2G);便携式室内Z-1200 臭氧检测仪(Environmental Sensors);BCA 试剂盒(北京博迈德);小鼠ELISA检测试剂盒(武汉华美生物);酶标仪(Tecan);TRIzol试剂(Invitrogen);逆转录试剂盒(Yeasen);q225-0207荧光定量PCR仪器(酷博科技公司)。
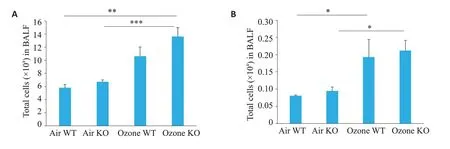
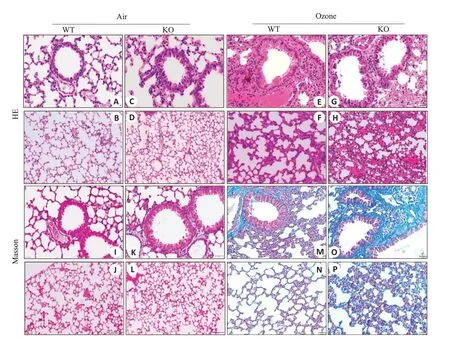
HE染色和Masson染色显示,空气组两组小鼠肺泡和支气管上皮结构完整,纤毛排列整齐,未见明显的胶原沉积;臭氧WT组小鼠支气管上皮可见轻度纤毛脱落,出现了轻度的肺泡壁破裂和融合,伴有少量纤维蛋白渗出,臭氧ACE2 KO组小鼠支气管腔中的免疫浸润和细胞碎片增加,支气管上皮出现增厚,纤毛缺损,周围有大量炎性细胞浸润,出现了更严重的肺泡壁破裂或融合,肺泡隔增厚,炎症细胞浸润40%~60%,更多的混合炎症细胞浸润、纤维化或组织学以及充血在肺组织中观察到(图3)。肺组织损伤及炎症病理学评分显示臭氧暴露组小鼠总评分及各项目评分显著高于空气暴露组的相应的同基因型小鼠,臭氧组的ACE2 KO组小鼠的总评分及各项目评分均显著高于WT组小鼠(<0.01,表2)。由表2可见,Masson 染色定量结果显示,臭氧组小鼠在肺组织支气管和肺泡周围存在大量的胶原沉积,臭氧组ACE2 KO小鼠肺组织的支气管和肺泡的胶原沉积阳性区域面积为(19.62±3.16)%、(21.63±3.78)%,高于臭氧组WT小鼠的(6.49±1.34)%、(4.44±0.99)%,二者差异有统计学意义(<0.05,表3)。
1.2 方法
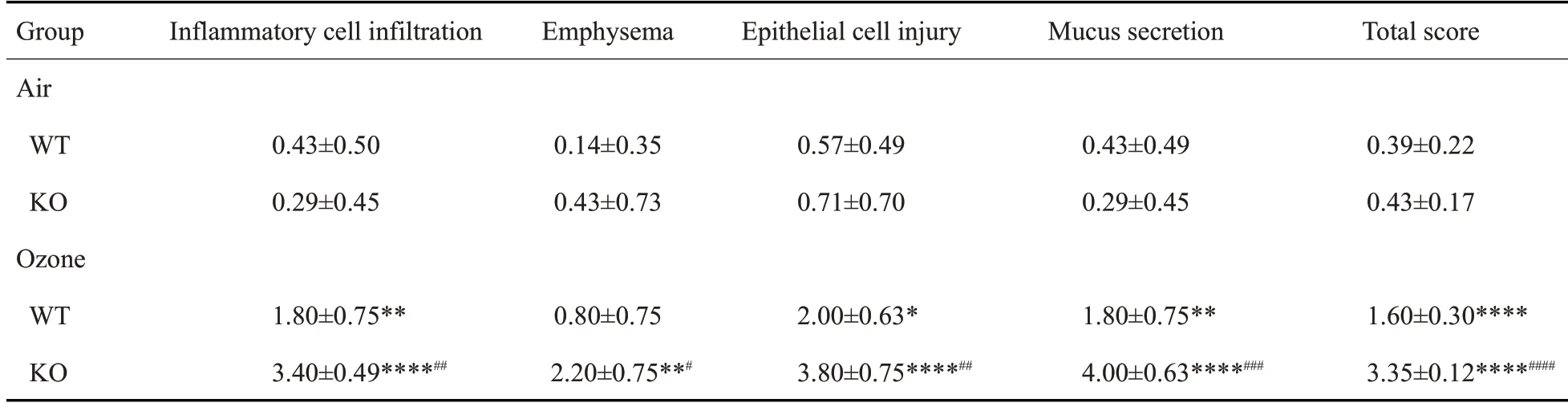
对4组小鼠BALF中炎症因子进行测定,空气暴露的两组小鼠各炎症因子没有差异,臭氧暴露的小鼠各炎症因子明显高于空气暴露的相应基因型小鼠,臭氧暴露的ACE2 KO小鼠的BALF中的IL-6、IL-1β、TNF-α、KC和MCP-1水平均高于WT小鼠,两组IL-1β水平差异具有统计学意义(<0.001,图4)。
教育部于2000年发布了《高等学校仪器设备管理办法》的通知,在第二章第九条中界定了贵重仪器设备的判定标准,以购置金额为主要判断标准,即单价在人民币10万元(含)以上的仪器即为贵重仪器设备。
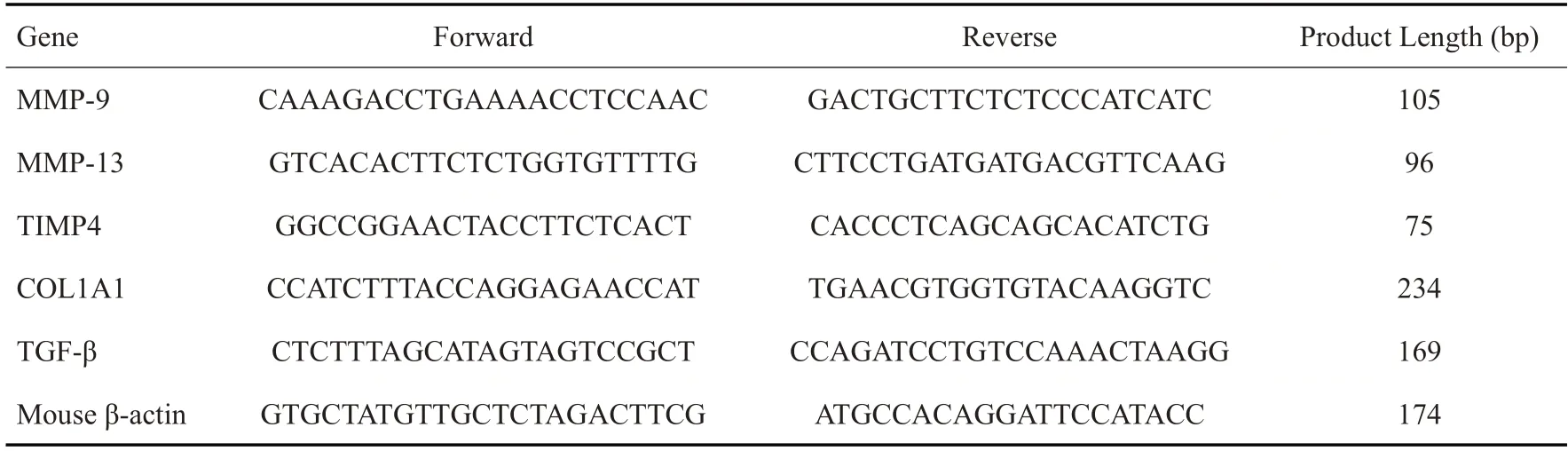
1.2.2 小鼠基因型鉴定 ACE2基因位于X染色体上,本研究所用的ACE2 KO小鼠是根据目标基因ACE2的蛋白保守区和基因组结构,选择敲除位置为转录产物202的exon7,利用CRISPR/Cas9技术使目的基因从exon7开始发生移码突变。剪鼠尾,长度约3 mm即可。鼠尾裂解液加蛋白酶K(25 mg/mL),每1 mL加20 μL蛋白酶K,每管加150 μL含蛋白酶K的裂解液。55 ℃水浴过夜。13 000 r/min离心5 min,将上清转移至新的EP管,每管加500 μL异丙醇,涡旋10 s。室温条件下13 000 r/min离心5 min,弃上清。每管加500 μL的70%的酒精洗涤,将EP管置于通风橱干燥5~10 min。每管加150 μL的TE缓冲液,55 ℃水浴1 h至底物完全溶解。进行PCR扩 增(ACE2-KO-F:GGAAGCTGAAGTATTCTTG GTC;ACE2-KO-R:CCAAGCAAATGGGCAGGGG AG),扩增体系:94 ℃,2 min;(98 ℃10 s;60 ℃30 s;68 ℃45 s)35个循环;68 ℃终延伸10 min。最后进行2%琼脂糖凝胶电泳。
1.2.3 肺组织HE染色与Masson染色病理学观察 如我们之前的研究所述。暴露结束后第2天,取小鼠肺组织置于10%的福尔马林中充分固定24 h,梯度酒精脱水,二甲苯透明,石蜡包埋,5 μm厚度切片,置烤箱中65 ℃烤片2 h。石蜡切片经二甲苯脱蜡,梯度酒精脱水后进行常规HE和Masson染色,再经脱水、透明后,中性树胶封片,普通光镜下观察肺组织变化和胶原沉积情况。根据张妍迪等报道的分级评分标准进行肺部炎症病理评分。
Nia等进行了锥头铜弹(phosphor bronze)侵彻半无限混凝土靶板的实验[7],弹体冲击速度为650 ~1 000 m·s-1,混凝土靶材料为39~65.6 MPa 。图10给出了本文模型的预测结果与实验结果的对比,模型采用相同质量的柱形弹来代替实验中的锥头弹进行计算,L0为47.4 mm,r0为2.5 mm,弹、靶材料各参数值列于表1中。
1.2.4 支气管肺泡灌洗液(BALF)的收集与BALF总细胞计数 暴露结束24 h后处死小鼠,进行颈部解剖,暴露气管进行插管,进行支气管肺泡灌洗。BALF经4 ℃,1500 r/min离心10 min后,收集上清并置于-20 ℃冰箱保存。经离心沉淀的细胞成分重悬在光学显微镜下计数。
ISA95标准中,MES也已经被纳入其中,在图1所示的ISA95功能层次模型中,MES位于第3层,负责生产过程的管理。
1.2.7 气道生理评估 用计算机控制的小动物呼吸机(FlexiVent,加拿大)对小鼠进行通气,并通过强迫振荡技术进行呼吸力学的测量。用0、10、25、100 mg/mL的雾化乙酰甲胆碱激发小鼠,并通过每30 s持续5 min的阻力测量来确定气道反应。呼吸阻力(Rrs)测量值(以每秒每毫升气体中的水厘米数表示;cm HO/mL/s)在每个剂量下取平均值,并与初始基线测量值一起绘制成图表。
臭氧是一种与不良健康结局高度相关的氧化性气态污染物。最近,臭氧暴露对健康造成重大不利影响的证据不断增加。本研究成功构建了臭氧暴露所致的小鼠肺部炎症模型,研究的结果显示,与空气对照组相比,臭氧暴露能导致小鼠肺组织会发生明显的炎症病理学变化,在肺组织支气管和肺泡周围出现大量的胶原沉积,炎症因子IL-6、IL-1β、TNF-α、KC、MCP-1等水平均有所上调,气道重塑相关指标MMP-9、MMP-13、TIMP4、COL1A1、TGF-β的mRNA水平上调,气道反应性增高。这与之前臭氧暴露所致的小鼠肺部炎症模型的研究结果一致。
1.2.5 支气管肺泡灌洗液总蛋白和炎症因子的测定BALF 中的总蛋白含量测定采用BCA 法(北京博迈德)。采用双抗夹心酶联免疫法(ELISA)测定BALF中白介素(IL-6)、IL-1β、TNF-α、趋化因子(C-X-C基序)配体1 趋化因子(CXCL1/KC)和单核细胞趋化蛋白(MCP-1)水平,操作步骤严格按照试剂盒说明书进行。
暴露期间各组小鼠正常饮水、进食,各组小鼠体质量在染毒前后无显著差异,小鼠在暴露期间可见呼吸急促、精神萎靡。
2 结果
2.1 小鼠体征
1.2.8 统计学分析 使用SPSS22.0统计软件进行数据分析,Image J 软件计算胶原沉积阳性区域面积,计量资料用均数±标准差表示,两组以上均数比较采用单因素方差分析,两组间均数的比较,采用独立样本检验或′检验。<0.05时认为差异具有统计学意义。
2.2 小鼠基因型鉴定
WT小鼠PCR产物大小为142bp,KO小鼠为120bp。经过电泳检测,结果如图所示(图1)。
2.3 BALF总细胞计数与总蛋白的测定
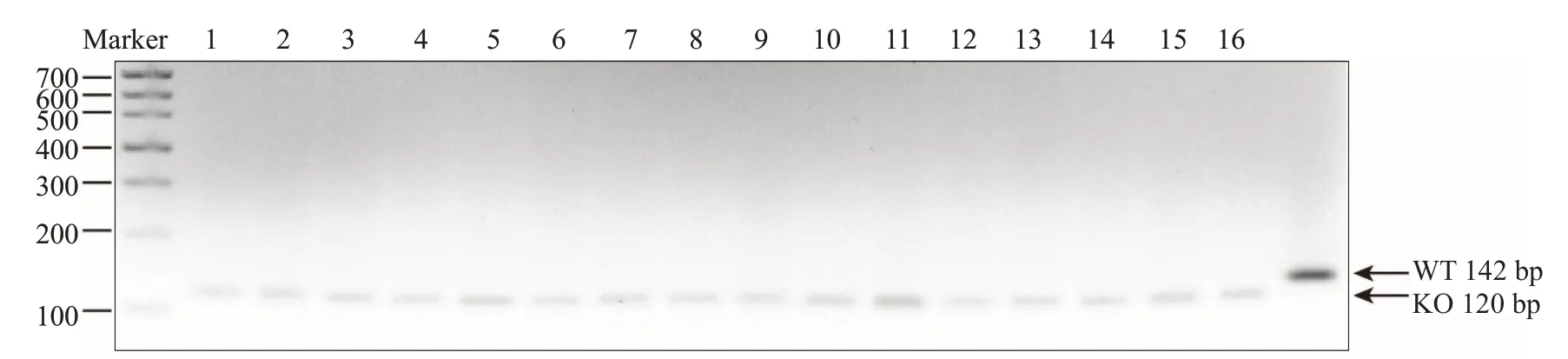
普通光学显微镜下对4组小鼠的BALF中的总细胞进行计数,臭氧暴露的小鼠的总细胞数高于相应的空气组的同基因型小鼠,差异具有统计学意义。臭氧暴露的ACE KO组小鼠的总细胞数高于WT组小鼠,差异无统计学意义(>0.05,图2A);BCA法测定BALF的总蛋白含量,臭氧暴露的小鼠的BALF的总蛋白高于相应的空气组的同基因型小鼠,差异具有统计学意义。臭氧暴露的ACE KO组小鼠的总蛋白含量略高于WT小鼠,差异无统计学意义(>0.05,图2B)。
2.4 肺组织病理观察
乐山市作为一个有千年历史的地区,不但有丰厚的当地特产及资源,更有非常多样的语言种类。四川省发布的相关数据显示,乐山市民族分布比较多样,有大约41个民族定居该地。其中,汉族、回族、苗族及彝族是乐山世代存在的民族成份。在这些民族文化中,语言种类较为多样,在少数民族语言分布中,作为四川杂居地域的主体民族,藏语的使用较为广泛,且有不同地区的方言,还有回族语言、彝族语等多种。而乐山的各地方言种类也是比较多的,以井研县为主的东部分地区大部分为自贡方言的使用地,而市区主要是乐山方言,此外还有嘉南语等方言。得益于乐山市语言的多样性,诸多语言学研究者在做理论研究之前,都会亲自到乐山地区做试点调查。
2.5 BALF中炎症因子的测定
1.2.1 臭氧暴露 采用臭氧发生器产生臭氧,通过调节臭氧发生器(广州创环,CH-KTB)和流量计将臭氧浓度控制在0.8 ppm,并连接动式染毒柜,将臭氧导入动式染毒柜的暴露室中,两组小鼠放入臭氧暴露室,每天暴露3 h,持续5 d。
治疗后,2组患者的膝关节功能评分较治疗前均显著升高(均P<0.05),观察组膝关节评分更高于对照组(P<0.05)。见表1。

2.6 肺组织中气道重塑相关指标的测定
用qRT-PCR检测肺组织匀浆中气道重塑相关指标mRNA的表达。结果表明,臭氧暴露的ACE2 KO小鼠的肺组织中的MMP-9、MMP-13、TIMP4、COL1A1、TGF-β的mRNA水平均明显高于WT组小鼠,两组的MMP-9、TIMP4、COL1A1、TGF-β的mRNA水平差异具有统计学意义(<0.01,图5)。

2.7 气道生理评估
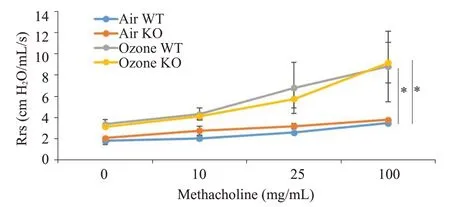
将各组小鼠对乙酰甲胆碱的气道反应进行了直接测量,结果显示,以空气暴露的小鼠比较,臭氧暴露组小鼠增强了对不同剂量乙酰甲胆碱的敏感性。空气暴露组小鼠和臭氧暴露组小鼠在0、10、25、100 mg/mL的乙酰甲胆碱浓度下的气道反应差异无统计学意义(图6)。
3 讨论
1.2.6 荧光定量PCR检测肺组织中气道重塑相关指标的mRNA表达 使用TRIzol试剂(Invitrogen)从肺中提取总RNA,使用逆转录试剂盒(Yeasen)产生cDNA,反应体系及条件参照说明书。使用酷博科技公司q225-0207荧光定量PCR仪器检测MMP-9、MMP-13、金属蛋白酶组织抑制剂(TIMP)4、I型胶原α1(COL1A1)、转化生长因子-β(TGF-β)的转录水平。所有基因表达水平均通过2方法计算,以β-肌动蛋白(β-actin)表达水平标准化。实验中使用的引物序列如表1所示。
李克强同志曾在大会上发言,表明留抵退税的相关问题确实是没有想到的意外,但是也无可厚非,政策的施行总会遇到瓶颈,既然发现了问题,就会出台相应的措施来弥补不足。想要解决这个大麻烦也有许多难点,本来增值税就是多档次税率并存,退税时也会因为这个问题出一些纰漏,再加上退税也加重了财政的负担,因此这也不利于革新之后的发展。
研究表明肺ACE2 缺失会导致PM2.5、吸入酸引起的肺损伤、败血症以及SARS-CoV和SARSCoV-2引起的严重感染。然而,我们对ACE2是否参与了臭氧诱导的肺部炎症及其在臭氧诱导的肺部炎症中生物学机制了解十分有限。本研究的结果显示,臭氧暴露的ACE2 KO小鼠肺组织的炎症病理学变化相比WT组更加严重,ACE2 KO组小鼠肺组织的支气管和肺泡的胶原沉积阳性区域面积较WT 组明显增加,IL-6、IL-1β、TNF-α、KC和MCP-1等炎症因子的水平显著上调,肺组织中气道重塑相关指标的MMP-9、MMP-13、TIMP4、COL1A1、TGF-β的mRNA水平显著升高,这说明暴露于臭氧环境下会诱导小鼠肺部的炎症和损伤,促进相关促炎细胞因子和气道重塑相关指标的释
放,造成实质性细胞损伤,肺泡空间塌陷,气体交换受损,且ACE2的缺失会加重肺组织的炎症与损伤。与之前探讨ACE2在PM2.5、酸雾诱导的肺损伤研究中的结果类似。
根据式(7)得出无偏灰色预测模型的未知参数A、B为:A=-0.035 362,B=7.877 3,则无偏灰色预测模型为:
此外,本研究显示臭氧暴露的WT 小鼠和ACE2 KO小鼠的气道阻力没有出现明显差异。呼吸道上皮形成物理屏障和粘膜免疫的第一道防线,有研究显示,臭氧可直接破坏上皮屏障,细支气管上皮细胞屏障立即受损,细胞应激、脱屑和死亡,1~2 h内即可发现蛋白质和DNA泄漏,引起气道阻力增加。本研究连续暴露5 d,时间略长,这可能与臭氧暴露的两组小鼠气道阻力没有发现差异直接相关。但本研究中检测肺组织匀浆中气道重塑相关指标mRNA 的表达水平,臭氧暴露的ACE2 KO小鼠的明显高于WT组小鼠。我们的结果表明ACE2的缺失会增强臭氧在鼠肺中诱导的气道重塑反应。这与之前探讨ACE2/Ang-(1-7)/Mas 轴参与了哮喘的气道重塑的结果类似。尽管本研究证实了ACE2参与了臭氧诱导的小鼠肺部炎症及气道重塑,但具体的机制仍有待进一步研究,ACE2的缺失与不同时间、浓度臭氧诱导的肺部炎症及气道重塑之间是否存在剂量依赖关系,ACE2的干预是否可以缓解不同时间、浓度臭氧诱导的肺部炎症及气道重塑等仍需进一步的研究来进行阐明。
近年来,ACE2因其作为SARS-CoV-2的主要受体而饱受关注。许多研究发现,ACE2参与了肺部炎症与感染性疾病的过程,包括细菌性肺炎、哮喘、新冠肺炎等。过去的大量报告表明,ACE2可作为一种保护性分子,维持生理稳态并防止多种病理的发展。ACE2 拮抗经典RAS 系统的激活,防止器官损伤,预防高血压、糖尿病和心血管疾病。肺组织具有高RAS活性,是Ang II合成的主要场所。Ang II是一种有效的肺血管收缩剂。RAS 活性参与哮喘的气道重塑,ACE2/Ang-(1-7)/Mas 轴可防止肺成纤维细胞迁移和肺纤维化。外源性Ang-(1-7)可抵消血管紧张素II 的作用,直接抑制TGF-β在肺泡上皮细胞中诱导的上皮间质转化。Ang II不仅能促进血管平滑肌细胞的生长反应,还能直接促进血管重构,预防与肺损伤相关的肺炎和分流。然而,Ang II 也能促进肺水肿的发生,损害肺功能。ACE2 通过将Ang I 转化为Ang(1-9)以及将Ang II转化为Ang(1-7)来调节Ang I和Ang II的水平,后者与MAS和AT2受体结合形成肾素-血管紧张素的“保护臂”系统导致血管舒张、一氧化氮合成增加、抗炎和抗纤维化作用。这抵消了Ang II/AT1臂的“经典”血管收缩、促炎和促纤维化作用。研究表明,ACE2的过度表达可抑制炎症损伤和细胞增殖,从而保护肺、心脏和肾脏免受损伤的影响。ACE2 KO小鼠已被用于与酸吸入、PM2.5相关的肺损伤、败血症和严重感染(例如SARS-CoV、SARS-CoV-2和流感病毒),表明ACE2的缺失会导致急性肺衰竭。有研究显示,在小鼠中敲除ACE2导致ACE/ACE2和Ang II/Ang-(1-7)之间的不平衡,从而加重肺损伤,而外源性ACE2显着减少损伤病变。它抵消了ACE 的功能并负调节了Ang II水平。
综上,ACE2与臭氧诱导的小鼠肺部炎症及气道重塑有关,但是ACE2在臭氧诱导小鼠肺部炎症及气道重塑中的作用与机制还有待进一步研究。

