锁阳黄酮提取纯化工艺优选及吸附特性研究
吕 鑫,顾志荣,祁 梅,张 锐,郭 燕,毛小文,葛 斌*
(1.甘肃中医药大学 药学院,甘肃 兰州 730000;2.甘肃省人民医院 药剂科,甘肃 兰州 730000)
锁阳黄酮(Cynomorium songaricumflavonoids,CSF)提取自锁阳科植物锁阳(Cynomorium songaricumRupr.)的干燥肉质茎[1]。CSF 主要由儿茶素、柑桔素-4-O-吡喃葡萄糖苷、异槲皮苷、表儿茶素、原花青素、表儿茶素没食子酸酯等成分组成[2]。CSF具有抗氧化[3]、延缓衰老[4]、清除自由基及抗癌[5]等多种生理活性。CSF 作为锁阳的有效成分之一,其科学、稳定的提取纯化工艺在药效学研究方面具有关键作用。总结关于CSF 提取纯化的文献,发现提取方法主要有超声波辅助提取法[6]和溶剂提取法[7],纯化方法均为大孔吸附树脂法[8],而关于CSF提取纯化工艺的系统研究未见报道。本研究以CSF提取率为评价指标,首先对CSF 的提取溶剂和提取方法进行考察,在此基础上再进行单因素试验,最后通过正交试验优选提取工艺;查阅文献统计大孔树脂用于黄酮纯化工艺研究中所用树脂类型的频次,选用AB-8、HPD-826、HPD-100、D-101 型大孔吸附树脂进行树脂优选,在最佳提取工艺的基础上,从静态吸附和动态吸附两方面探讨CSF 的纯化工艺,并阐明其吸附特性。首次对CSF 的提取纯化工艺进行系统完整的研究,旨在为进一步开发利用CSF提供参考。
1 材料与方法
1.1 材料与试剂
锁阳,2021年3月采集于内蒙古,经甘肃中医药大学中药鉴定教研室李硕副教授鉴定为(Cynomorium songaricumRupr.)的干燥肉质茎,将其晾至完全干透,粉碎,过二号药典筛,60℃烘干,于干燥器保存备用。芦丁(批号:CHB170303,含量≥98%),购自成都克洛玛生物科技有限公司;所用试剂均为分析纯;水为纯化水。AB-8、HPD-826、HPD-100、D-101 型大孔吸附树脂,均购于武汉市伟琪博星生物科技有限公司,参数见表1。

表1 不同型号大孔树脂的参数Tab. 1 Parameters of different types of macroporous resins
1.2 仪器与设备
紫外-可见分光光度计(UV8100A 型,北京莱伯泰科仪器有限公司),调速多用振荡器(HY-4 型,常州普天仪器有限公司),万分之一电子天平(AL204型,瑞士梅特勒-托利多公司),超声波清洗机(SB25-12DTD 型,宁波新芝生物科技股份有限公司),数显恒温水浴锅(HH-6 型,西安超杰仪器有限公司),真空干燥箱(DZF-6090 型,上海一恒科学仪器有限公司),低速大容量离心机(DD-5M 型,湘仪离心机仪器有限公司),EV351 旋转蒸发仪(北京莱伯泰科仪器有限公司)等。
1.3 试验方法
1.3.1 CSF的提取工艺
取锁阳粉末约50 g,按照所考察的工艺参数设定(即一定的提取时间、提取温度、液料比及乙醇浓度)进行回流提取,提取结束后,将提取液趁热过滤,滤液浓缩至无醇味,定容于250 mL容量瓶中。
1.3.2 对照品溶液制备
精密称取芦丁对照品10 mg,用50%乙醇溶解并定容至50 mL 容量瓶中,摇匀,置于4℃药品保存箱。
1.3.3 检测波长选择[9]
取“1.3.2”项下对照品溶液2.5 mL 于10 mL 容量瓶中,先加入5%亚硝酸钠(NaNO2)溶液0.4 mL,振荡摇匀,静置6 min;再加入10%硝酸铝[Al(NO3)3]溶液0.4 mL,振荡摇匀,静置6 min,最后加4 mL10%氢氧化钠(NaOH)溶液,振荡摇匀,放置15 min,待显色结束用50%乙醇溶液定容至刻度。以50%乙醇溶液为参比,在波长200~800 nm 进行全波长扫描,结果表明在513 nm处有最大吸收。
1.3.4 标准曲线的建立
精密量取“1.3.2”项下溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL,分 别 置 于10 mL 容 量 瓶 中,同“1.3.3”方法显色,测定吸光度,绘制标准曲线,A=12.036 0C+0.009 3,r=0.999 5,表明线性范围在0.01~0.08 mg/mL。
1.3.5 方法学考察
1.3.5.1 精密度考察
精密吸取“1.3.2”项下溶液1.0 mL 于10 mL 容量瓶中,按“1.3.3”项下方法测定A513,连续测定6 次,A513值分别为0.241 9、0.241 9、0.241 6、0.241 8、0.241 9、0.241 9,RSD为0.05%,表明仪器精密度良好。
1.3.5.2 重复性考察
取锁阳粕粉约2g,加12 倍量75%乙醇,80℃回流提取60 min,趁热过滤,滤液浓缩至无醇味,定容于25 mL容量瓶中,再精密量取0.1 mL定容至25 mL容量瓶中供后续测定使用。精密吸取1.0 mL于10 mL容量瓶中(下同),按“1.3.3”项下方法测定A513,A513值分别为0.572 9、0.562 0、0.572 3、0.545 1、0.552 5、0.567 3,RSD为2.0%,CSF 的 质 量 分 数 分 别 为146.33、143.50、146.18、139.11、141.04、144.88 mg/g,RSD为2.03%,表明该方法重复性良好。
1.3.5.3 稳定性实验
精密吸取上述1.0 mL 供试品溶液于10 mL 容量瓶中,按“1.3.3”项下方法分别在0、10、20、30、40、50、60 min 测定A513,A513值分别为0.571 6、0.569 4、0.564 2、0.570 0、0.559 8、0.561 4、0.562 8,RSD为0.83%,表明样品在1 h内稳定。
1.3.5.4 加样回收率
精密吸取6份上述供试品溶液各1.0 mL于10 mL容量瓶中,分别加入一定量的芦丁标准溶液,按“1.3.3”项下方法分别测定A513,得平均加样回收率为98.79%,RSD为2.12%,结果表明本方法回收率良好。
1.3.6 大孔树脂的预处理和再生处理
参照安晓婷[10]和冯靖[11]对树脂的预处理和再生处理方法。
1.3.7 大孔树脂的吸附解吸实验
锥形瓶中加入优选得到的树脂2 g,加入一定质量浓度的CSF 提取液25 mL,将锥形瓶置于调速多用振荡器中,频率为120次/min,振荡24 h,使之达到吸附平衡,取样,测定A513,计算吸附率。
将达到吸附平衡的树脂用纯化水清洗后,加入70%乙醇25 mL,同上振荡24 h,使之达到解吸平衡,取样,测定A513,计算解吸率。
1.4 数据处理方法

式中:c为质量浓度,v为提取液体积,n为稀释倍数,m为锁阳粗粉质量,C0、Ce分别为吸附前、后吸附液中CSF的质量浓度,V、Vd分别为吸附液、解吸液的体积,m为树脂质量,Cd为解吸液浓度。
2 结果与分析
2.1 提取工艺优化
2.1.1 提取溶剂和提取方法考察
为探究最高提取工艺,在单因素试验前期,设定一定的提取时间、提取温度、液料比及乙醇浓度,对提取溶剂和提取方法进行考察,结果显示醇提和水提的提取率分别为11.13%、8.56%;回流提取和超声提取的提取率分别为13.47%、12.02%。因此,本研究采用热乙醇回流提取CSF,在此基础上进一步进行后续单因素试验。
2.1.2 单因素试验
分别准确称取6份锁阳粗粉,设计单因素试验,因素与水平见表2,以CSF 为指标确定各因素的中心点。具体操作如下:
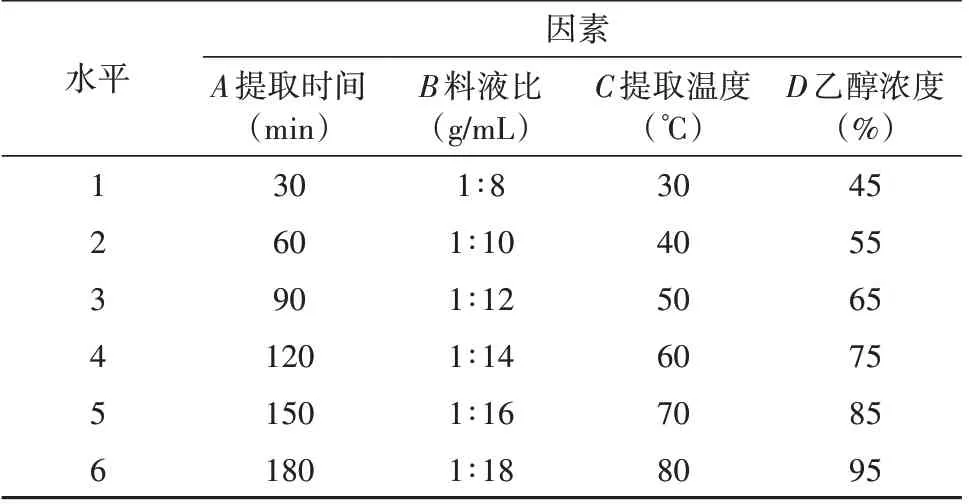
表2 单因素试验因素与水平Tab. 2 Parameters of different types of macroporous resins
设定料液比1∶10,提取温度80℃,乙醇体积分数75%,按A列进行提取,由图1 可知:在90 min 以前,提取率与提取时间成正比,之后成反比,原因可能是受热过久导致CSF某些不耐热成分被破坏从而提取率降低[12]。因此,选择90 min 作为提取时间的中心点;设定提取时间为90 min,提取温度为80℃,乙醇体积分数为75%,按B列进行提取,由图2 可知:当料液比小于1∶12时,提取率与料液比成正比,之后成反比,可能当料液比增加到一定程度后,黄酮类成分基本溶出,再继续增加杂质的溶出也相继增加。因此,选择1∶12 作为料液比的中心点;设定提取时间为90 min,料液比为1∶12,乙醇体积分数为75%,按C列进行提取,由图3可知:70℃时提取率最高,70℃之前提取率随温度的升高而增大,之后反而减小,这可能是因为高温会破坏组织细胞,低温达不到溶出温度[13]。因此,选择70℃作为提取温度的中心点;设定提取时间为90 min,料液比为1∶12,提取温度为70℃,按D列进行回流提取,由图4 可知:乙醇浓度为65%时,提取率达到最大,而继续增加乙醇浓度时,提取率逐渐降低。其原因可能在于随着乙醇浓度的逐步增加时,某些脂溶性成分(醇溶性色素、亲脂性成分等)溶出量也随之增加,这些成分会与黄酮同时竞争乙醇-水分子,导致提取率呈现出降低的趋势[14]。因此,选择65%作为乙醇浓度的中心点。
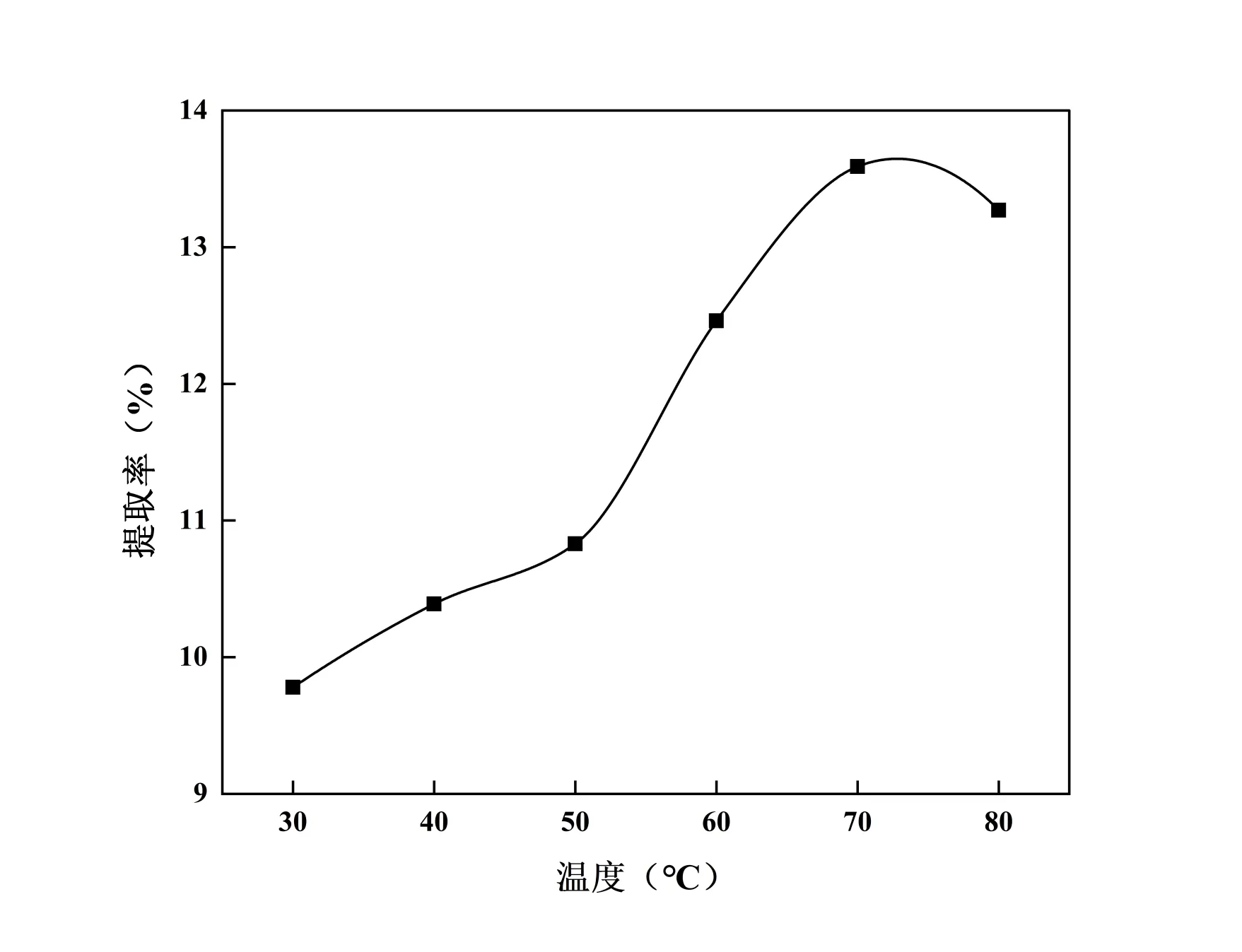
图3 提取温度对提取率的影响Fig.3 Effect of extraction temperature on extraction rate
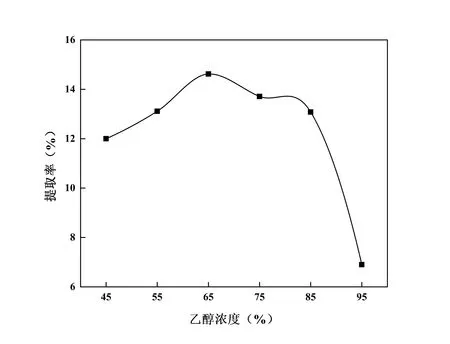
图4 乙醇浓度对提取率的影响Fig.4 Effect of ethanol concentration on extraction rate
2.1.3 正交试验
在“2.1.2”基础上,设计L9(34)正交试验,以CSF提取率为评价指标筛选最佳提取工艺,因素水平见表3,结果见表4,方差分析见表5。结果显示,4 个因素对CSF 提取率的影响依次为D>C>B>A,其中以乙醇浓度和提取温度的影响较为显著。所得CSF的最佳提取条件为A3B2C3D2,即提取时间为120 min,料液比1∶12 g/mL,提取温度80℃,乙醇浓度65%。在此条件下进行重复提取3批样品进行验证试验,CSF平均提取率可达19.95%,RSD为2.43%,见表6。
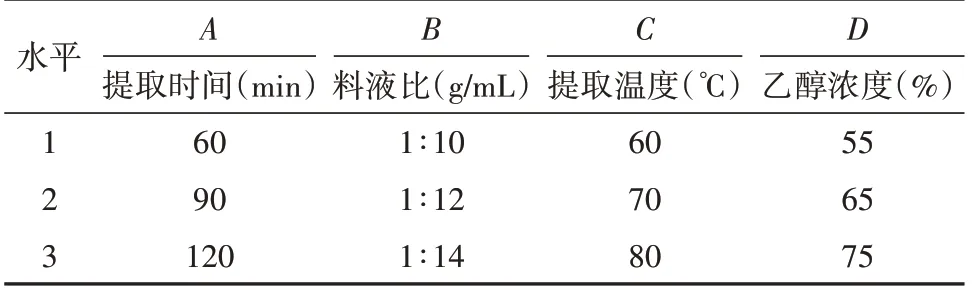
表3 因素与水平Tab.3 Factors and levels
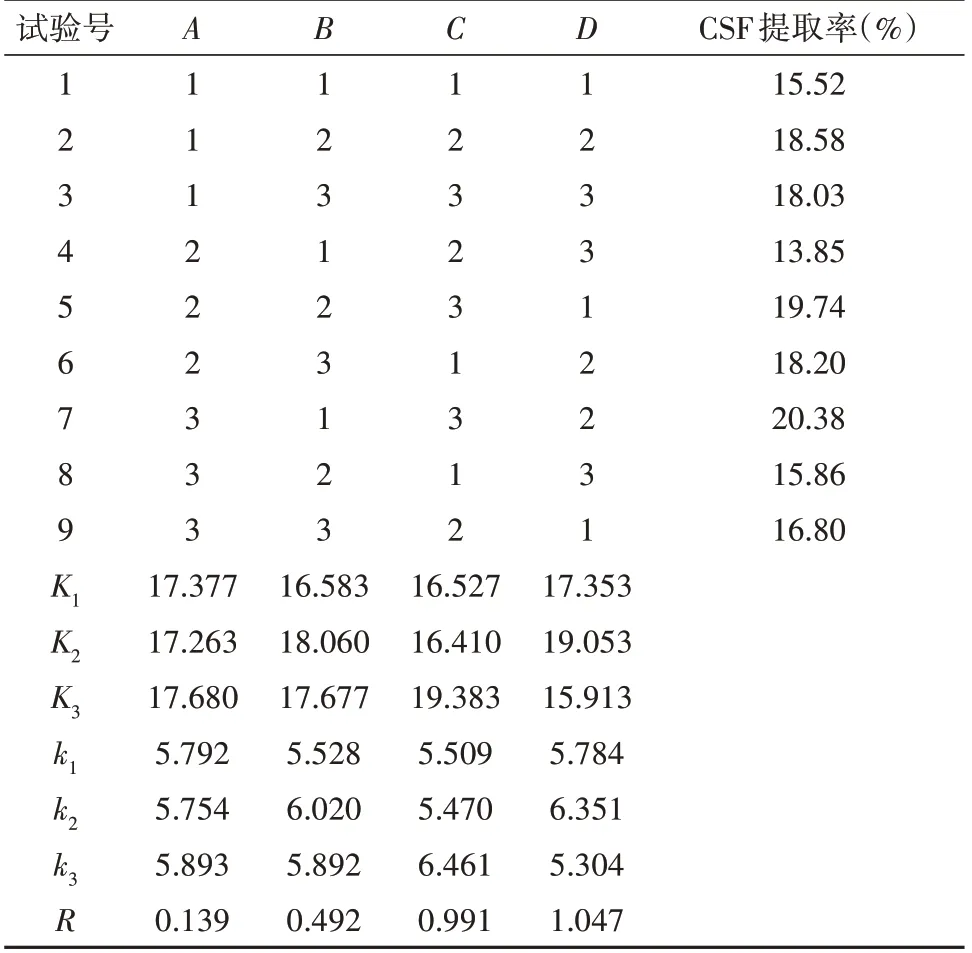
表4 正交试验结果Tab.4 The results of orthogonal experiments
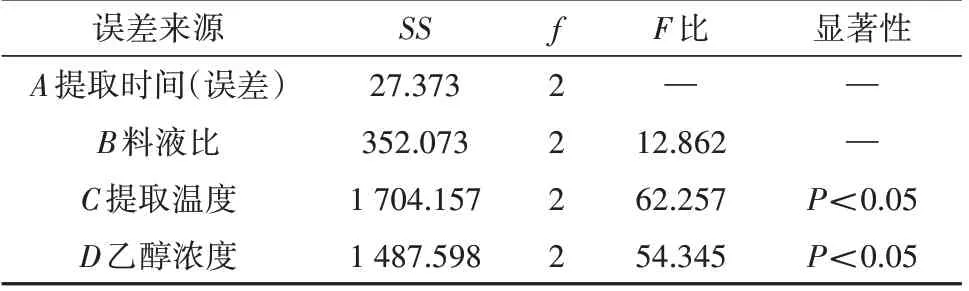
表5 方差分析Tab. 5 Analysis of variance
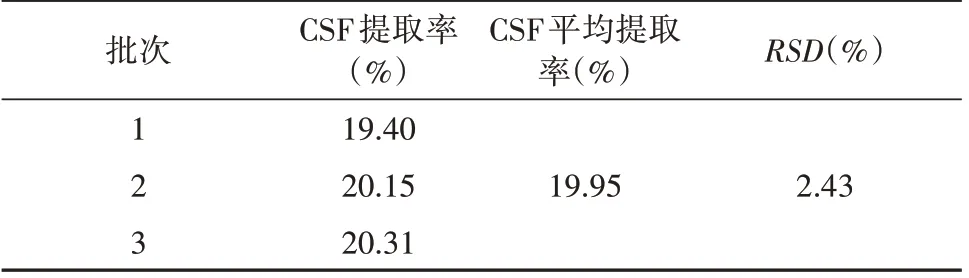
表6 验证试验Tab. 6 Confirmatory experiment
2.2 大孔树脂的筛选
统计大孔树脂用于黄酮纯化工艺相关文献中所用树脂类型的频次,选择排名前4 的大孔树脂类型,以吸附率、吸附量、解吸率、解吸量为指标筛选树脂。由表7可知,4种大孔树脂均具有较高的吸附率,但HPB-826 同时具有最高的吸附率和解吸率,因此,本研究选择HPD-826 型大孔树脂作为后续研究。
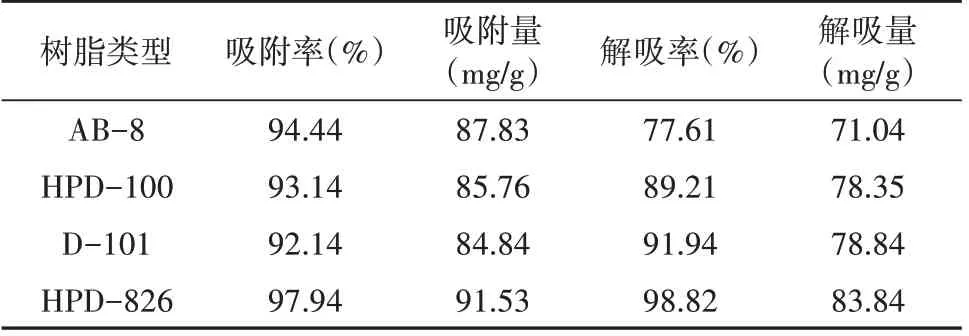
表7 4种大孔树脂的吸附与解吸效果比较Tab.7 Comparison of adsorption and desorption effects of four macroporous resins
2.3 吸附特性考察
2.3.1 树脂的吸附动力学考察
吸附动力学研究有助于在实际工业化生产中优化工艺参数及选择加工设备[15],本研究对HPD-826 大孔树脂纯化CSF 进行吸附动力学考察。精密称取2.0 g HPD-826 大孔树脂,进行静态吸附,在不同吸附时间下取样,分别测定CSF质量浓度,计算吸附量。用准一级、准二级动力学模型和颗粒内扩散模型[16]对数据进行拟合,结果见图5、表7。
图5(A)所示,吸附量在120 min 前随时间延长而显著增加,之后趋于缓慢,在270 min 达到平衡。由表8 可知,准一级吸附动力学模型方程计算得到的理论平衡吸附量(90.55 mg/g)与试验值(91.72 mg/g)更为相近,可能较好地描述CSF 静态吸附过程。图5(B)显示,颗粒内扩散模型拟合图为不经过原点的非线性三段式图,说明吸附的过程是一个连续性的分段过程,由液膜扩散和颗粒内扩散共同控制[17]。
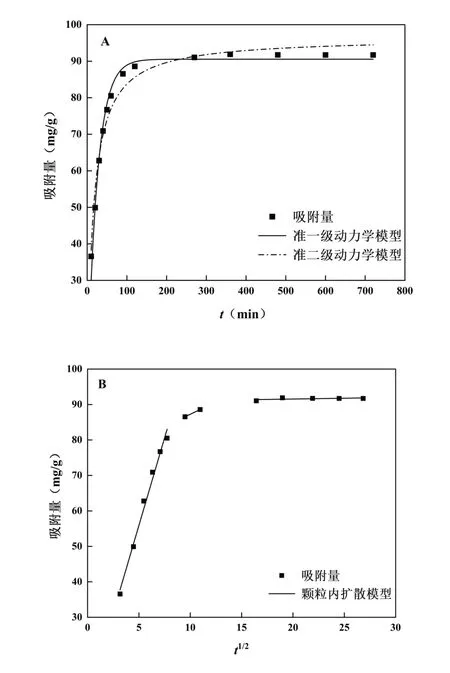
图5 吸附动力学拟合曲线Fig. 5 Adsorption kinetics fitting curve
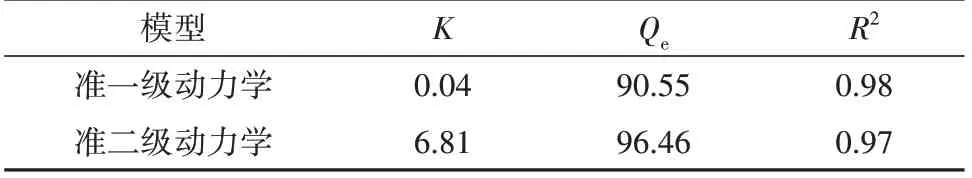
表8 CSF吸附动力学参数Tab. 8 Adsorption kinetic parameters of total flavonoids
2.3.2 树脂的吸附等温线考察
图6 建立了Langmuir 和Freundlich 模型拟合曲线,从表9 可看出,Langmuir 模型拟合的回归方程相关系数总体高于Freundlich 模型,说明Langmuir 吸附等温线更能准确反映CSF 在HPD-826 型树脂上的吸附过程,并表明吸附是单分子层吸附,所有吸附位点均匀且具有相同的能量,被吸附分子之间没有相互作用[18]。

表9 CSF吸附等温线参数Tab. 9 Adsorption isotherm parameters of CSF
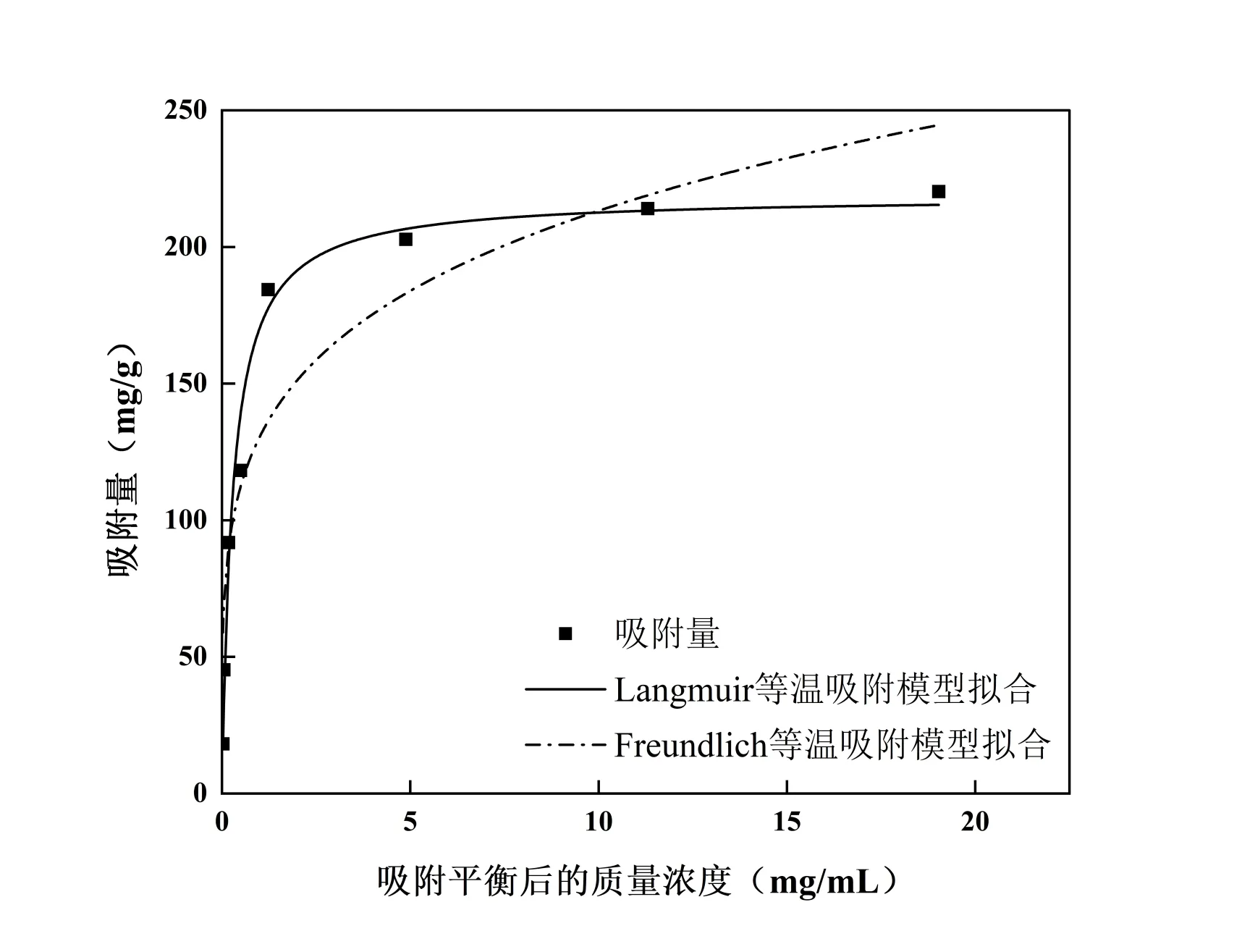
图6 吸附等温线模型拟合曲线Fig. 6 Fitting curve of adsorption isotherm model
2.3.3 纯化工艺参数优选
2.3.3.1 上样溶液pH对静态吸附的影响
精密称定8份2 g预处理好的HPD-826树脂,依次加入质量浓度为7.63 mg/mL,pH 值为2、3、4、5、6、7、8、9 的CSF 提取液25 mL,置于振荡器中振荡12 h,测定吸附液中的CSF 质量浓度,结果见表10。可知,当pH≤7 时,对吸附率无显著影响;pH>7 时,吸附率和解吸率均呈现下降趋势;在pH=5 时,有最大吸附率和解吸率,故pH值确定为5。
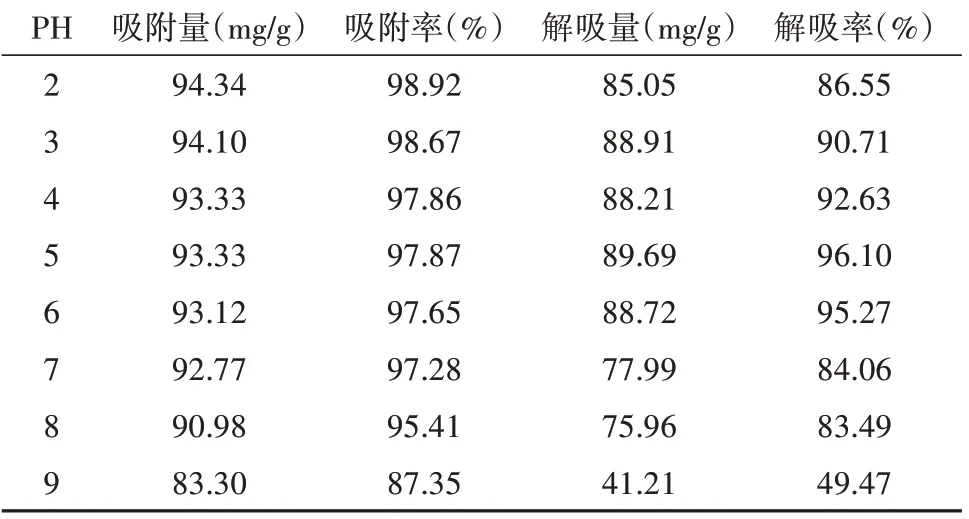
表10 pH值对CSF吸附与解吸的影响Tab. 10 Effect of pH on the adsorption and desorption of CSF
2.3.3.2 泄露曲线的绘制
在径高比为1∶6、上样浓度为7.63 mg/mL、pH 为5、体积流量为1.0 mL/min 的条件下,进行动态吸附实验,分段收集流出液,10 mL/份,计算CSF 含量,并绘制泄露曲线,寻找泄漏点[19]。结果见图7,从第2份收集液开始,CSF 开始明显泄露;在第15 份流出液中,CSF 质量浓度达到了上样质量浓度的1/10(泄漏点),因此选择上样体积为150 mL。
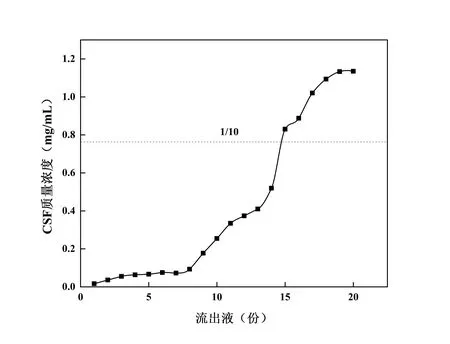
图7 泄漏曲线Fig. 7 Leakage curve
2.3.3.3 上样液浓度对动态吸附的影响
在径高比为1∶6、pH为5、体积流量为1.0 mL/min的条件下,分别配置上样浓度为3.71、7.63、10.00、15.98、21.11、28.43 mg/mL 的上样液各150 mL,分别收集流出液,计算不同浓度条件下的吸附率和吸附量,确定最佳上样浓度,结果见图8,发现吸附率随着上样浓度的加大而减小,吸附量随着上样浓度的增大先增大后减小,在上样浓度为15.98 mg/mL达到最大值。由于浓度太低致使树脂没有得到充分利用,且延长纯化周期;若浓度太高则致使CSF 溶液没有得到充分吸附,还会造成树脂空间结构的堵塞,不易洗脱,故选择上样质量浓度为15.98 mg/mL。
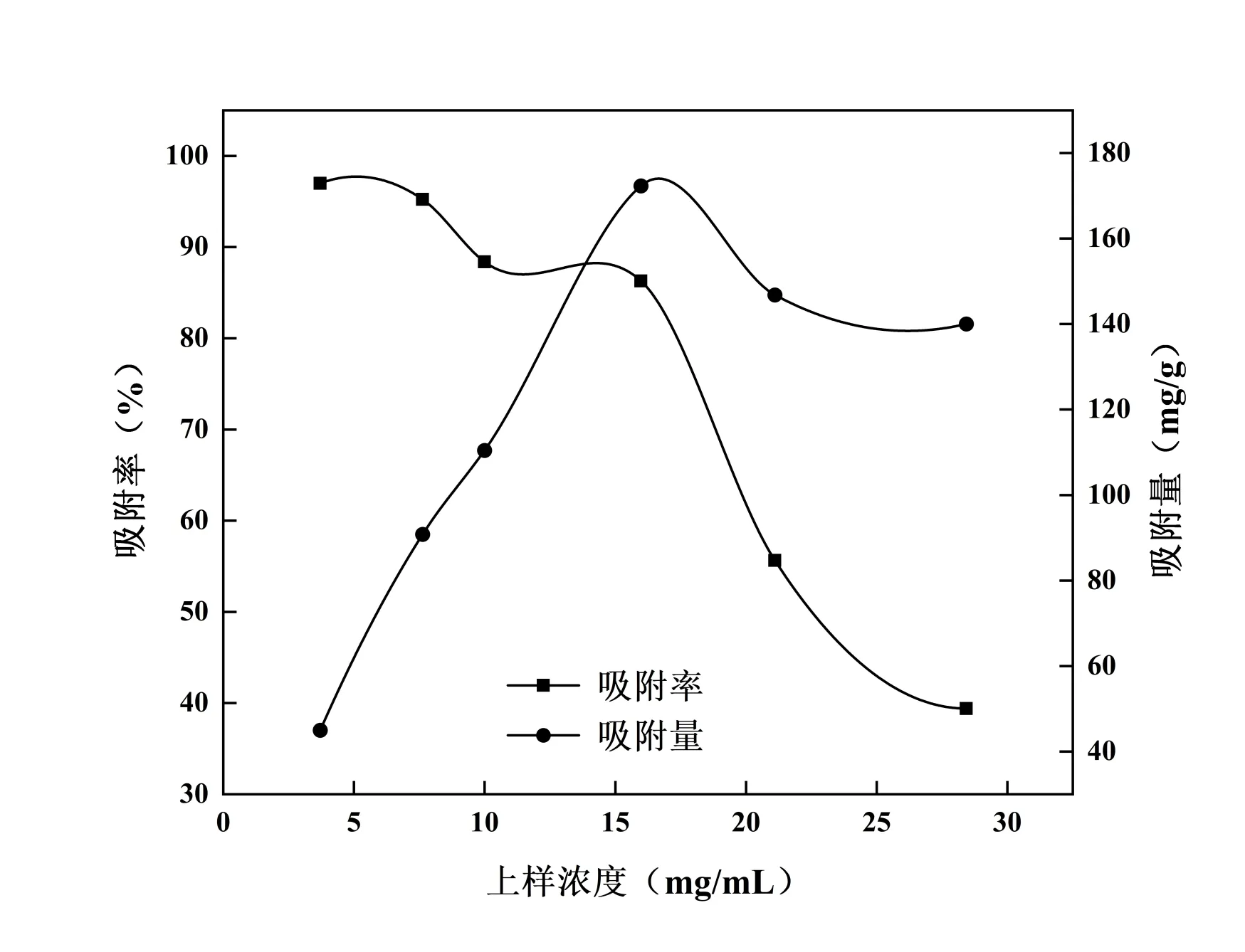
图8 上样浓度对吸附效果的影响Fig. 8 Effect of sample concentration on adsorption effect
2.3.3.4 上样体积流量对动态吸附的影响
设置径高比为1∶6,配置上样浓度为15.98 mg/mL、pH 为5 的4 份CSF 溶液各150 mL,分别以1.0、2.0、3.0、4.0 mL/min的体积流量通过树脂柱,分别收集流出液,计算吸附率,确定最佳上样体积流量。结果见图9,随着上样体积流量的增加,吸附率呈显著下降趋势,可能是流速过快导致CSF 与树脂接触不充分,因此选择上样体积流量为1 mL/min。

图9 上样体积流量对吸附效果的影响Fig. 9 Effect of sample volume flow rate on adsorption influence
2.3.3.5 径高比对动态吸附的影响
设置径高比为1∶6、1∶8、1∶10、1∶12,将15.98 mg/mL、pH 为5 的CSF 溶 液150 mL 分 别 以1.0 mL/min 的 体积流量通过树脂柱,分别收集流出液,计算不同径高比下的吸附率和吸附量,确定最佳径高比。结果见图10,随着径高比增大,吸附率呈显著增长趋势,而吸附量呈显著下降趋势。当径高比为1∶12时,虽有最大吸附率,但由于树脂床层过高,上样液穿透能力较差,耗时长延长生产周期,树脂容易堵塞,且实验过程中发现,待吸附完全后靠近吸附柱下部的部分树脂仍为乳白色,表明树脂没有得到充分利用。因此,本研究选择径高比为1∶10(即1 g 树脂可较好的吸附7.69 mL CSF溶液)。
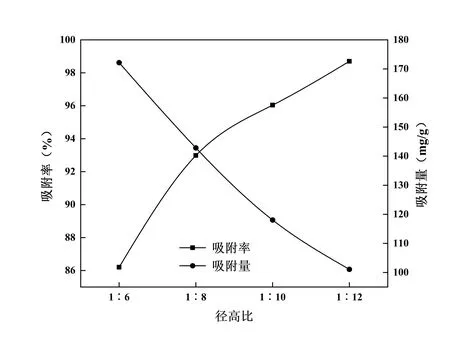
图10 径高比对吸附效果的影响Fig. 10 Effect of diameter-height ratio on adsorption influence
2.3.3.6 水洗脱曲线
结果见图11,当水洗用量达到160 mL 时,大部分未被吸附的CSF 及杂质已经被洗脱下来;160 mL之后,水洗脱曲线基本趋于平衡,故本研究选择水洗用量为160 mL。
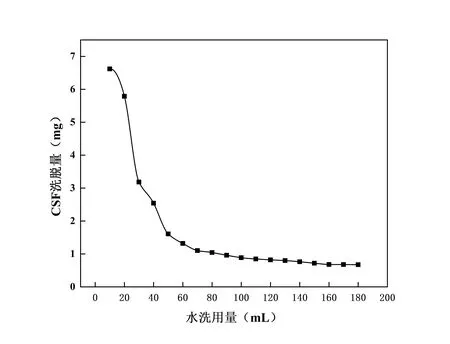
图11 水洗脱曲线图Fig. 11 Water elution curve
2.3.3.7 洗脱溶剂对静态解吸的影响
分别称取10 份2 g 达到吸附平衡的树脂置于锥形瓶中,依次加入浓度为10 %~100 %乙醇溶液25 mL,置于振荡器上振荡24 h,使之达到解吸平衡,计算解吸率。结果见图12,当洗脱液浓度为50%时解吸率最高,为97.53%。再继续升高洗脱液浓度,解吸率呈现下降趋势,可能是浓度过高破坏了黄酮类化合物结构[20]。
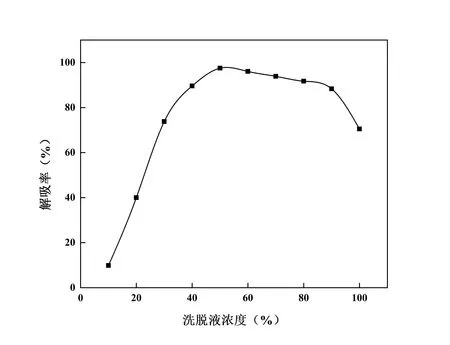
图12 洗脱液浓度对CSF解吸效果的影响Fig. 12 Effect of eluent concentration on desorption of CSF
2.3.3.8 溶剂洗脱曲线
用50%乙醇对吸附饱和的HPD-826 树脂进行解吸,每10 mL 收集1 份,期间洗脱液颜色变化为:无色(10 mL)→黄色(20 mL)→酒红色(30 ~40 mL)→黄色(50 ~70 mL)→浅黄色(80 ~120 mL)→无色(130 ~200 mL)。测量A513,计算CSF浓度,结果见图13,随着溶剂洗脱用量的增加,CSF 浓度先增加,继而降低,当洗脱溶剂达到120 mL 时溶剂洗脱曲线趋于平衡,综合考虑时间成本,本研究选择洗脱溶剂用量为120 mL。
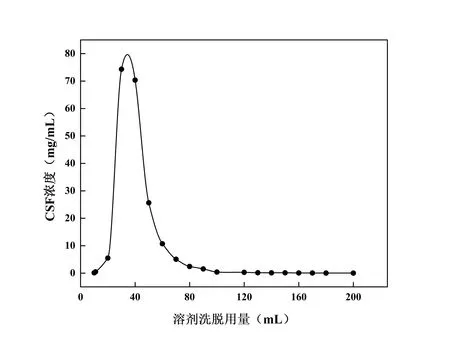
图13 溶剂洗脱曲线图Fig. 13 Solvent elution curve
2.3.3.9 洗脱流速对动态解吸的影响
结果见图14,随着洗脱流速的逐渐增大,解吸率先升高后减低,在2 mL/min 时解吸效率最高。可能原因为流速过快导致50%的乙醇与CSF 溶液在HPD-826 树脂上的吸附位点接触时间短,不足以将CSF全部解吸,因此本研究选择洗脱流速为2 mL/min。
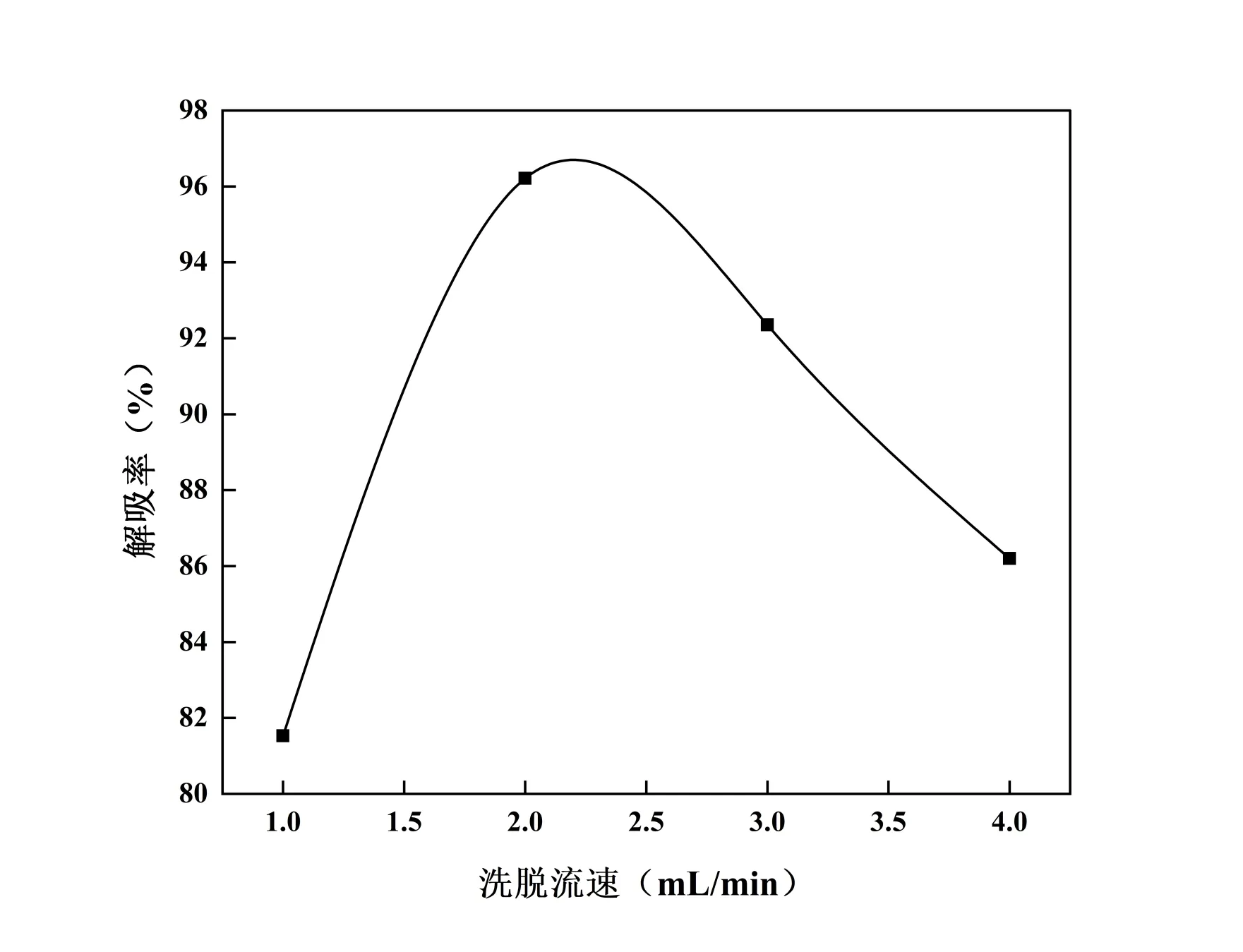
图14 洗脱流速对解吸效果的影响Fig. 14 The influence of eluent rate on desorrtion properby
2.4 验证试验
按照最佳工艺条件,对CSF 进行动态吸附与解吸,将洗脱后的溶液进行旋蒸、真空干燥,得到纯化后的CSF,对其进行纯度检测,结果见表11。可知,经最佳工艺纯化后,CSF 纯度由17.02%提高到88.86%;3次试验RSD值为0.95%,符合要求,表明本试验方案可行。

表11 CSF纯化前后纯度对比Tab. 11 ComparisonofpurityofCSFbeforeandafterpurification
3 结论
大孔树脂在黄酮类活性部位的分离纯化研究中具有良好的吸附性和反复利用等特点,通过物理作用将黄酮类物质吸附在自身孔隙中,从而达到有效分离纯化的目的[21]。本研究首先对提取溶剂和提取方法进行考察,在此基础上进一步进行单因素试验和L9(34)正交试验,旨在选出最佳提取工艺,最终得出以65%乙醇作溶剂,热回流提取120 min,料液比1∶12 g/mL,提取温度80℃,CSF 提取量为19.95%。所选用于纯化工艺的HPD-826 树脂是一种新型的氢键树脂,多用于多酚类、黄酮类、有机酸类等多羟基成分的提取分离,其吸附动力学符合准一级吸附动力学模型,吸附等温线符合Langmuir 吸附等温线模型,属于单分子层吸附。本研究还对纯化工艺参数进行了系统考察,如上样溶液pH、上样液浓度、上样体积流量、径高比、水洗脱用量、洗脱溶剂浓度、洗脱流速等,使其纯度较未纯化前提高了5.22 倍,验证试验结果显示,工艺稳定可行,表明大孔树脂HPD-826 用于CSF 纯化效果较好,为进一步开发利用CSF提供了有力支持。

