密旋链霉菌Act12中调控因子AdpA-s和LuxR-2306 对寡霉素合成的影响
颜华,赵康康,张媛,陈欢,郝鹏泽,贾良辉
(西北农林科技大学 生命科学学院,杨凌 712100)
链霉菌是一类具有分枝状菌丝体的革兰氏阳性菌,抗生素的主要来源之一,链霉素、四环素、万古霉素等均由链霉菌合成[1].链霉菌次生代谢是在特定生长状态下,受形态分化、环境胁迫的影响而进行的[2],受到多层次严密调控.通常,次生代谢过程会受全局性和途径特异的调控因子的控制[3-4].全局性调控基因常位于次生代谢合成基因簇外部,负责对碳氮源、pH、盐离子浓度等环境信号做出响应,调控下游基因的表达;全局性调控基因可能控制多种代谢途径并间接地影响次生代谢[5-7].而途径特异性调控基因常位于次生代谢合成基因簇内部,直接影响簇内基因的表达.
寡霉素是一类由放线菌产生的二十六元大环内酯类化合物,具有多种生物学活性.寡霉素对黑曲霉(Aspergillus niger)、新月弯孢菌(Curvularia lunata)、多孔木霉(Tolypocladium inflatum)等有显著的抑制活性[8].寡霉素能诱导细胞程序性死亡具有抗肿瘤活性.在以线粒体为靶标的37000 个化合物对人类60个肿瘤细胞株的抗癌活性试验中,寡霉素是效果最好的37 种化合物之一[9].寡霉素也能抑制线粒体氧化磷酸化,被广泛应用于线粒体功能紊乱有关疾病及程序性死亡等相关研究[10].目前,虽然寡霉素尚未被利用在临床上,但作为ATP 合酶抑制剂,具有重要的科学意义.而且,寡霉素抑制多种病原真菌的能力,预示了其在农业上的应用潜力.
密旋链霉菌(Streptomyces pactum)Act12 全基因组预测含有30 个次生代谢合成基因簇.其中,寡霉素合成基因簇全长183189 bp,有9 个可能的核心生物合成酶基因、10 个可能的调控基因.最靠近核心生物合成酶基因的两个调控基因分别是LuxR-2306、LuxR-2307,推测其可能作为途径特异调控因子控制寡霉素的生物合成. 灰色链霉菌(Streptomyces griseus)中,全局性调控因子AdpA 可激活许多与形态分化和次生代谢相关基因的表达,使其分化形成气生菌丝和孢子,同时合成链霉素和黄色色素[11].在密旋链霉菌Act12 中,也存在AdpA 的同源基因AdpA-s(为便于区分,将 Act12 中的 AdpA 同源基因命名为AdpA-s),推测其可能作为全局性调控因子控制Act12的形态分化和次生代谢.
1 材料和方法
1.1 材料
1.1.1 菌株和质粒
菌株:密旋链霉菌(Streptomyces pactum)Act12;大肠杆菌(Escherichia coli)DH5α、S17-1;苹果腐烂菌(Valsa mali). 质粒:大肠杆菌-链霉菌穿梭质粒pKC1139(Aprr),含链霉菌温度敏感pSG5 复制子,用于构建阻断突变株;pSET152::PermE*,含红霉素抗性基因的强启动子,用于构建高表达菌株(均由本实验室保存).
1.1.2 培养基和培养条件
培养链霉菌使用高氏一号固体培养基;链霉菌种子培养采用TSB 培养基;链霉菌发酵采用SPY 培养基(胰蛋白胨0.2%,酵母提取物0.4%,可溶性淀粉1%,氯化钠0.8%,pH 7.2);结合转移采用2CMY 培养基(胰蛋白胨0.2%,可溶性淀粉1%,氯化钠0.1%,硫酸铵0.2%,磷酸氢二钾0.1%,碳酸钙0.2%,硝酸钾0.1%,无机盐溶液,琼脂1.6%);苹果腐烂菌培养采用PDA 培养基.大肠杆菌培养采用LB 培养基.链霉菌培养温度为28 ℃;苹果腐烂菌培养温度为30 ℃;大肠杆菌培养温度为37 ℃.
1.1.3 引物
引物由上海生工合成,引物序列见表1.划线序列代表基因特异性引物,未划线代表同源臂.

表1 PCR引物序列Tab.1 PCR primer sequence
1.1.4 抗生素、酶
安普霉素(Apr)、卡那霉素(Kan)、萘啶酮酸(Nal)均配成100 mg/mL 高浓度储备液于-20 ℃保存. LB 培养基中,安普霉素使用浓度是50 μg/mL.高氏一号和2CMY 培养基中,安普霉素和卡那霉素使用浓度是10 μg/mL,萘啶酮酸使用浓度是25 μg/mL.限制性内切酶和基因转录分析相关的酶均购自赛默飞.高保真DNA 聚合酶购自TaKaRa.同源重组酶购自南京诺唯赞.Trizol 试剂购自北京擎科.
一入秋冬,皮肤就干燥脱屑、奇痒难耐,一脱衣服甚至能欣赏到“静电噼啪如闪电,漫天皮屑似白雪”的胜景,那画面太美不敢看……你的皮肤为何如此脆弱?
1.2 阻断突变株和高表达菌株的构建
1.2.1 阻断突变株的构建
整个过程分两阶段完成,即构建重组密旋链霉菌Act12(pKC1139-U-KANA-D)和筛选双交换基因阻断菌株.
构建Act12(pKC1139-U-KANA-D):首先,通过多片段同源重组的方法构建S17-1(pKC1139-UKANA-D).然后,通过结合转移的方式将重组质粒转入Act12中,获得Act12(pKC1139-U-KANA-D).
筛选双交换基因阻断菌株:将Act12(pKC1139-U-KANA-D)涂布于高氏一号固体培养基(kan+),40 ℃培养一周左右,挑取单克隆孢子接种至高氏平板,28 ℃扩大培养.然后,将单克隆孢子接种于TSB培养基(Kan+Apr+),28 ℃、140 r/min 培养,不能生长的推定为双交换基因阻断株.最后通过测序验证,获得发生双交换的基因阻断菌株.
1.2.2 高表达菌株的构建
首先,采用同源重组的方法构建重组大肠杆菌S17-1(pSET152::PermE*-Target gene).然后,通过结合转移的方式将重组质粒转入Act12 中,获得高表达菌株Act12(pSET152::PermE*-Target gene).
1.3 密旋链霉菌Act12 在发酵培养基(SPY)中生长曲线测定
从培养Act12的高氏一号固体培养基(7 d)中刮取1 cm2的新鲜孢子接种于含有100 mL TSB 种子培养液的250 mL 锥形瓶中,28 ℃、180 r/min 培养2 d.按1∶10 的比例接种于含有40 mL SPY 发酵培养液的 100 mL 锥形瓶中,28 ℃、180 r/min 发酵培养 .每隔12 h 取样,抽滤、蒸发至恒重后,称量细胞干重.每组3 个重复.以培养时间(h)为横坐标,细胞干重(g)为纵坐标绘制生长曲线.
1.4 发酵产物抑菌活性测定
种子液培养同1.3,然后按1∶10 的接种量接种于含有200 mL SPY 发酵培养液的500 mL 锥形瓶中,28 ℃、180 r/min培养7 d.将发酵液按1∶1的比例用乙酸乙酯萃取两次(发酵液与乙酸乙酯混合后,于摇床中18 ℃、115 r/min 旋涡震荡萃取24 h),并收集上层有机相(约400 mL)后,旋转蒸发仪蒸干. 2 mL 甲醇溶解萃取剩余物,0.45 μm 有机滤膜过滤除菌后,-20 ℃保存.
抑菌实验采用滤纸片法.取活化后直径为0.5 cm的苹果腐烂菌菌饼,置于新的PDA 平板的中央.在距离中央相等的位置放4 张直径为0.6 cm 的滤纸片,其中一张滤纸片上滴加15 μL甲醇,另外三张滤纸片上分别滴加15 μL发酵萃取液.30 ℃培养2~3 d,记录抑菌圈大小.
1.5 发酵液中寡霉素的HPLC分析
高效液相色谱采用C18 反向层析柱,以甲醇为流动相.梯度洗脱程序为:0~5 min 10%甲醇、5~35 min 10%~100%甲醇、35~45 min 100% 甲醇、45~50 min 100%~10%甲醇.进样量10 μL,流速1 mL/min,检测波长210 nm.
1.6 基因的转录分析
收集发酵培养4 d 的菌体提取总RNA,方法参照北京擎科Trizol 试剂盒说明书.cDNA 的合成及实时荧光定量PCR的操作参考Thermo Fisher Scientific试剂公司相关产品的说明书.
2 结果与分析
2.1 发酵萃取液抑生活性检测
Act12、LuxR-2306 HE、Spa LuxR-2306、AdpA-s HE、Spa AdpA-s 菌株对苹果腐烂菌的抑生活性实验结果表明(图1),阳性对照100 μg/mL 的寡霉素A/B/C 混合物(甲醇溶液配制)对苹果腐烂菌表现出极强的抑生活性(图1(b)).较于野生型Act12,Spa LuxR-2306 菌株完全失去了对苹果腐烂菌的抑生活性,LuxR-2306 HE 菌株对苹果腐烂菌的抑生活性更强(图1(c)).然而,同样与野生型比较,Spa AdpA-s 对苹果腐烂菌的抑生活性无显著差别,AdpA-s HE抑制苹果腐烂菌生长的能力则要更强(图1(d)).这说明AdpA-s和LuxR-2306均能增强对苹果腐烂菌生长的抑生活性,且可能是以促进抑菌物质的合成来实现的.

图1 发酵萃取液对苹果腐烂菌的抑生活性检测Fig.1 The antimicrobial activity test of extrated fermentation
2.2 发酵萃取液中寡霉素D含量的检测
较于野生型 Act12(图 2(b)),Spa LuxR-2306 彻底丧失了合成寡霉素D 的能力(图2(c)),LuxR-2306 HE 合成寡霉素D 的能力增强,产量提高了113%(图2(b));Spa AdpA-s 中寡霉素D 产量差异不大(图2(e)),但 AdpA-s HE 寡霉素D 的合成能力却显著增强,产量提高了78%(图2(f)).这说明AdpA-s 和LuxR-2306 可通过正向调控寡霉素D 的生物合成,增强对苹果腐烂菌的抑生活性.另外,与途径特异性调控因子LuxR-2306 相比,全局性调控因子AdpA-s 对寡霉素D 合成的促进作用明显要弱;且AdpA-s的缺失并没能降低寡霉素D 的产量.
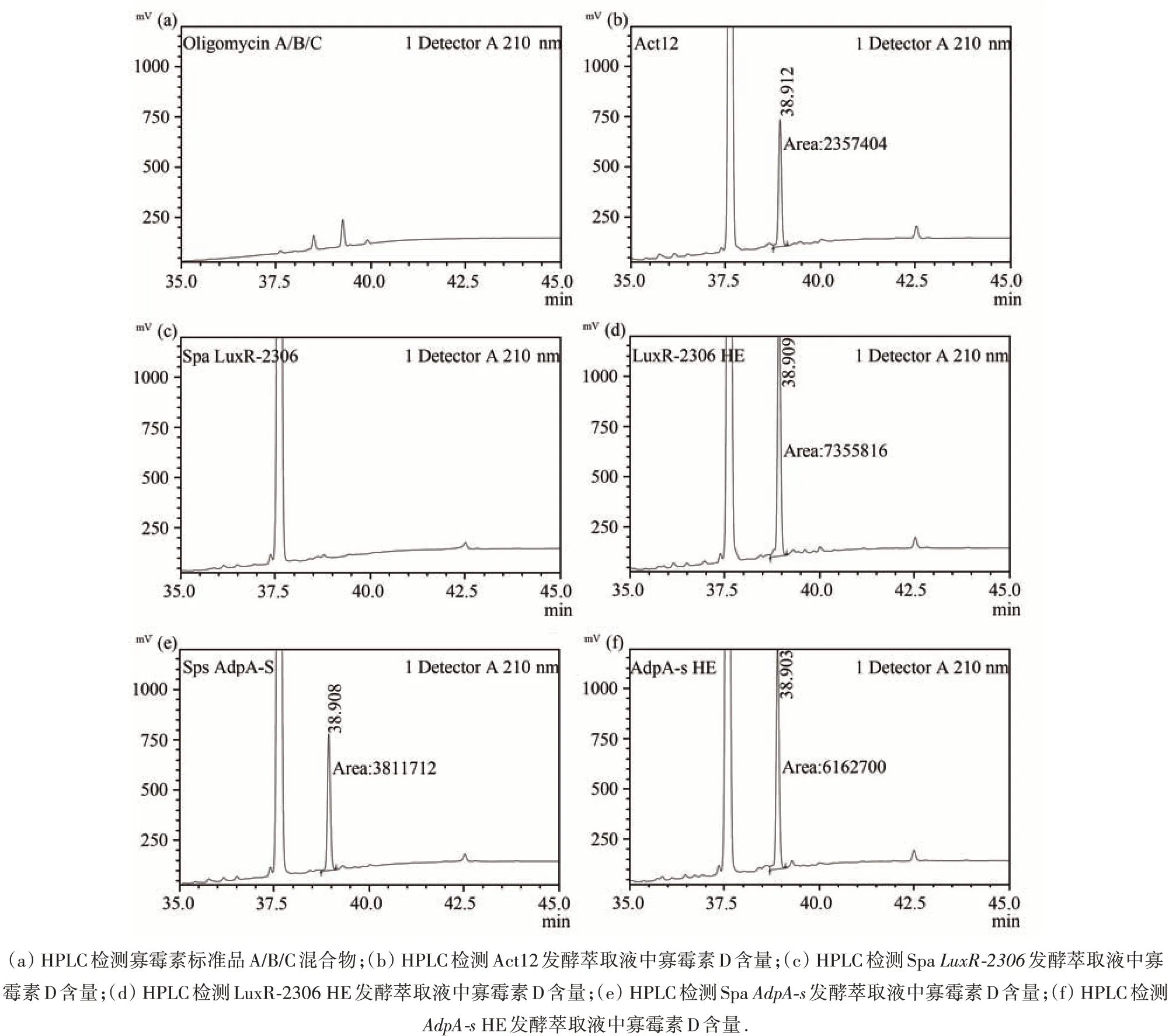
图2 发酵萃取液中寡霉素含量的检测(检测波长210 nm)Fig.2 The oligomycin D test of extrated fermentation(detected at 210 nm)
2.3 AdpA-s 和LuxR-2306 正向调控寡霉素的生物合成
Act12 中 AdpA-s、LuxR-2306 转录水平与寡霉素D生物合成核心酶基因转录水平之间的调控关系,通过实时荧光定量PCR进行检测.结果表明,LuxR-2306敲除后,AdpA-s 转录水平显著下降(图3(b));同时,AdpA-s基因敲除后,LuxR-2306的转录水平也显著下降(图3(c)).这说明AdpA-s和LuxR-2306间可能存在一定的反馈调节作用.在Spa LuxR-2306中,寡霉素生物合成核心酶基因2298/2302/2305的转录水平显著低于野生型 Act12;然而,在 LuxR-2306 HE 中,2298/2302/2305 的转录水平则显著高于野生型(图3(d/e/f)).这说明LuxR-2306可能通过促进寡霉素核心合成酶基因的转录,进而促进寡霉素D的生物合成.

图3 AdpA-s和LuxR-2306正向调控寡霉素D的生物合成Fig.3 AdpA-s and LuxR-2306 positively regulate biosynthesis of oligomycin D
3 讨论
在高氏一号固体培养基中Spa AdpA-s 不能发育形成孢子体,说明AdpA-s 能调控孢子的发育形成(数据未发表).在AdpA-s HE 和LuxR-2306 HE 中寡霉素产量显著增加,表明AdpA-s 和LuxR-2306 能正向调控寡霉素的生物合成.转录分析表明LuxR-2306能显著的影响寡霉素核心合成酶基因的表达,进而促进寡霉素的生物合成.而全局性调控因子AdpA-s和LuxR-2306 之间则存在一定的反馈效应,AdpA-s可能是通过间接影响LuxR-2306 的转录,从而间接地影响了寡霉素的合成.后续实验将对此展开进一步的深入研究与论证.从而为研究生防菌内活性产物的代谢调控提供一定的理论依据,为提高生防菌活性奠定基础.
近年来,许多放线菌被报道具有抗病原真菌活性并作为微生物农药用于农业生产实践.李晓华等从湖北神农架土壤中筛选到一株链霉菌Iβ1,抑菌实验表明该株菌对多种农作物病原真菌具有抑制活性[12].曾夏冬等筛选的水稻内生放线菌OsiLf2、OsiSh-2对稻瘟病菌有较好的抑制效果,且能一定程度促进水稻幼苗的生长,在稻瘟病的生物防治方面有较大的应用潜力[13].密旋链霉菌 Act12 是一株从青藏高原土壤中分离到的放线菌,对草莓、甜瓜等园艺作物有良好的促生作用[14-15];结合腐植酸钾配施能促进丹参生长,提高产量及抗病虫能力[16].目前,Act12 凭其促生功能已作为一种微生物肥料投入农业生产.本研究将全局性调控因子AdpA-s和途径特异性调控因子LuxR-2306 高表达后,寡霉素D的产量显著提高,并且对植物病原真菌-苹果腐烂菌的抑制作用也明显增强.密旋链霉菌Act12 内活性次级代谢生物合成的调控机制的研究,利于对其进一步开发利用,同时有望通过基因工程手段获得高活性生防菌株个体用于农业生产,具有重要的实践意义.

