南美白对虾肝胰腺蛋白提取方法优化及无水保活环境胁迫对细胞凋亡蛋白的影响
郑晓娴 吴嘉鑫 徐德峰 孙力军 王雅玲 秦小明 范秀萍

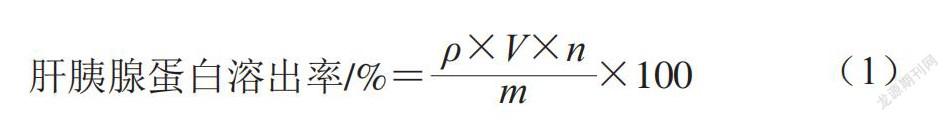

摘 要:为提高Western Blotting结果的可靠性,以蛋白溶出率和凝胶电泳蛋白条带完整性为指标,比较提取液种类、研磨方式、酶抑制剂种类及其体积分数和提取时间对南美白对虾肝胰腺蛋白提取效果的影响。采用优化后的提取方法获得高质量蛋白样品,并采用Western Blotting法分析无水环境胁迫后南美白对虾肝胰腺组织中细胞凋亡信号通路相关蛋白的表达水平。结果表明:RIPA裂解液作为提取溶剂所得的蛋白溶出率高于水提和磷酸盐缓冲液,电动匀浆和液氮研磨所得蛋白条带更完整,4%蛋白酶磷酸酶混合抑制剂能有效抑制肝胰腺内源酶引起的蛋白降解;采用Western Blotting法分析无水保活期间南美白对虾肝胰腺蛋白,发现低温诱导休眠的同时会引起细胞轻微凋亡,且凋亡水平呈应激时间依赖性增加,环境胁迫解除后有所回调。
关键词:南美白对虾;肝胰腺;蛋白提取;保活运输;细胞凋亡
Optimization of Protein Extraction from Hepatopancreas of Litopenaeus vannamei and Effect of Environmental Stress during Waterless Transportation on Apoptosis-Related Proteins
ZHENG Xiaoxian1, WU Jiaxin1, XU Defeng1,2,*, SUN Lijun1, WANG Yaling1, QIN Xiaoming1, FAN Xiuping1
(1.Guangdong Provincial Engineering Technology Research Center of Marine Food, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China;
2.Collaborative Innovation Center of Seafood Deep Processing, Dalian Polytechnic University, Dalian 116034, China)
Abstract: In the present study, in order to improve the reliability of Western blotting results, the effects of extraction buffers, grinding methods, inhibitor type and concentration, and extraction time on protein extraction from the hepatopancreas of Litopenaeus vannamei were explored by considering protein dissolution rate and the completeness of protein bands in electrophoretic gels. Next, the expression levels of apoptosis-related proteins in the hepatopancreas of Litopenaeus vannamei were detected with Western blotting. The results showed that the protein dissolution rate was higher using RIPA lysis buffer compared with phosphate buffer saline (PBS) or water as the extraction solvent. Electric homogenization and liquid nitrogen grinding provided more complete protein bands. The degradation of proteins by endogenous proteases was obviously suppressed by addition of 4% protease and phosphatase inhibitor cocktail. In addition, Western blotting results revealed that in addition to inducing Litopenaeus vannamei into dormancy, low temperatures induced slight apoptosis in the hepatopancreas tissue. Furthermore, the apoptosis level increased with waterless duration and this effect was alleviated after removal of environmental stress.
Keywords: Litopenaeus vannamei; hepatopancreas; protein extraction; live transportation; apoptosis
DOI:10.7506/rlyj1001-8123-20220315-018
中圖分类号:TS254.1 文献标志码:A 文章编号:1001-8123(2022)06-0009-07FE2EA4C7-3244-48AE-9847-AEA3170429DE
引文格式:
郑晓娴, 吴嘉鑫, 徐德峰, 等. 南美白对虾肝胰腺蛋白提取方法优化及无水保活环境胁迫对细胞凋亡蛋白的影响[J].
肉类研究, 2022, 36(6): 9-15. DOI:10.7506/rlyj1001-8123-20220315-018. http://www.rlyj.net.cn
ZHENG Xiaoxian, WU Jiaxin, XU Defeng, et al. Optimization of protein extraction from hepatopancreas of Litopenaeus vannamei and effect of environmental stress during waterless transportation on apoptosis-related proteins[J]. Meat Research, 2022, 36(6): 9-15. DOI:10.7506/rlyj1001-8123-20220315-018. http://www.rlyj.net.cn
南美白对虾是我国沿海地区最受欢迎的水产养殖品种之一,其养殖产量位居我国对虾养殖首位[1]。近年来,随着南美白对虾养殖面积及养殖产量的不断攀升以及消费者对水产品品质要求的提高,人们更青睐于消费鲜活水产品,因而带动了水产品活体运输业的发展[2-3]。
在低温无水保活运输过程中,南美白对虾易受到低温、缺氧、空气暴露及机械振动等环境因素的影響,引起一系列生理应激[4]。当对虾处于应激状态时,机体通过细胞凋亡来清除损伤细胞,而细胞凋亡是一种细胞程序性死亡,分为线粒体介导的内源性凋亡和死亡受体介导的外源性凋亡[5-6]。在机体响应外界环境胁迫时,促凋亡B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族中的Bax蛋白被激活并迁移到线粒体外膜,降低线粒体膜电位,使线粒体膜通透性增加,而细胞色素C被释放到胞质中,促进凋亡小体的形成,进而启动细胞凋亡;同时Caspase家族中的启动者(Caspase-9蛋白)和执行者(Caspase-3蛋白)被连续激活,最终导致细胞凋亡[7]。此外,Caspase-3的活化会进一步水解胞内蛋白,引起细胞骨架分子降解,导致肌肉软化及持水性下降,影响食用口感,对水产品保活运输业造成巨大的经济损失[8-9]。因此,明确细胞凋亡规律及其机制对提升水产动物保活质量具有十分重要的理论和现实意义。
肝胰腺作为甲壳类动物生理代谢的重要器官之一,担负着消化酶的分泌、生理调节、防御及造血等功能,是响应外界环境胁迫的关键器官[10-12],因此可以作为评价保活流通过程细胞凋亡水平的靶组织。此外,蛋白质作为生命活动的功能执行者,在机体应答环境生物或非生物胁迫、调控内稳态平衡、维持个体存活等方面发挥至关重要的作用。杨明等[13]研究低氧胁迫期间日本沼虾鳃、肝胰腺及肌肉组织中抗氧化酶活力变化,发现与其他组织相比,肝胰腺抗氧化酶活力变化更明显。本课题组前期研究证明,无水保活流通过程中南美白对虾应答急冷和无水暴露双重胁迫时肝胰腺氧化与免疫防御、生理代谢调节系统均发生了显著变化,且肝胰腺组织超微结构发生了明显的结构损伤[14-16],提示肝胰腺蛋白特异性变化可作为判断机体早期生理功能变化的辅助指标,而获取高质量肝胰腺蛋白样品是后续蛋白分析的前提。
但对虾肝胰腺组织柔软、水分含量高、富含丝氨酸蛋白酶等内源性蛋白酶[17-21],因此研磨时内源性蛋白酶的溶出会造成蛋白质快速降解。前期实验表明,经典的组织/细胞蛋白提取法在对虾肝胰腺蛋白提取过程中存在提取不充分和提取过程快速降解的典型问题[22-23],而适用于对虾肝胰腺蛋白的高质量提取方法鲜见系统报道。为此,本研究针对肝胰腺蛋白提取过程中可能诱发组织蛋白降解的典型环境和操作因子,以蛋白溶出率和蛋白完整性为评价指标,依次考察提取液种类、研磨方式、抑制剂种类及其体积分数、提取时间对肝胰腺蛋白提取效果的影响,旨在优化南美白对虾肝胰腺蛋白提取方法,为后续在蛋白质水平上解析机体应答环境胁迫的生理调控机制提供高质量蛋白样品。并在此基础上,采用Western Blot方法研究对虾在无水保活流通过程中的凋亡进展规律,为靶向提升对虾存活质量提供理论依据。
1 材料与方法
1.1 材料与试剂
南美白对虾购于广东省湛江市霞山水产品批发市场。将鲜活的南美白对虾充氧保活运回实验室,之后迅速放入1 m3新鲜海水中暂养12 h,水温(23±1) ℃,pH 7.69±0.50,增氧泵连续曝氧,期间不投放饵料。
挑选大小、颜色均一、无机械性损伤且状态良好的对虾进行实验。
磷酸盐缓冲液(phosphate buffered saline,PBS)、RIPA裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、蛋白酶磷酸酶抑制剂混合物、考马斯亮蓝染色液、考马斯亮蓝脱色液、增强型化学发光(enhanced chemiluminescence,ECL)试剂盒 上海碧云天生物技术公司;BCA蛋白定量分析试剂盒、预染蛋白Marker 美国Thermo Scientific公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrohoresis,SDS-PAGE)凝胶配制试剂盒 陕西中晖赫彩生物医药科技有限公司;Bax、Bcl-2、Caspase-3、Caspase-9单克隆抗体 美国Cell Signaling Technology公司。
1.2 仪器与设备
3-30KS高速冷冻离心机 德国Sigma公司;Varioskan Flash全波长酶标仪 美国赛默飞世尔科技有限公司;GelDoc XR+凝胶成像系统、Mini-PROTEAN Tetra垂直电泳系统 美国Bio-Rad公司;塑料周转箱(490 mm×345 mm×285 mm) 东莞市茶山中距塑胶卡板厂。FE2EA4C7-3244-48AE-9847-AEA3170429DE
1.3 方法
1.3.1 南美白对虾肝胰腺蛋白提取流程
参照Luo Zhizhan等[24]方法,选用暂养12 h的南美白对虾进行肝胰腺蛋白提取方法优化,实验流程如图1所示。称取200 mg研磨均匀的对虾肝胰腺组织,加入1 mL含酶抑制剂的提取液后置于冰上提取一段时间,期间多次振荡混匀。取出后于4 ℃、14 000 r/min离心15 min,去除上层悬浮液和下层沉淀,收集澄清液即肝胰腺蛋白提取液,于-20 ℃冰箱中短暂保存。
肝胰腺蛋白提取的主要影响因素为提取液種类(水、RIPA裂解液和PBS)、研磨方式(研钵研磨、电动匀浆机匀浆、液氮研磨)、酶抑制剂种类及其体积分数(PMSF:0.5%、1.0%、2.0%;蛋白酶磷酸酶混合抑制剂:2%、4%、6%)、提取时间(30、60、120、180 min),
以蛋白溶出率和SDS-PAGE蛋白条带完整性为指标,依次考察上述4 个因素对肝胰腺蛋白提取效果的影响,确定南美白对虾肝胰腺蛋白提取的最佳工艺参数。
本研究使用的蛋白酶磷酸酶抑制剂混合物为50×的储备液商品,使用时按照需求分别以体积比1∶50、2∶50、3∶50加入裂解液中,体积分数分别为2%、4%和6%。同样,所使用的PMSF为100×的储备液,按照需求以不同比例加入裂解液中。
1.3.2 南美白对虾肝胰腺蛋白溶出率测定
参照代佳和等[25]的方法,采用BCA法测定不同处理条件下肝胰腺蛋白的溶出量,以牛血清白蛋白(bovine albumin,BSA)为标准蛋白,在562 nm波长处测定吸光度,绘制标准曲线。标准曲线回归方程为y=0.001 3x+0.176 3(R2=0.997),其中y为蛋白质量浓度,x为吸光度。按式(1)计算肝胰腺蛋白溶出率。
(1)
式中:ρ为蛋白质量浓度/(mg/mL);V为待测溶液体积/mL;n为待测体积稀释倍数;m为肝胰腺样品质量/g。
1.3.3 蛋白完整性分析
参照许倩倩等[26]方法,对肝胰腺蛋白进行SDS-PAGE。将上述提取的肝胰腺总蛋白与上样缓冲液混合后于沸水浴中变性5 min,每个泳道蛋白上样量为200 ?g,上样体积20 ?L,80 V电泳30 min后,120 V继续电泳至结束。将凝胶置于考马斯亮蓝染色液中摇床染色2 h,回收考马斯亮蓝染色液,加入脱色液脱色至背景透明后进行凝胶电泳成像。
1.3.4 南美白对虾分组及处理
预先准备3 个塑料周转箱,并连续编号。按照本课题组前期实验方法[27],将暂养12 h后的南美白对虾分为3 组,每组120 条,其中1 组放入含有新鲜海水的1号箱中作为正常对照(normal control,NC)组,其余2 组分别放入含有(12±1) ℃海水的2号和3号箱中低温诱导休眠。观察对虾的活动状态,至侧倒、腹肢无明显摆动、触及反应微弱后捞出,2号箱中对虾为急性冷应激(acute cold,AC)组。3号箱中对虾分装于塑料密封袋中,每袋10 只,共12 袋,排出袋内空气后充氧密封,放入12 ℃层析柜中模拟无水保活运输(waterless duration,WD)。
将保活3、6、9 h,及保活9 h后放入常温海水中复苏(recover,R)2 h的对虾分别记为WD3h、WD6h、WD9h、WD9h+R组。
1.3.5 肝胰腺中细胞凋亡相关蛋白表达测定
采用优化后的蛋白提取方法,分别提取NC组、AC组、WD3h组、WD6h组、WD9h组及WD9h+R组对虾肝胰腺蛋白。按照Luo Zhizhan等[24]的方法,采用Western Blot法检测肝胰腺中细胞凋亡相关蛋白的表达。BCA试剂盒测定各组的蛋白质量浓度后取等量蛋白样品上样,SDS-PAGE分离蛋白组分,湿转法将蛋白转移至硝酸纤维素膜上,7 g/100 mL脱脂牛乳封闭,TBST缓冲液洗膜。然后加入一抗(Bax、Bcl-2、Caspase-9、Caspase-3),4 ℃孵育过夜,并回收对应的一抗;之后加入二抗,室温摇床孵育2 h,ECL显色,最后将目标条带放入发光型凝胶成像系统照相,采用Image J软件进行条带的灰度值分析,以β-actin为内参,定量分析目标蛋白的相对表达水平。各目标蛋白的相对表达量按式(2)计算。
(2)
1.4 数据处理
所有实验设置3 次重复,结果用平均值±标准差表示。采用SPSS 25软件进行差异统计分析,其中P<0.05表示差异显著,P<0.01表示差异极显著。实验结果用GraphPad Prism 8和Power Point软件进行绘图。
2 结果与分析
2.1 南美白对虾肝胰腺蛋白提取方法优化
2.1.1 提取液种类对肝胰腺蛋白提取效果的影响
目前,常用于组织蛋白提取的方法有PBS提取法、三氯乙酸/丙酮沉淀法、裂解液提取法等[28],其中PBS提取法和裂解液提取法在甲壳类动物肝胰腺蛋白的提取中多有报道[29-32]。本实验以水作为对照,采用PBS和RIPA裂解液分别提取对虾肝胰腺中的蛋白。
小写字母不同,表示差异显著(P<0.05)。图3~5同。
由图2可知,RIPA裂解液提取所得的蛋白溶出率最高,为(54.63±0.67)%,而PBS组与对照组(水)之间无统计学差异。不同提取液提取所得的蛋白经电泳染色后结果如图2B所示,与PBS相比,RIPA裂解液提取所得的蛋白条带更清晰,在60~130 kDa处条带更清晰、数量更多。RIPA裂解液更利于组织中蛋白的释放,蛋白总体提取效果优于PBS组。因此确定肝胰腺蛋白最佳提取液为RIPA裂解液。
2.1.2 研磨方式对肝胰腺蛋白提取效果的影响FE2EA4C7-3244-48AE-9847-AEA3170429DE
目前,动物组织研磨破碎的方法主要有超声破碎法、玻璃珠匀浆法、机械研磨法和液氮研磨法等[26],可进一步将其分为匀浆法和研磨法两大类。采用电动匀浆机和液氮研磨提取动物组织蛋白已多有报道[28,33-34]。因此,本研究以研钵研磨为对照,选取较有代表性的电动匀浆机匀浆和液氮研磨2 种方法进行比较实验。
由图3可知,电动匀浆法所得的蛋白溶出率最高,达到(63.82±0.62)%,与液氮研磨的蛋白溶出率有极显著差异,可能是因为电动匀浆机是将肝胰腺组织匀浆成液态,使样品与裂解液充分接触,更利于蛋白的溶出。电动匀浆法和液氮研磨法在40 kDa以上的蛋白完整性明显优于研钵研磨。其中液氮研磨法所得的蛋白在55 kDa和70~100 kDa处的清晰度和条带数量略高于电动匀浆法,可能是因为液氮的超低温将组织迅速冻结,保护蛋白不被破坏或降解,但二者差异并不明显。根据上述结果,确定肝胰腺蛋白最佳研磨方式为电动匀浆机匀浆法。
2.1.3 抑制剂种类及其体积分数对肝胰腺蛋白提取效果的影响
温度的回升会激活对虾肝胰腺中的内源酶,极易造成蛋白质的降解和去修饰,影响后续蛋白的检测[35]。因此,低温环境和添加酶抑制剂是抑制蛋白酶活性的主要措施。PMSF是一种丝氨酸蛋白酶不可逆抑制剂,是组织蛋白提取过程常用的蛋白酶典型抑制剂。蛋白酶磷酸酶混合抑制剂(以下分析简称为混合抑制剂)包含广谱的丝氨酸、半胱氨酸和酸性蛋白酶等抑制剂。
由图4可知,与PMSF组相比,混合抑制剂组的蛋白溶出率和蛋白完整性明显更优,其中以体积分数4%混合抑制剂组的蛋白溶出率最高,可达(62.39±0.76)%,但其蛋白条带与6%混合抑制剂组无差异,同时2%混合抑制剂组在35~60 kDa处的蛋白条带清晰度略差,提示蛋白可能发生降解。因此确定肝胰腺蛋白最佳抑制剂为体积分数4%混合抑制剂。
2.1.4 提取时间对肝胰腺蛋白提取效果的影响
由图5可知,提取时间延长有利于肝胰腺蛋白的溶出。当冰上提取时间达120 min时蛋白溶出率达到最大,继续延长提取时间,蛋白溶出率略有下降但变化不显著。不同提取时间所得的蛋白条带之间无明显差异,且蛋白完整、丰度较高。除此之外,样品的贮藏条件对肝胰腺蛋白的提取也有一定的影响。前期实验分别提取当天和低温放置一段时间后的蛋白样品,发现蛋白样品放置的时间越长,贮藏温度越高,其蛋白降解程度越大,蛋白丰度显著降低,该结果再一次表明对虾肝胰腺组织的独特性。结合前期实验,推测继续延长提取时间可能会降低蛋白溶出率,诱发肝胰腺中蛋白酶激活进而导致蛋白降解。因此,出于对蛋白溶出率和蛋白完整性的综合考虑,确定肝胰腺蛋白最佳提取时间为120 min。同時应尽可能保持全程环境低温,使用新鲜的肝胰腺,且蛋白提取后应尽快完成后续测定。
2.2 低温无水保活期间南美白对虾细胞凋亡信号通路
蛋白表达水平变化
A.免疫印迹图;B~F. Bax、Bcl-2、Bax/Bcl-2、Caspase-9、Caspase-3表达水平;与NC组相比,*. P<0.05,**. P<0.01,***. P<0.001,****. P<0.000 1。
采用Western blotting技术检测线粒体凋亡信号通路中起关键作用的主要蛋白(Bax、Bcl-2、Caspase-3、Caspase-9)。由图6可知,与NC组相比,低温诱导休眠(AC组)使Caspase-3蛋白表达水平显著上调
(P<0.000 1),Bcl-2蛋白的表达水平有所上调但不显著。Bcl-2蛋白是Bcl-2家族中的重要一员,可与促凋亡蛋白(如Bax)结合,抑制细胞凋亡,在抗凋亡过程中起积极作用[36]。AC组Caspase-3和Bcl-2蛋白表达水平的变化说明在单一的低温胁迫过程中,对虾受到冷应激,激活凋亡的关键执行者Caspase-3,并通过上调Bcl-2蛋白的表达抑制凋亡信号通路活化。AC组的凋亡指数(Bax/Bcl-2)并未明显变化,可能是由于低温诱导休眠阶段的时间较短,并不足以彻底激活细胞凋亡信号通路。在WD组中,Bax、Caspase-9、Caspase-3蛋白的表达水平及凋亡指数不断升高,WD6h组达到峰值后有所下降,说明对虾在无水保活期间由于低温及空气暴露等多种胁迫,细胞凋亡信号通路已被完全激活,WD9h组对虾肝胰腺细胞凋亡现象的减弱可能源于机体的抗氧化及免疫防疫系统的充分激活。环境胁迫解除后Bax、Caspase-9、Caspase-3蛋白表达水平及Bax/Bcl-2均恢复到正常水平。与NC组相比,WD9h+R组Bcl-2蛋白的表达水平有所回升但未能恢复至正常水平,可能源于环境胁迫后Bcl-2与Bax之间的结合被解离,Bcl-2被迅速降解,显著降低了Bcl-2蛋白的表达水平。
环境胁迫造成的氧化应激是触发机体细胞凋亡的主要诱因,生物体在应激状态下会积累过量的氧自由基,引起多不饱和脂肪酸等生物大分子发生过氧化,产生丙二醛(malondialdehyde,MDA),其含量通常用来评价机体的氧化损伤程度[37]。黎一鸣等[38]利用TUNEL法分析肝细胞的凋亡情况,发现肝细胞MDA含量与细胞凋亡率呈正相关。细胞凋亡水平除了可以侧面反映生物体的
氧化应激水平,还能反映细胞结构损伤程度。团队前期研究[11-12,15]发现,南美白对虾在受到AC+WD胁迫时,肝胰腺组织中的MDA含量显著升高,在保活3 h达到最高值后随着保活时间的延长有所下降,且肝胰腺组织的病理性损伤程度呈时间依赖性增大,而在AC组中未发现明显异常,在急性冷应激及无水胁迫的交互作用下,对虾的氧化应激及肝胰腺组织病理性损伤程度随保活时间的延长而加剧,该结果与本实验细胞凋亡水平具有相似的变化趋势,提示细胞凋亡与机体应激损伤及组织损伤密切相关。
3 结 论FE2EA4C7-3244-48AE-9847-AEA3170429DE
對南美白对虾肝胰腺蛋白提取方法进行优化后,得到最佳提取条件为RIPA裂解液、电动匀浆机匀浆、4%蛋白酶磷酸酶混合抑制剂、提取60 min,在此条件下提取得到的肝胰腺蛋白溶出率可达(74.83±1.67)%,经SDS-PAGE分离,蛋白条带清晰、完整。蛋白免疫分析进一步表明,肝胰腺中凋亡通路相关蛋白的表达水平在短时间低温胁迫诱导下显著上调,复苏后凋亡减轻,提示细胞凋亡信号通路介导了对虾保活流通过程中环境胁迫诱导的机体伤残或死亡。
参考文献:
[1] 中国水产学会. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020: 26-28.
[2] 董丽君, 孟宪红, 孔杰, 等. 基于转录组分析筛选凡纳滨对虾低温胁迫下的差异表达基因[J]. 中国水产科学, 2019, 26(1): 161-171. DOI:10.3724/SP.J.1118.2019.18061.
[3] 管维良. 南美白对虾无水保活及其生化和肉质的应激响应[D].
杭州: 浙江大学, 2021: 1-7. DOI:10.27461/d.cnki.gzjdx.2021.001224.
[4] KOOLHAAS J M, BARTOLOMUCCI A, BUWALDA B, et al. Stress revisited: a critical evaluation of the stress concept[J]. Neuroscience and Biobehavioral Reviews, 2011, 35(5): 1291-1301. DOI:10.1016/j.neubiorev.2011.02.003.
[5] SAMALI A, FULDA S, GORMAN A M, et al. Cell stress and cell death[J]. International Journal of Cell Biology, 2010, 2010: 245803. DOI:10.1155/2010/245803.
[6] CARNEIRO B A, EL-DEIRY W S. Targeting apoptosis in cancer therapy[J]. Nature Reviews Clinical Oncology, 2020, 17: 395-417. DOI:10.1038/s41571-020-0341-y.
[7] ZHANG Han, HUANG He, ZHENG Peng, et al. The alleviative effect of thyroid hormone on cold stress-induced apoptosis via HSP70 and mitochondrial apoptosis signal pathway in bovine Sertoli cells[J]. Cryobiology, 2022, 105: 63-70. DOI:10.1016/j.cryobiol.2021.11.181.
[8] JANEWANTHANAKUL S, SUPUNGUL P, TANG S, et al. Heat shock protein 70 from Litopenaeus vannamei (Lv HSP70) is involved in the innate immune response against white spot syndrome virus (WSSV) infection[J]. Developmental and Comparative Immunology, 2020, 102: 103476. DOI:10.1016/j.dci.2019.103476.
[9] LANA A, ZOLLA L. Apoptosis or autophagy, that is the question: two ways for muscle sacrifice towards meat[J]. Trends in Food Science and Technology, 2015, 46(2): 231-241. DOI:10.1016/j.tifs.2015.10.001.
[10] MENG Xianliang, JAYASUNDARA N, Zhang Jingyan, et al. Integrated physiological, transcriptome and metabolome analyses of the hepatopancreas of the female swimming crab Portunus trituberculatus under ammonia exposure[J]. Ecotoxicology and Environmental Safety, 2021, 228: 113026. DOI:10.1016/j.ecoenv.2021.113026.
[11] XU Defeng, WU Jiaxin, SUN Lijun, et al. Combined stress of acute cold exposure and waterless duration at low temperature induces mortality of shrimp Litopenaeus vannamei through injuring antioxidative and immunological response in hepatopancreas tissue[J]. Journal of Thermal Biology, 2021, 100: 103080. DOI:10.1016/j.jtherbio.2021.103080.FE2EA4C7-3244-48AE-9847-AEA3170429DE
[12] XU Defeng, WU Jiaxin, SUN Lijun, et al. Energy metabolism response of Litopenaeus vannamei to combined stress of acute cold exposure and waterless duration: implications for physiological regulation and waterless live transport[J]. Journal of Thermal Biology, 2022, 104: 103149. DOI:10.1016/j.jtherbio.2021.103149.
[13] 楊明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响[J]. 中国水产科学, 2019, 26(3): 493-503. DOI:10.3724/SP.J.1118.2019.18285.
[14] HAN Siyin, WANG Mengqiang, LIU Mei, et al. Comparative sensitivity of the hepatopancreas and midgut in the white shrimp Litopenaeus vannamei to oxidative stress under cyclic serious/medium hypoxia[J]. Aquaculture, 2018, 490(1): 44-52. DOI:10.1016/j.aquaculture.2018.02.021.
[15] XU Defeng, WU Jiaxin, SUN Lijun, et al. Antioxidative and immunological response of shrimp Litopenaeus vannamei to combined stress of acute cold exposure and waterless duration: implications for live transport[J]. Aquaculture Research, 2022, 53(3): 1026-1039. DOI:10.1111/are.15644.
[16] 徐德峰, 吴嘉鑫, 孙力军, 等. 急冷与空气暴露联合胁迫对凡纳滨对虾生理代谢影响[J]. 广东海洋大学学报, 2022, 42(1): 1-10. DOI:10.3969/j.issn.1673-9159.2022.01.004.
[17] SENPHAN T, BENJAKUL S. Use of the combined phase partitioning systems for recovery of proteases from hepatopancreas of Pacific white shrimp[J]. Separation and Purification Technology, 2014, 129: 57-63. DOI:10.1016/j.seppur.2014.03.025.
[18] SENPHAN T, BENJAKUL S. Compositions and yield of lipids extracted from hepatopancreas of Pacific white shrimp (Litopenaeus vannamei) as affected by prior autolysis[J]. Food Chemistry, 2012, 134(2): 829-835. DOI:10.1016/j.foodchem.2012.02.188.
[19] SRIKET C, BENJAKUL S, VISESSANGUAN W. Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn (Macrobrachium rosenbergii)[J]. Journal of the Science of Food and Agriculture, 2011, 91(1): 52-59. DOI:10.1002/jsfa.4145.
[20] MEUNPOL O, HALL M R, KAPOOR V. Partial characterization and distribution of kynurenine aminotransferase activity in the Black Tiger prawn (Penaeus monodon)[J]. Comparative Biochemistry and Physiology B, 1998, 120(1): 139-143. DOI:10.1016/s0305-0491(98)10002-0.
[21] ZHAN Wenbin, WANG Xiaojie, CHEN Jing, et al. Elimination of shrimp endogenous alkaline phosphatase background and development of enzyme immunoassays for the detection of white spot syndrome virus (WSSV)[J]. Aquaculture, 2004, 239(1): 15-21. DOI:10.1016/j.aquaculture.2004.05.042.FE2EA4C7-3244-48AE-9847-AEA3170429DE
[22] 吴嘉敏, 姜新耀. 中华绒螯蟹血淋巴和肝胰腺的总蛋白含量与性早熟的关系[J]. 水产学报, 2000, 24(4): 306-307. DOI:10.3321/j.issn:1000-0615.2000.04.003.
[23] 孟永海, 王欣慰, 史连宏, 等. 三种大鼠肌肉组织蛋白提取方法的比较研究[J]. 哈尔滨商业大学学报(自然科学版), 2015, 31(6): 661-670. DOI:10.19492/j.cnki.1672-0946.2015.06.006.
[24] LUO Zhizhan, HUANG Wen, WANG Guoxia, et al. Identification and characterization of p38 MAPK in response to acute cold stress in the gill of Pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture Reports, 2020, 17: 100365. DOI:10.1016/j.aqrep.2020.100365.
[25] 代佳和, 罗旋飞, 史崇颖, 等. 响应面法优化辣木叶中水溶性蛋白提取工艺研究[J]. 云南农业大学学报(自然科学), 2020, 35(1): 130-138. DOI:10.12101/j.issn.1004-390X(n).201805050.
[26] 许倩倩, 滕夏虹, 郝彦利, 等. 不同提取方法对小鼠海马AD相关蛋白电泳的影响[J]. 神经解剖学杂志, 2018, 34(4): 491-496. DOI:10.16557/j.cnki.1000-7547.2018.04.013.
[27] 徐德峰, 王雅玲, 孙力军, 等. 降温及生态冰温条件对凡纳滨对虾无水存活时间的影响[J]. 广东海洋大学学报, 2019, 39(6): 101-107. DOI:10.3969/j.issn.1673-9159.2019.06.013.
[28] 朱黎娜, 侯丽英, 张盈莹, 等. 不同方法提取和处理中华绒螯蟹组织蛋白的过敏原组分分析[J]. 中国免疫学杂志, 2014, 30(12): 1652-1657. DOI:10.3969/j.issn.1000-484X.2014.12.014.
[29] 秦兆宇, 刘师莲, 宋春华, 等. 中国对虾肝胰腺蛋白质组学双向电泳技术体系的建立[J]. 生物医学工程研究, 2007, 26(1): 80-83. DOI:10.3969/j.issn.1672-6278.2007.01.020.
[30] 章跃陵, 卓奕明, 朱永飞, 等. 南美白对虾人工感染细菌后肝胰脏中主要变化蛋白的研究[J]. 水产科学, 2005, 24(6): 19-23. DOI:10.3969/j.issn.1003-1111.2005.06.007.
[31] FAN Lanfen, WANG Anli, MAO Yuntao, et al. Comparative proteomic identification of the hepatopancreas response to cold stress in white shrimp, Litopenaeus vannamei[J]. Aquaculture, 2015, 454: 27-34. DOI:10.1016/j.aquaculture.2015.10.016.
[32] 徐洲, 母昌考, 李荣华, 等. 交配与未交配三疣梭子蟹肝胰腺蛋白质组学的初步分析[J]. 宁波大学学报(理工版), 2013, 26(4): 1-6.
[33] 赵永强, 李娜, 李来好, 等. 尼罗罗非鱼肌肉蛋白质双向电泳体系的建立[J]. 水产学报, 2016, 40(10): 1648-1656. DOI:10.11964/jfc.20151010109.
[34] 朱佳杰, 沈夏霜, 付强, 等. 吉富罗非鱼肝脏蛋白质组双向电泳技术的建立与优化[J]. 西南农业学报, 2013, 26(5): 2122-2126. DOI:10.16213/j.cnki.scjas.2013.05.085.
[35] 银凤, 周愛梅, 张祥刚, 等. 南美白对虾虾头主要自溶酶的分离纯化及鉴定[J]. 食品与发酵工业, 2011, 37(3): 23-26. DOI:10.13995/j.cnki.11-1802/ts.2011.03.004.
[36] SINGH R, LETAI A, SAROSIEK K, et al. Regulation of apoptosis in health and disease: the balancing act of Bcl-2 family proteins[J]. Nature Reviews: Molecular Cell Biology, 2019, 20(3): 175-193. DOI:10.1038/s41580-018-0089-8.
[37] 张玉晗, 谢晶. 低温休眠预处理对花鲈无水保活效果的影响[J]. 食品科学, 2018, 39(23): 221-226. DOI:10.7506/spkx1002-6630-201823033.
[38] 黎一鸣, 徐心, 吉鸿, 等. 肝动脉缺血对肝细胞凋亡的影响及其机制初探[J]. 西安交通大学学报(医学版), 2002, 23(4): 393-394. DOI:10.3969/j.issn.1671-8259.2002.04.021.
收稿日期:2022-03-15
基金项目:“十三五”国家重点研发计划重点专项(2019YFD0901601);国家自然科学基金面上项目(31772048);
广东省现代农业产业技术创新团队项目(2021KJ149);广东海洋大学研究生教育创新计划资助项目(202261)
第一作者简介:郑晓娴(1997—)(ORCID: 0000-0003-4748-8691),女,硕士研究生,研究方向为对虾保活流通应激损伤
机制与调控。E-mail: zhengxiaoxianzzz@163.com
*通信作者简介:徐德峰(1978—)(ORCID: 0000-0003-1218-5359),男,教授,博士,研究方向为水产品保鲜保活酶学
机制与海洋资源高值化利用。E-mail: 13827198525@163.comFE2EA4C7-3244-48AE-9847-AEA3170429DE

