和厚朴酚对糖尿病大鼠胰岛素抵抗的影响及其机制
焦红军,彭旭阳,彭秀丽
郑州大学第二附属医院药学部,郑州 450000
糖尿病(diabetes mellitus,DM)伴发多种并发症,例如糖尿病心肌病、糖尿病肾病和糖尿病足等,严重降低患者的生活质量[1]。和厚朴酚(honokiol,HKL)是传统中药厚朴的主要活性成分之一,具有抗炎、抗氧化应激及抗肿瘤等多种药理作用[2-4]。研究显示,HKL可改善胰岛β细胞功能障碍、促进胰岛素分泌、增强机体对胰岛素的敏感性,从而降低DM 大鼠的血糖水平。此外,HKL 可改善2型DM 小鼠胰岛素抵抗、肝脏脂肪变性以及炎症反应,从而达到预防DM 的效果[5-6]。过氧化物酶增殖物激活受体γ(peroxisome proliferators-activated receptorsγ,PPARγ)是一种核转录因子,在多种基因的表达中发挥调控作用,研究表明,miR-27a靶向作用于PPARγ可改善胰岛素抵抗、降低血糖[7]。本研究建立DM大鼠模型,灌胃给予HKL,探讨HKL对DM 大鼠的影响以及对PPARγ的调控作用。
1 仪器和材料
1.1 仪器
酶标仪(美国Thermo公司);电泳仪(北京六一生物科技有限公司)。
1.2 试药
HKL(质量分数>98%,南京景竹生物科技有限公司);链脲佐菌素(streptozocin,STZ)、PPARγ抑制剂GW9662均购自美国Sigma公司;血糖仪和血糖试纸(瑞士罗氏公司);空腹血清胰岛素(fasting serum insulin,FINS)试剂盒(南京建成生物工程研究所);PPARγPCR 特异性引物(广州锐博生物有限公司);兔抗大鼠腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)、p-AMPK、PPARγ抗体均购自美国Abcam 公司。
1.3 动物
健康清洁级SD 雄性大鼠70只,8周龄,体质量为200~220 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2018-0001。
2 方法
2.1 分组与给药
70只SD 大鼠用普通饲料适应性喂养3 d后,其中55只换用高脂高糖饲料喂养作为DM 组,其余15只用普通饲料喂养作为正常组。6周后,DM 组大鼠禁食不禁水12 h,一次性腹腔注射STZ 溶液35 mg·kg-1(STZ粉末溶于0.1 mol·L-1柠檬酸钠缓冲液,p H4.5,现用现配,避光使用),2 h后恢复高脂高糖饮食;正常组15只大鼠腹腔注射柠檬酸钠缓冲液,2 h后用普通饲料喂养。7 d后,DM 组大鼠禁食不禁水12 h,尾静脉采血,用血糖仪测定空腹血糖(fasting blood glucose,FBG)水平,FBG≥11.1 mmol·L-1视为DM 模型构建成功。其中53只大鼠建模成功,随机选取5只正常大鼠和5只DM 大鼠检测脂肪组织中PPARγm RNA 的相对表达量。
将剩余的48只DM 大鼠随机分为模型组、和厚朴酚组、抑制剂组、和厚朴酚+抑制剂组,每组12只。和厚朴酚组大鼠用HKL 50 mg·kg-1灌胃,抑制剂组大鼠用GW9662 1 mg·kg-1灌胃,和厚朴酚+抑制剂组大鼠用HKL 50 mg·kg-1灌胃,2 h 后用GW9662 1 mg·kg-1灌胃,每日1次,连续处理3周,模型组大鼠用等量生理盐水灌胃,末次给药结束后,所有大鼠禁食不禁水12 h,尾静脉采血,用血糖仪测定FBG,并称质量。
2.2 ELISA 检测血清FINS
称质量后,用戊巴比妥钠麻醉,打开胸腔,主动脉采血,室温静置2 h 后,以3 000 r·min-1离 心10 min,离心半径为8 cm,收集上清液。根据ELISA试剂盒说明书进行对照品稀释,酶标板设置空白孔、标准孔和待测样品孔,标准孔中加入稀释后的对照品50μL,待测样品孔加入样品稀释液40μL,再加入待测样品10μL,37℃孵育30 min,洗涤5次,加入链霉亲和素(除空白孔)50μL,再加入四甲基联苯胺50μL,37℃反应10 min 后,置于酶标仪中,测定450 nm处的A 值,计算胰岛素敏感指数(insulin sensitivity index,ISI)和胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMAIR)。ISI=Ln[1/(FBG×FINS)]。HOMA-IR=[(FBG×FINS)]/22.5。
2.3 检测PPARγ mRNA 的相对表达量
打开腹腔,取腹膜后脂肪组织,置于液氮中研磨,按照Trizol试剂盒说明书提取总RNA,用反转录试剂盒将RNA 逆转录成cDNA,以c DNA 为模板,以GAPDH 为内参,进行PCR 反应。反应条件:95℃预变性5 min、95℃15 s、60℃40 s,共40个循环,72℃延伸10 min。采用2-CT表示PPARγmRNA 的相对表达量,所有操作均独立重复3次。引物序列见表1。

表1 qRT-PCR 引物序列Tab.1 Primer sequence of qRT-PCR
2.4 检测PPARγ和p-AMPK 蛋白的相对表达量
打开腹腔,取腹膜后脂肪组织,置于液氮中研磨。加入RIPA 裂解液冰上静置30 min,以12 000 r·min-1离心10 min,离心半径为10 cm,收集上清液,按照BCA 试剂盒说明书测定蛋白浓度,加入蛋白上样缓冲液,100℃煮沸10 min使蛋白变性。SDS凝胶电泳,每孔加入蛋白样品20μL,120 V 恒压电泳2 h,0.3 A 恒流湿转2 h,根据相对分子质量裁取目的蛋白条带,用TBST 洗膜3次,每次5 min,室温封闭1 h,PPARγ、p-AMPK、GAPDH 一抗(1∶1 000)4℃孵育过夜,用TBST 洗膜3次,每次5 min,二抗(1∶5 000)室温孵育1 h,用TBST 洗膜3 次,每次5 min,用ECL 法显色。用Image J软件分析蛋白条带灰度值,目的蛋白条带灰度值与GAPDH 蛋白条带灰度值的比值为目的蛋白的相对表达量。
2.5 统计学方法
3 结果
3.1 q RT-PCR 检测结果
正常组大鼠脂肪组织中PPARγm RNA 的相对表达量(6.43±0.52)高于DM 组大鼠(2.17±0.48)(P<0.05)。
3.2 PPARγ m RNA 的相对表达量
PPARγmRNA 相对表达量组间比较,差异有统计学 意 义(P<0.05)。与 正 常 组 比 较,模 型 组PPARγmRNA 的相对表达量降低(P<0.05);与模型组比较,和厚朴酚组PPARγm RNA 的相对表达量升高,抑制剂组PPARγmRNA 的相对表达量降低(P<0.05);与和厚朴酚组比较,和厚朴酚+抑制剂组PPARγmRNA 的相对表达量降低(P<0.05);与抑制剂组比较,和厚朴酚+抑制剂组PPARγm RNA的相对表达量升高(P<0.05)。结果见表2。
表2 大鼠脂肪组织中PPARγmRNA相对表达量的比较(±s)Tab.2 Comparison of relative expression levels of PPARγ m RNA in adipose tissue of rats in each group(±s)

表2 大鼠脂肪组织中PPARγmRNA相对表达量的比较(±s)Tab.2 Comparison of relative expression levels of PPARγ m RNA in adipose tissue of rats in each group(±s)
注:与正常组比较,a P<0.05;与模型组比较,b P<0.05;与和厚朴酚组比较,c P<0.05;与抑制剂组比较,d P<0.05。
项目 n PPAR γ正常组10 8.26±0.35模型组 12 3.40±0.33a和厚朴酚组 12 5.74±0.38ab抑制剂组 12 2.04±0.22abc和厚朴酚+抑制剂组 12 4.52±0.29abcd F 607.808 P<0.001
3.3 FBG 和体质量测定结果
FBG、体质量组间比较,差异有统计学意义(P<0.05)。与正常组比较,模型组FBG 升高、体质量减轻(P<0.05);与模型组比较,和厚朴酚组FBG 降低、体质量增加,抑制剂组FBG 升高、体质量减轻(P<0.05);与和厚朴酚组比较,和厚朴酚+抑制剂FBG 升高、体质量减轻(P<0.05);与抑制剂组比较,和厚朴酚+抑制剂组FBG 降低、体质量增加(P<0.05)。结果见表3。
表3 大鼠FBG、体质量比较(±s)Tab.3 Comparison of FBG and body weight of rats in each group(±s)

表3 大鼠FBG、体质量比较(±s)Tab.3 Comparison of FBG and body weight of rats in each group(±s)
注:与正常组比较,a P<0.05;与模型组比较,b P<0.05;与和厚朴酚组比较,c P<0.05;与抑制剂组比较,d P<0.05。
项目 n FBG/(mmol·L-1) 体质量/g正常组10 6.14±0.53 325.80±11.42模型组 12 18.76±0.82a 201.73±8.24a和厚朴酚组 12 14.25±0.55ab 262.05±8.88ab抑制剂组 12 22.73±0.78abc 185.29±10.53abc和厚朴酚+抑制剂组12 16.44±0.78abcd 247.90±10.62abcd F 818.869 337.073 P<0.001 <0.001
3.4 FINS、ISI和HOMA-IR 检测结果
FINS、ISI和HOMA-IR 组间比较,差异有统计学意义(P<0.05)。与正常组比较,模型组ISI降低,FINS和HOMA-IR 升高(P<0.05);与模型组比较,和厚朴酚组ISI升高,FINS和HOMA-IR 降低,抑制剂组ISI降低,FINS和HOMA-IR 升高(P<0.05);与和厚朴酚组比较,和厚朴酚+抑制剂ISI降低,FINS和HOMA-IR 升高(P<0.05);与抑制剂组比较,和厚朴酚+抑制剂组ISI升高,FINS和HOMAIR 降低(P<0.05)。结果见表4。
表4 大鼠FINS、ISI和HOMA-IR 比较(±s)Tab.4 Comparison of FINS,ISI and HOMA-IR of rats in each group(±s)

表4 大鼠FINS、ISI和HOMA-IR 比较(±s)Tab.4 Comparison of FINS,ISI and HOMA-IR of rats in each group(±s)
注:与正常组比较,a P<0.05;与模型组比较,b P<0.05;与和厚朴酚组比较,c P<0.05;与抑制剂组比较,d P<0.05。
项目 n FINS/(m U·L-1)ISI HOMA-IR正常组10 8.53±0.64 7.92±0.25 7.57±0.82模型组 12 19.42±0.76a 5.30±0.22a 18.44±0.79a和厚朴酚组 12 13.05±0.73ab 6.43±0.20ab 12.07±0.84ab抑制剂组 12 21.73±0.68abc 4.24±0.17abc 23.94±1.25abc和厚朴酚+抑制剂组 12 15.90±0.51abcd 5.78±0.32abcd 15.82±1.06abcd F 664.946 363.209 454.527 P<0.001 <0.001 <0.001
3.5 脂肪组织中各蛋白的相对表达量
PPARγ和p-AMPK 蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与正常组比较,模型组PPARγ和p-AMPK 蛋白的相对表达量降低(P<0.05);与模型组比较,和厚朴酚组PPARγ和p-AMPK 蛋白的相对表达量升高,抑制剂组PPARγ和p-AMPK 蛋白的相对表达量降低(P<0.05);与和厚朴酚组比较,和厚朴酚+抑制剂PPARγ和p-AMPK蛋白的相对表达量降低(P<0.05);与抑制剂组比较,和厚朴酚+抑制剂组PPARγ和p-AMPK 蛋白的相对表达量升高(P<0.05)。结果见表5、图1。
表5 大鼠脂肪组织中PPARγ、p-AMPK 蛋白相对表达量比较(±s)Tab.5 Comparison of relative expression levels of PPARγand p-AMPK protein in adipose tissue of rats in each group(±s)
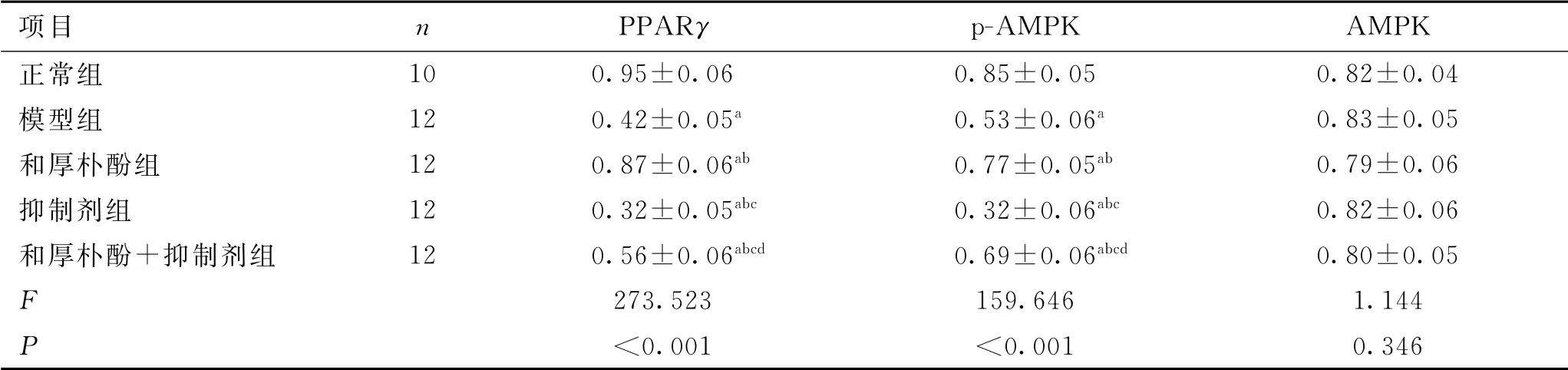
表5 大鼠脂肪组织中PPARγ、p-AMPK 蛋白相对表达量比较(±s)Tab.5 Comparison of relative expression levels of PPARγand p-AMPK protein in adipose tissue of rats in each group(±s)
注:与正常组比较,a P<0.05;与模型组比较,b P<0.05;与和厚朴酚组比较,c P<0.05;与抑制剂组比较,d P<0.05。
项目 n PPARγ p -AMPK AMPK正常组10 0.95±0.06 0.85±0.05 0.82±0.04模型组 12 0.42±0.05a 0.53±0.06a 0.83±0.05和厚朴酚组 12 0.87±0.06ab 0.77±0.05ab 0.79±0.06抑制剂组 12 0.32±0.05abc 0.32±0.06abc 0.82±0.06和厚朴酚+抑制剂组 12 0.56±0.06abcd 0.69±0.06abcd 0.80±0.05 F 273.523 159.646 1.144 P<0.001 <0.001 0.346
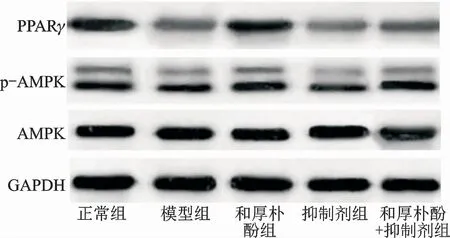
图1 Western blot 检 测 脂 肪 组 织 中PPARγ、p-AMPK 和AMPK 蛋白的表达Fig.1 Expressions of PPARγ,p-AMPK and AMPK proteins by Western blot
4 讨论
HKL是一种天然酚类化合物,具有低毒、高效的特点。研究发现,HKL对多种疾病具有治疗作用,例如保护肾脏免受缺血再灌注损伤、改善由血管紧张素Ⅱ诱导的高血压和内皮功能障碍及逆转上皮间质转化过程从而抑制乳腺癌细胞的迁移和侵袭[8-10]。另有研究发现,HKL 在DM 中同样发挥重要作用,它可以通过改善线粒体脂肪酸代谢,对DM 小鼠线粒体功能障碍发挥抑制作用,还可以改善2型DM 小鼠糖脂代谢[11-12]。PPARs是一类依赖于配体活化的核转录 因 子,该家族 成 员 包 括PPARγ、PPARα和PPARβ。PPARγ在人体多种组织器官中均有表达,PPARγ不仅可以调节脂肪酸氧化,还可以促进骨骼肌表面葡萄糖转运体4的表达,从而改善DM 患者糖脂代谢紊乱。最近一项研究表明,从DM 小鼠分离出的脂肪细胞中PPARγ的表达水平降低,而且胰岛素敏感性降低[13],黄芪多糖激活脂肪细胞中PPARγ的表达,减轻由TNF-α诱导的胰岛素抵抗[14],山柰素和葫芦巴碱激活PPARγ改善DM 大鼠糖脂代谢异常,同时减轻胰岛素抵抗[15-16]。本研究通过高脂高糖加小剂量STZ诱导建立2型DM 大鼠模型,灌胃给予HKL 和PPARγ抑制剂,探讨HKL 对DM 大鼠血糖以及胰岛素抵抗的作用。实验结果显示,DM大鼠FBG 升 高、体质量 减 轻,ISI 显 著 降低,而HOMA-IR 明 显 升 高,DM 大 鼠 用HKL 灌 胃 后FBG、HOMA-IR 降低、体质量增加、ISI升高;而用PPARγ抑制剂灌胃后FBG 和HOMA-IR 进一步升高,体质量和ISI进一步降低;DM 大鼠同时用HKL和PPARγ抑制剂灌胃与仅用PPARγ抑制剂灌胃比较,FBG 降低、体质量增加、ISI升高以及HOMA-IR降低。该实验结果提示,HKL 可降低DM 大鼠血糖水平,增强其对胰岛素的敏感性。
AMPK 是维持机体能量平衡的重要调节因子,参与调控多条代谢通路,例如脂肪酸氧化、糖酵解以及糖异生[17],此外,水飞蓟宾通过激活AMPK 可抑制由自由脂肪酸诱导的肝细胞炎症因子的分泌[18]。研究发现,PPARγ激活可使AMPK 发生磷酸化,通过增强机体抗氧化作用从而改善强直性脊柱炎患者的临床症状[19]。脂混合物诱导的人源肝细胞LO2中PPARγ和AMPK 活性降低,而厄贝沙坦通过激活PPARγ可降低脂质沉积以及三酰甘油和总胆固醇含量,对减轻肥胖糖尿病小鼠肝损伤具有重要意义[20]。本实验通过灌胃给予DM 大鼠PPARγ抑制剂和HKL,探讨HKL降低DM 大鼠血糖、增强胰岛素敏感性是否通过激活PPARγ和AMPK 发挥调控作用。用蛋白印迹法检测PPARγ和p-AMPK 的蛋白表达,结果显示,DM 大鼠PPARγ和p-AMPK 蛋白的表达水平降低,HKL 上调PPARγ和p-AMPK蛋白的表达水平。该实验结果提示,HKL 激活PPARγ/AMPK 信号通路。
综上所述,HKL 降低DM 大鼠血糖水平、减轻胰岛素抵抗,其可能是通过激活PPARγ/AMPK 信号通路发挥作用,为临床治疗DM 提供理论依据。

