秋水仙素诱导“法新”蓝莓多倍体初探
崇慧影 安常蓉 王代波 文光琴 赵亮清


摘 要 为建立秋水仙素诱导蓝莓多倍体的方法,以“法新”蓝莓组培苗为试验材料,用浓度为0.1%、0.2%、0.4%的秋水仙素溶液分别浸泡蓝莓组培苗茎段10 h、18 h、26 h,培养45 d后观察和测定无菌蓝莓组培苗生长状况及相关生理指标。结果初步表明:在同一处理时间条件下,蓝莓组培苗成活率随着秋水仙素浓度的增加而降低;在同一处理浓度条件下,蓝莓组培苗成活率随秋水仙素处理时间的增加而降低。与对照相比,变异植株出现茎段增粗、叶面积变大和叶片颜色加深等特征。结合隶属函数对其综合分析表明,秋水仙素浓度为0.2%处理10 h是最适合“法新”蓝莓组培苗多倍体的诱导条件。
关键词 蓝莓;秋水仙素;诱导多倍体;隶属函数
中图分类号:S663.9 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2022.11.017
蓝莓(Vaccinium uliginosum)为杜鹃花科越橘属植物,又名蓝浆果,是一种多年生灌木,其果实富含多种维生素、微量元素及花色素苷、类黄酮等生理活性成分,这些化合物对人体有多种益处,如清除体内多余自由基、提高免疫力、抵抗身体和皮肤的氧化衰老等[1]。蓝莓作为果中珍品,因保健及药用价值较高,已被联合国粮食及农业组织列为人类五大健康食品之一[2]。目前,我国具有较丰富的野生蓝莓资源,但野生品种产量低且品质差,而多倍体蓝莓不仅枝繁叶茂、抗性强,而且果实品质好、果大、产量高,为选育优质新品种提供了重要途径,对开发利用及保存我国蓝莓种质资源具有重大意义[3]。
与普通的二倍体植物相比,多倍体植物在遗传可塑性及生理适应性等方面具有更强的优势,因此越来越多的植物学家热衷于探究多倍体的选育工作。随着生物技术的高速发展及科学研究的不断深入,植物多倍体诱导也愈发得到广泛的应用及发展[4]。诱导多倍体通常采用3种方法,即生物学方法、物理方法及化学方法,最常用的方法是采用化学诱变剂进行诱导,这也是当前最有效、最经济的方式[5]。在多倍体诱导过程中,通常选取植物体内生长最活跃、最旺盛的组织器官进行诱导,如植株的愈伤组织、萌动或刚出芽的种子幼苗、幼嫩枝条的生长点等,采用吲哚乙酸、秋水仙素等化学诱变剂对其进行处理,均可诱导形成多倍体,该方法最大的优势就是具有高度专一性[6]。在所有的诱变剂中,秋水仙素处理诱变效果最佳。用秋水仙素处理细胞后,由于纺锤丝不能形成而停留在有丝分裂中期阶段,每一个染色体形成的一对染色单体分离,但由于缺少纺锤丝的牵引而不能向两极移动,无法形成两个单独的子细胞,最终导致染色体加倍[7]。有学者使用秋水仙素对苹果组培苗幼叶片进行誘导,同时增添了浓度为2%的二甲基亚砜,结果发现,使用浓度为0.5%的秋水仙素对其处理4 d后,有56.1%的植株被诱导成多倍体[8]。利用组织培养技术与秋水仙素诱导多倍体相结合的技术选育新品种,比常规杂交育种周期短,不受季节变化的影响,能较快繁育出蓝莓多倍体新品种,不仅提高了蓝莓果实品质,还推动了蓝莓工厂化育苗。
因此,本试验以“法新”蓝莓组培苗为研究对象,通过观察植株的生长特征及测定植株的各项生理指标,探究不同浓度秋水仙素和不同浸泡时间对蓝莓组培苗的影响,以期筛选出蓝莓多倍体诱导的最佳处理浓度和时间。
1 材料与方法
1.1 试验材料
试验材料为“法新”蓝莓组培苗。
1.2 试验方法
1.2.1 多倍体诱导
选取生长健壮的蓝莓无菌组培苗,剪取长度约1 cm的茎段。选取生长一致的茎段浸泡在3种不同浓度(0.1%、0.2%、0.4%)的秋水仙素溶液中,浸泡时间分别为10 h、18 h、26 h,共9个处理,每个处理30个茎段;将秋水仙素浸泡过的茎段置于摇床(120 r·min-1)振荡,处理温度为(26±1) ℃;将处理好的茎段接种于改良的WPM培养基上,每个处理接种6瓶,每瓶接种5个茎段。同时在改良的WPM培养基上接种未经秋水仙素处理的茎段作为对照。
培养条件:改良WPM培养基的pH值为5.6,培养室相对湿度为(75±5)%,温度为(25±1) ℃,光照周期为12 h·d-1,光照强度为1 800~2 500 lx,各处理因素水平组合列于表1。
1.2.2 测量指标及方法
1)生长指标。继代培养45 d后,根据形态观察法确定成活植株和变异植株,统计不同处理的成活数和变异数,计算成活率和变异率,计算公式为[9]:
成活率=成活株数/总处理株数×100%
变异率=变异株数/总处理株数×100%
2)形态指标。对蓝莓植株的株高、叶长、叶宽、叶片数、茎粗、鲜质量和增殖数进行测定,数据以[x±s]表示。
3)综合性评价。采用SPSS软件计算半致死时间(LT50),采用隶属函数法对其综合性评价[9-10]。
2 结果与分析
2.1 秋水仙素对蓝莓组培苗生长指标的影响
2.1.1 成活率
由表2可知,蓝莓组培苗的成活率受到秋水仙素浓度和处理时间的双重影响。对照组蓝莓组培苗成活率最高,达100%;秋水仙素浓度一致时,各处理间成活率大小排序为A1>A2>A3,B1>B2>B3,C1>C2>C3,表明蓝莓组培苗的成活率随着秋水仙素处理时间的增加而减小;秋水仙素作用时间相同时,成活率大小排序为A1>B1>C1,A2>B2>C2,A3>B3>C3,表明秋水仙素处理浓度越高,蓝莓苗成活率越低。
2.1.2 变异率
由表2可知,蓝莓苗变异率排序为B1>B2>C3>B3>A2>A3>C1>C2>A1,B1处理和B2处理的变异率分别为35.7%和29.6%。当秋水仙素处理浓度为0.1%时,随着处理时间的增加,变异率变化趋势为先升后降,最高达21.4%;浓度为0.2%时,随着处理时间延长,变异率逐渐降低,最高为35.7%;浓度为0.4%时,随着处理时间的延长,变异率先降后升,最高为25.0%。在处理时间为10 h、18 h时,随着处理浓度的增加,变异率呈现先增大后减小趋势;在处理时间为26 h时,变异率随浓度的增加而增大。
2.2 秋水仙素对蓝莓组培苗形态指标的影响
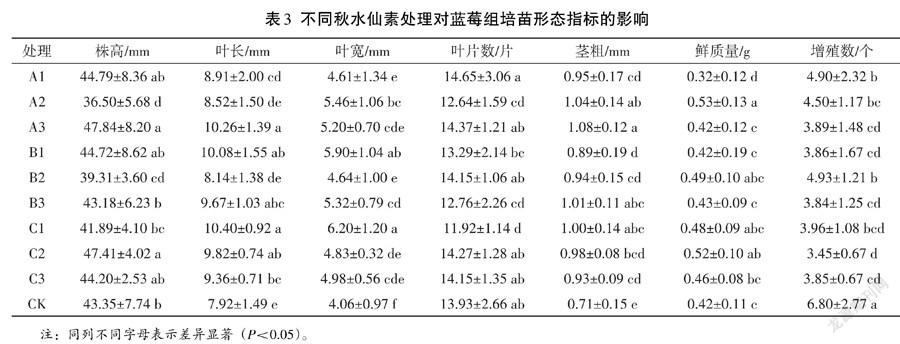
由表3可知,不同秋水仙素处理下蓝莓组培苗形态指标差异显著。1)株高排序为A3>C2>A1>B1>C3>CK>B3>C1>B2>A2,A3处理平均株高最高,为47.84 mm,比对照高4.49 mm;A1、B1、C2、C3与A3处理间差异不显著(P>0.05),A2、B2、B3、C1、CK與A3处理间差异显著(P<0.05)。2)叶长排序为C1>A3>B1>C2>B3>C3>A1>A2>B2>CK,C1处理叶长最长,为10.40 mm,比对照长2.48 mm;A3、B1、B3、C2与C1处理间差异不显著(P>0.05),A1、A2、B2、C3、CK与C1处理间差异显著(P<0.05),B2、CK处理叶长最短,且二者间差异不显著(P>0.05)。3)C1处理叶宽值最大(6.20 mm),CK叶宽值最小(4.06 mm),两者相差2.14 mm;各处理叶宽排序为C1>B1>A2>B3>A3>C3>C2>B2>A1>CK,但C1与B1处理间差异不显著(P>0.05)。4)叶片数最多的为A1(14.65片),各处理具体排序为A1>A3>C2>C3=B2>CK>B1>B3>A2>C1,但A3、B2、C2、C3、CK与A1处理间差异不显著(P>0.05)。5)A3处理茎段最粗(1.08 mm),CK茎段最细(0.71 mm),两者相差0.37 mm;各茎段粗度排序为A3>A2>B3>C1>C2>A1>B2>C3>B1>CK,但A3与A2、B3、C1处理间差异不显著(P>0.05)。6)A2处理鲜质量最大,为0.53 g,各处理鲜质量排序为A2>C2>B2>C1>C3>B3>A3=B1=CK>A1,其中B2、C1、C2与A2处理差异不显著(P>0.05)。7)CK处理增殖数最多,为6.8个,其次为B2处理,增殖数为4.93个,二者差异显著(P<0.05);各处理增殖数排序为CK>B2>A1>A2>C1>A3>B1>C3>B3>C2。
2.3 秋水仙素对蓝莓组培苗各指标隶属度、综合值及半致死时间的影响
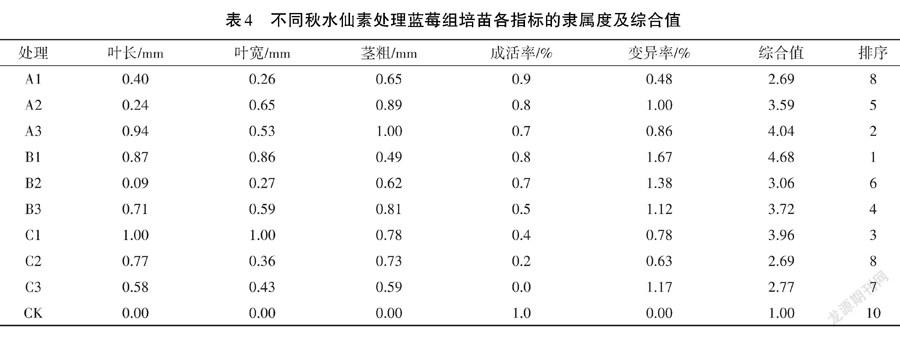
由表4可以看出,通过隶属函数对蓝莓组培苗叶长、叶宽、茎粗、存活率及变异率5项指标综合分析发现,效果最好的为B1处理,即0.2%浓度的秋水仙素浸泡10 h时,“法新”蓝莓植株的变异效果达到最好。
对表2中秋水仙素浓度0.2%时处理组数据进行半致死时间方程的拟合,将该浓度下的处理时间及相应的死亡率代入计算得出线性回归方程为y=0.625x-0.116 7,R2=0.962 9。经计算,蓝莓植株在秋水仙素浓度为0.2%时的半致死时间为80.19 h,说明秋水仙素溶液对“法新”蓝莓植株毒性较弱。
3 小结与讨论
秋水仙素诱导在多倍体育种中应用广泛且效果明显[11]。本试验中,“法新”蓝莓在0.2%秋水仙素溶液中处理10 h时,植株死亡率6.7%,变异率35.7%,诱导效果最佳。
有研究表明,处理材料的死亡率与秋水仙素浓度和处理时间成正比关系[1]。本试验表明,同一处理浓度下,植株的死亡率随着秋水仙素处理时间的延长而增大;同一处理时间下,植株的死亡率随着秋水仙素浓度的增高而增大,与前人研究结果趋势一致[12]。
秋水仙素对植株毒性的大小常用半致死时间(LT50)作为参数,在EMA诱导小麦突变的研究中,半致死时间筛选适宜的处理条件有重要的指导作用[13]。本试验发现,0.2%浓度的秋水仙素对“法新”蓝莓植株的毒性较弱,该结果与前人针对越橘属植物的研究结果不一致,推测可能与植物品种有关,具体原因有待进一步研究。
有研究发现,对黄心猕猴桃进行多倍体诱导时出现叶片颜色加深、叶片增厚的现象;诱导黄瓜获得四倍体时,植株出现茎段明显增粗等特征[14-15]。本试验中,经秋水仙素处理后的蓝莓组培苗在生长过程中出现叶片颜色变深、叶表皮毛增多、叶面积显著增大、茎段明显增粗及增殖系数减小等现象,各项形态指标与对照差异均具有统计学意义。下一步将对获得的多倍体植株炼苗移栽,观察其田间性状表现。
参考文献:
[1] 李雪松,赵康,李凌.越橘“Legacy”离体培养及秋水仙素诱变研究初报[J].西南大学学报(自然科学版),2015,37(5):51-57.
[2] 周继芬,兰武,王军,等.蓝莓营养及独特保健功能研究[J].北方园艺,2020(21):138-145.
[3] 裴新澍.植物多倍体育种[J].中国农业科学,1962(12):6-12.
[4] 韦荣昌,吴庆华,马小军,等.植物多倍体的研究进展[J].种子,2013,32(7):50-52.
[5] 周璐璐.沙芦草染色体加倍技术及再生体系建立研究[D].银川:宁夏大学,2016.
[6] 张爱清.人工诱导植物多倍体的方法初探[J].中学生物学,2016,32(4):5-6.
[7] 刘圣明.灰葡萄孢菌抗多菌灵β-微管蛋白基因在禾谷镰孢菌中的表达研究[D].南京:南京农业大学,2011.
[8] 王长泉,李雅志,崔德才,等.苹果叶片离体培养中秋水仙素加倍效应的研究[J].核农学报,1997(1):23-27.
[9] 李映乐,张伊,李茹,等.秋水仙素诱导人参果“圆果”多倍体的初探[J].江苏农业科学,2021,49(10):122-126.
[10] 冯琛,黄学旺,李兴亮,等.不同苹果矮化砧穗组合的抗旱性比较研究[J].园艺学报,2022,49 (5):945-957.
[11] Hisato K, Toshiki N, Kinya M, et al. Somaclonal and chromosomal effects of genotype, ploidy and culture duration in Asparagus officinalis L.[J]. Euphytica, 1998, 102(3): 309-316.
[12] 杨佩.花魔芋多倍体诱导技术研究[D].荆州:长江大学,2013.
[13] 闫炯,付晶,刘桂茹,等.EMS诱变小麦河农822的SSR及SDS-PAGE鉴定[J].河北农业大学学报,2008(1):1-5.
[14] 魏卓,张先昂,张越,等.黄心中华猕猴桃多倍体诱导及鉴定[J].分子植物育种,2020,18(12):
4036-4040.
[15] 武娅歌,赵建华,宋晓飞,等.欧洲温室型黄瓜同源四倍体新种质的创制与鉴定[J].江苏农业科学,2019,47(18):141-145.
收稿日期:2022-03-11
基金项目:贵州省生物研究所基金项目“水肥调控对蓝莓生长发育及果实品质的影响”(黔生所字〔2021〕02号);贵州科学院青年基金项目“蓝莓菌根形成调控因素及接种效应的研究”(黔科院J字〔2021〕15号);贵州省科技计划项目“贵州不同海拔地区高丛类食鲜蓝莓良种鉴选及配套栽培技术研究”(黔科合支撑〔2021〕一般232)。
作者简介:崇慧影(1992—),女,安徽阜阳人,硕士,研究实习员,研究方向为作物栽培育种。
*为通信作者,E-mail:875004614@qq.com。

