PTCDI//δ-MnO2水系铵离子电池性能研究
孙 颖,赵 钦,尹博思,马天翼
(1辽宁大学,辽宁沈阳 110036;2斯威本科技大学,澳大利亚墨尔本 3000)
随着化石能源的逐渐枯竭,人类对清洁能源的需求持续增长。开发及应用稳定的电化学储能系统(EES)是实现社会可持续发展目标的关键技术之一[1-3]。在众多储能器件中,水系二次电池具有低成本、高安全性、环境友好等特点,是极具应用前景的新一代储能电池。目前,水系二次电池主要采用金属离子作为载流子,如Li+[4]、Na+[5]、K+[6]、Ca2+[7]、Mg2+[8]、Zn2+[9]和Al3+[10]等。研究人员发现,在以上水系电池中,金属离子在进入电池材料结构时往往伴随着水合氢离子的共嵌入过程。这一现象,引发了人们对利用非金属电荷载体实现储能的研究兴趣。
相比于传统的金属离子,非金属离子来源广泛,生态友好,并且分子量小,水合离子尺寸小,在液相离子传输、固相扩散等方面具有独特的本征优势。表1列举了各载流子的水合离子半径。在各种非金属电荷载流子中,水合铵离子(NH4+)半径最小,成本低廉,腐蚀性小,且不易发生析氢副反应,适宜利用其开发新一代非金属离子电池。制备具有高度可逆NH4+离子容纳能力的电极材料是构建高性能水系铵离子电池的基础。目前,铵离子电池电极材料仍处在探索阶段,只有少数材料被证实有储铵能力,如部分普鲁士蓝类化合物[11-14]、Ti3C2MXene[15]、导电聚合物[16-18]、钛酸[19]、少部分过渡金属氧化物(V2O5[20]、NH4V4O10[21]、MoO3[22])。然而NH4+在这些电极材料主体晶格中尚不能形成强氢键,未能实现电极材料高倍率性能以及长循环寿命的目标。并且多数的研究都集中在铵电半电池上,对于水系全电池的探索仍然匮乏。

表1 载流子的水合离子半径[23]Table 1 Hydrated radius of charge carriers[23]
考虑到电极材料在氨化/脱氨过程中会发生的结构改变,本文选取具有层状结构的δ-MnO2纳米片作为正极材料,采用有机固体3,4,9,10-四甲酰二亚胺(PTCDI)作为负极材料,通过XRD、SEM、TEM、XPS、FTIR、拉曼光谱等分析手段对正极和负极材料的结构、形貌和组分进行了分析。采用循环伏安法、恒电流充放电法等对半电池以及PTCDI//δ-MnO2全电池进行放电比容量、倍率性能以及循环性能的研究。研究结果表明层状结构的δ-MnO2电极材料可以提供足够空间来容纳NH4+,能够实现有效且可逆的NH4+存储。PTCDI//δ-MnO2全电池在0~1.5 V电压窗口内可以稳定工作500个循环周期。水系铵离子电池虽然还没得到广泛探索,但即将激起电池领域新的浪潮。电池新概念、新材料和新体系的探索和研究,也将推动新一代绿色电池的开发。
1 实验部分
1.1 材料的制备过程
正极材料的制备:采用KMnO4热分解法制备了层状δ-MnO2。具体步骤如下:称取2 g 研细的KMnO4粉末,在马弗炉中于350 ℃下加热5 h,随后自然冷却。用去离子水洗涤3次至滤液无色,在60 ℃下于真空干燥箱中干燥12 h,然后在进一步表征之前在玛瑙研钵中将其研磨成粉末。
负极材料选取有机固体3,4,9,10-四甲酰二亚胺(PTCDI),它是一种商用染料,购自玛雅试剂。
1.2 电池组装及电化学性能测试
在三电极体系中,将碳棒作为对电极,饱和甘汞电极作为参比电极。电解液为0.5 mol/L 的NH4Ac 溶液。正极工作电极由活性物质(δ-MnO2)、导电炭黑(super P)、聚偏氟乙烯(PVDF)黏结剂按质量比8∶1∶1的比例在N-甲基吡咯烷酮(NMP)溶剂中混合研磨均匀,涂覆在碳纸集流体上,并在真空干燥箱中60 ℃下干燥12 h。使用冲片机将涂覆活性物质的碳纸制备成直径为12 mm的圆形极片,并计算活性物质负载量。经计算,本文正极工作电极活性物质负载量范围为1.2 ~1.8 mg/cm2。负极工作电极的制备方法同正极,活性物质(PTCDI)、导电炭黑(super P)、聚偏氟乙烯(PVDF)的质量比为8∶1∶1,经计算其活性物质负载量为1.2~1.8 mg/cm2。水系全电池的正、负极片的制备方法与三电极体系相同,隔膜采用玻璃纤维,电解液使用0.5 mol/L 的NH4Ac 溶液,在大气环境下组装成CR2032型纽扣电池。
使用法国VMP3多通道电化学工作站对三电极体系进行循环伏安(CV)测试和恒电流充放电(GCD)测试,正极电压范围0 ~0.8 V,负极电压范围-0.9~0.2 V;对扣式电池进行CV测试,电压范围0~1.5 V。使用深圳新威测试仪对电池进行倍率性能及循环性能表征。
1.3 材料表征
采用德国Bruker D8-Advance X 射线衍射仪(XRD)确定样品物相结构与结晶性强弱,其测试条件为:Cu靶K射线,测试范围为:5°~80°,扫描速率为10°/min。采用日本日立公司的HITACHI,SU8010 扫描电子显微镜(SEM)表征样品的微观形貌。采用日本JEOL 2100F 透射电子显微镜(TEM)表征样品的微观结构。采用美国Thermo Scientific KαX 射线光电子能谱(XPS)收集样品表面元素信息,并对其进行组成及含量的分析。以Al-Kα辐射(hν=1486.6 eV)为激发源进行测试,测试时真空度约为3×10-7mba(1 mba=100 Pa),束斑尺寸大小为400 μm。结合能量标度用C 1s(284.6 eV)加以校正。采用德国Bruker Tensor II进行傅里叶变换红外光谱(FTIR)分析,测试波长范围为400~4000 cm-1。采用法国LabRAM HR Evolution-HORIBA 进行拉曼光谱分析,激发波长为532 nm。
2 δ-MnO2纳米片正极和PTCDI 纳米粒子负极在铵离子电池中的应用
2.1 δ-MnO2纳米片的表征
通过KMnO4热分解法制备了层状δ-MnO2,反应方程式表示如下[24]

图1(a)为δ-MnO2的XRD 衍射谱图,所有衍射峰均与卡片(JCPDS:42-1317)吻合,证实产物为δ-MnO2,属单斜结构,未检测到明显的杂质峰。δ-MnO2是由位于(001)平面上共边的MnO6八面体构成的层状的二维结构[24-25]。图1(b)为δ-MnO2的FTIR光谱图。在520 cm-1处的吸收峰可以归结为Mn—O键的弯曲振动,在1403 cm-1、1658 cm-1处的吸收峰可以归结为O—H 键和Mn 原子的弯曲振动,在3344 cm-1处的吸收峰可以归结为层间水分子和羟基的拉伸和弯曲振动[26-28]。图1(c)为δ-MnO2的拉曼光谱图,可以观察到两个特征位移,在632 cm-1处的拉曼位移是由MnO6八面体的Mn—O键的伸缩振动引起的,在339 cm-1处的拉曼位移归因于MnO2的Mn—O—Mn 键的弯曲振动[29-30]。通过XRD、FTIR光谱和拉曼光谱结果分析,可以证明纯相的δ-MnO2被成功合成。利用XPS谱图进一步研究δ-MnO2中元素的详细组成和价态。图1(d)证明了所合成的δ-MnO2中O、Mn元素的存在。图1(e)的O 1s光谱与Mn—O—Mn 键(中心位于529.7 eV),Mn—O—H键(中心位于530.2 eV),H—O—H 键(中心位于531.6 eV)的存在相吻合[31-33],同时结构中含有水分子。图1(f)展示了Mn 2p 谱图,两个峰分别位于654.1 eV和642.6 eV,Mn 2p1/2和Mn 2p3/2二者的波峰间距为11.5 eV,在图4(a)的Mn 3s 谱图中波峰间距为4.6 eV,证明了δ-MnO2中Mn4+的存在[30-34]。
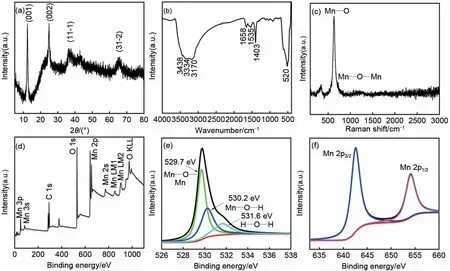
图1 δ-MnO2的结构表征:(a)XRD谱图;(b)FTIR光谱图;(c)拉曼光谱图;(d)XPS全谱扫描图;(e)O 1s XPS谱图;(f)Mn 2p XPS谱图Fig.1 Structural characterization of δ-MnO2:(a)XRD patterns,(b)FTIR spectra,(c)Raman spectrum,(d)Survey XPS spectra and corresponding high-resolution XPS spectra of(e)O 1s and(f)Mn 2p
图2(a)~(b)为δ-MnO2在不同放大倍数下的SEM 图。通过图2(b)所示的高倍SEM 图可以清晰看到合成的δ-MnO2呈片状结构。电极的性能可能受粒径、形貌等因素的影响[12]。为了探究粒径对电极性能的影响,本工作采取商业大粒径的MnO2为对比样,进行了相同条件下的性能测试,并在后续进行了讨论。其中,商业MnO2的SEM图如图2(c)~(d)所示。与所合成的δ-MnO2相比,商业MnO2粒径明显增大。为了进一步研究水热法制备的δ-MnO2的微观形貌,对其进行了TEM 测试,如图2(e)~(f)所示。图2(e)的低倍TEM 图进一步证实了δ-MnO2的片状形貌,与SEM结果相符。0.14 nm的晶面间距对应δ-MnO2的(31-2)晶面,这与XRD 结果相一致[图2(f)]。

图2 MnO2的微观形貌和微观结构的表征:(a)、(b)δ-MnO2的SEM图;(c)、(d)商业MnO2的SEM图;(e)、(f)δ-MnO2的TEM图Fig.2 Characterization of microscopic morphology and microstructure of MnO2:(a),(b)the SEM images of δ-MnO2;(c),(d)the SEM images of commercial MnO2;(e),(f)the TEM images of δ-MnO2
2.2 δ-MnO2纳米片的电化学性能测试
为了研究上述δ-MnO2正极材料的储铵性能,首先,在含0.5 mol/L 的NH4Ac 电解液中进行了三电极电化学性能的测试。图3(a)为δ-MnO2电极在不同扫速下的CV 曲线,在0.4 V 左右可以发现一对明显的氧化还原峰,这主要归因于NH4+的脱嵌。随着扫速的增大,氧化峰向正电位偏移,还原峰向负电位偏移,这是由于扫速的增大,极化反应加重引起的。CV 峰值电流(i)和扫速(v)之间有如下关系[35-36]

将此公式进行变形,改写为

其中,b表示log(i)对log(v)曲线的斜率,其范围通常在0.5~1。当b值为0.5时,电化学过程受离子扩散控制。当b值达到1时,表面赝电容行为将主导整个充放电过程。通过线性拟合log(i)与log(v)的关系,可以从动力学角度初步区分纳米结构电极中扩散控制的容量贡献和赝电容贡献。如图3(b)所示,两个峰对应的b值分别为0.74和0.70。这说明δ-MnO2电极的电化学反应同时受离子扩散和赝电容反应的控制。这一特性是δ-MnO2电极高倍率性能的原因。具体电容型容量贡献比例可以通过以下方法计算[37]

此公式可变形为

其中,i代表着响应电流;k1v和k2v1/2分别代表电容型容量贡献和离子扩散型容量贡献。由于k1可以通过拟合i/v1/2与v1/2的关系图得到,因此,通过CV曲线可以计算电极材料在不同扫速下两种类型产生的容量对电极总容量的贡献比例。通过图3(c)可以发现,当扫速为0.1 mV/s,电容贡献为34%。随着扫速的增加,在0.2 mV/s、0.3 mV/s、0.5 mV/s、0.8 mV/s 的扫速下,电容贡献分别达到42%、45%、51%、60%。在较低扫速下,扩散控制过程在δ-MnO2电极的容量总贡献中占主导地位,随着扫速的增大,电容型容量贡献占比不断增大。电容型占比的增大有利于电极获得高倍率下的电化学性能。
图3(d)是δ-MnO2电极在不同电流密度下的恒电流放电曲线,随着电流密度的增加,δ-MnO2电极的容量逐渐下降。图3(e)展示了较为优异的倍率性能,当电流密度重新回到0.5 A/g 时,容量可以达到初始容量的70%。造成容量损失的原因可能来自于δ-MnO2的部分溶解。为了探究粒径大小对电极性能的影响,我们在0.5 A/g 的电流密度下分别对δ-MnO2纳米片电极和粒径较大的商业MnO2电极进行了恒电流充放电测试,结果如图3(f)所示。δ-MnO2电极在0.5 A/g的电流密度下,放电比容量为47 mA·h/g,库仑效率为100%。在相同条件下商业MnO2电极的放电比容量仅为12 mA·h/g,这表明较小的纳米级粒径有助于提升电极的性能。
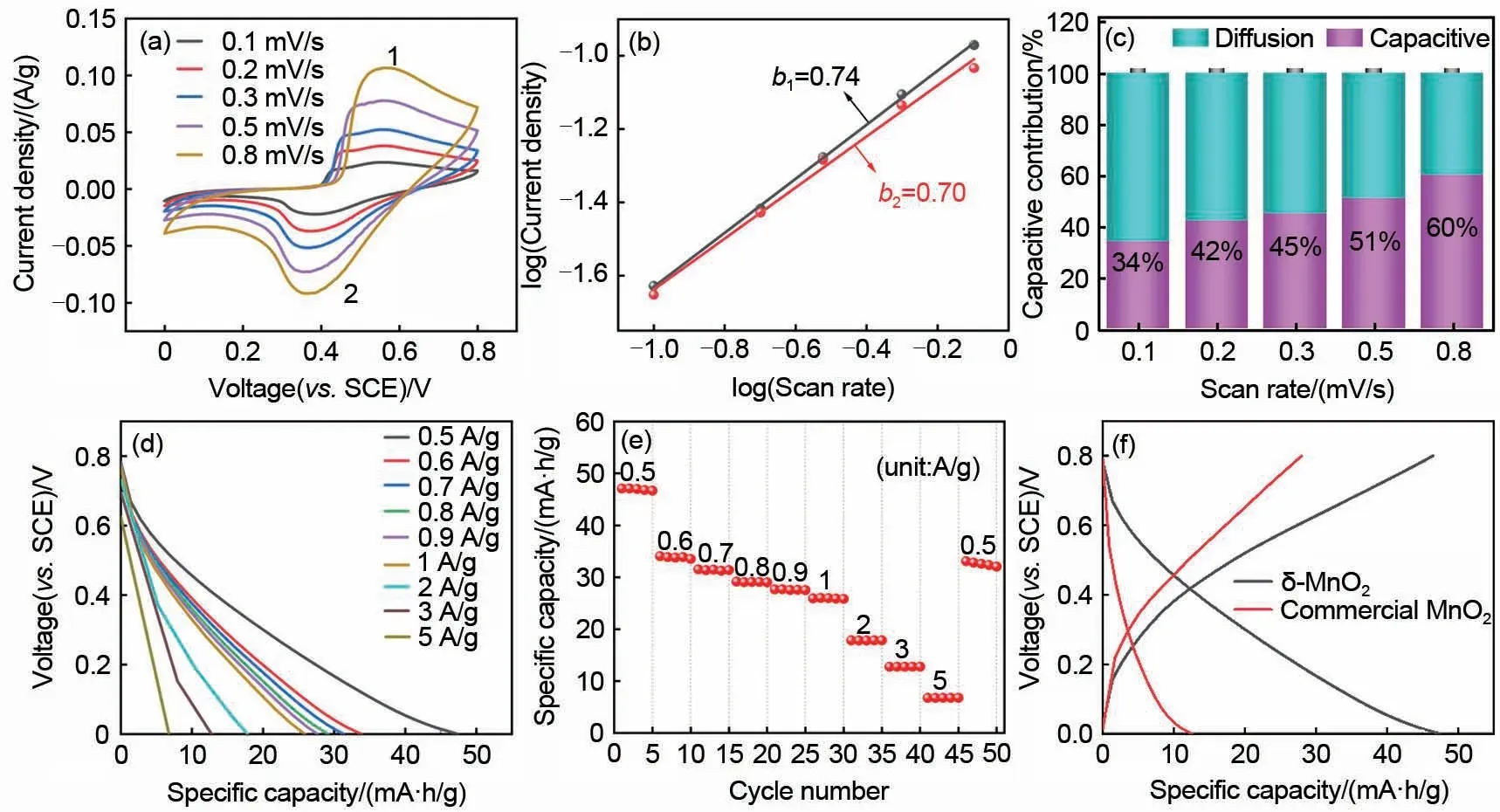
图3 δ-MnO2电极的动力学分析和电化学性能:(a)在不同扫速下的CV曲线;(b)各CV曲线log(峰值电流)vs.log(扫描速率)图;(c)不同扫速下的电容贡献比;(d)在不同电流密度下的恒电流放电曲线;(e)倍率性能;(f)δ-MnO2和商业MnO2电极在0.5 A/g的电流密度下的恒电流充放电曲线Fig.3 Kinetic analysis and electrochemical performance of δ-MnO2 electrode:(a)The CV curves at different scan rates;(b)The corresponding plots of log(peak current)vs.log(scan rate)at each peak;(c)The capacitive contribution at different scan rates;(d)The galvanostatic discharge curves at different current densities;(e)The rate capability;(f)The galvanostatic charge/discharge curves at 0.5 A/g of δ-MnO2 and commercial MnO2 electrode
2.3 δ-MnO2纳米片中NH4+的储存机制
为了了解δ-MnO2纳米片中NH4+的储存机制,对不同的充放电状态的δ-MnO2电极进行了非原位XPS 测试。选择了δ-MnO2电极的两种电荷状态:第一次放电状态(0 V)和第一次充电状态(0.8 V)。
δ-MnO2在不同电荷状态下的Mn 3s XPS 谱图如图4(a)所示,初始δ-MnO2的Mn 3s 的两波峰间距为4.6 eV,表明其化合价为+4 价。在第一次放电至0 时,波峰间距为4.9 eV,表明Mn 的化合价为+3价,此时NH4+嵌入δ-MnO2材料中。而当第一次充电至0.8 V 时,波峰间距为4.7 eV,表明Mn的化合价为+4 价,此时NH4+由δ-MnO2材料中脱出[34]。图4(b)为δ-MnO2在不同荷电态的N 1s XPS谱图,由图可知在放电过程中,N 1s XPS 谱向更高的结合能方向移动,这说明NH4+与δ-MnO2之间存在着相互作用[38]。

图4 (a)δ-MnO2在不同荷电态的Mn 3s XPS谱图;(b)δ-MnO2在不同荷电态的N 1s XPS谱图Fig.4 (a)XPS Mn 3s spectra for the different states of charge of δ-MnO2;(b)XPS N 1s spectra for the different states of charge of δ-MnO2
2.4 PTCDI纳米粒子的表征
PTCDI 分子式为C24H10N2O4,分子量为390.35,是紫红色的粉末。其沸点为(821.4±61.0)℃,密度为(1.680±0.06) g/cm3,酸度系数为(8.75±0.20),不溶于水。PTCDI及其衍生物具有良好的电子亲和力和较快的电子迁移率,是一种在有机光电子中被广泛应用的n型半导体。PTCDI是商业度成熟并且无毒的材料,成本低,可以满足大规模电池应用的需求[39]。
PTCDI 的XRD 谱图如图5(a)所示。与以往的文献进行对比[39-41],图中XRD 峰分别属于PTCDI晶体(单斜P21/n空间群)的(011)、(021)、(002)、(11-2)、(12-2)和(140)晶面。随后,通过FTIR光谱确定了PTCDI的分子结构。如图5(b)所示,所有的FTIR 峰的出现都可以归属于PTCDI 结构中苝环和亚胺基团的特征振动。在3041 cm−1、2919 cm−1、2848 cm−1和1587 cm−1处的吸收峰反映了Ar(C−H)键和苝环的伸缩振动,而在3155 cm−1、1686 cm−1、1360 cm−1和1275 cm−1处的吸收峰分别反映了亚胺基团的N—H、C=O和C—N键的伸缩振动[40]。

图5 PTCDI的结构表征:(a)XRD谱图;(b)FTIR光谱图Fig.5 Structural characterization of PTCDI:(a)XRD patterns,(b)FTIR spectra
通过SEM和TEM研究了PTCDI的微观形貌和微观结构。PTCDI 在不同放大倍数下的SEM 图如图6(a)~(c)所示。PTCDI呈现颗粒状,其形状不规则,粒径不均匀。图6(d)~(f)为PTCDI的TEM图,其中图6(e)和图6(f)是图6(d)的高倍TEM图,可以发现PTCDI纳米粒子晶格条纹不明显。

图6 PTCDI的微观形貌和微观结构的表征:(a)~(c)SEM图;(d)~(f)TEM图Fig.6 Characterization of microscopic morphology and microstructure of PTCDI:(a)—(c)the SEM images;(d)—(f)the TEM images
2.5 PTCDI纳米粒子的电化学性能测试
同样地,在三电极体系中,对PTCDI 电极的电化学性能进行了研究。图7(a)为PTCDI电极在不同扫速下的CV 曲线图,从图中可以发现一对明显的氧化还原峰-0.63 V/-0.1 V,这对应着NH4+的嵌入/脱出。在图7(b)中,通过线性拟合log(i)与log(v)的关系,计算出两个峰分别对应的b值为0.84、0.73。这说明PTCDI电极的电化学反应同时受离子扩散和赝电容反应的控制。在图7(c)中,通过CV曲线分别计算了PTCDI 电极在不同扫速下电容型容量和离子扩散型容量对电极总容量的贡献比例。在PTCDI 电极的容量总贡献中占主导地位的为电容型容量。当扫速从0.1 mV/s增大至0.8 mV/s时,电容贡献比例从57%增大至78%。电容型占比的增大有利于电极获得高倍率下的电化学性能[42]。PTCDI 电极在0.5 A/g 的电流密度下的恒电流充放电曲线如图7(d)插图所示,曲线在-0.6 V左右有一个放电平台,对应着NH4+的嵌入,在-0.1 V左右有一个充电平台,对应着NH4+的脱出。该结果与图7(a)的CV曲线结果是一致的。图7(d)展示了PTCDI电极在不同电流密度下的恒电流放电曲线,当电流密度为0.5 A/g 时,PTCDI 电极的放电比容量为58 mA·h/g,当电流密度增大到5 A/g 时,PTCDI电极的放电比容量为55 mA·h/g,放电比容量未见明显衰减,其倍率性能优异。图7(e)更加直观地表现了PTCDI 电极的倍率性能,当电流密度重新回到0.5 A/g时,容量可以达到100%的恢复。循环性能也是衡量半电池的重要性能指标之一,如图7(f)所示,PTCDI 电极在0.5 A/g 的电流密度下经过500周循环,容量保持率可以达到96%,充分展现了其良好的循环稳定性,这对于构建的全电池体系的循环稳定性具有重要意义。

图7 PTCDI电极的动力学分析和电化学性能:(a)在不同扫速下的CV曲线;(b)各CV曲线log(峰值电流)vs.log(扫描速率)图;(c)不同扫速下的电容贡献比;(d)在不同电流密度下的恒电流放电曲线[图(d)中插图:在0.5 A/g的电流密度下的恒电流充放电曲线];(e)倍率性能;(f)在电流密度为0.5 A/g时的循环稳定性Fig.7 Kinetic analysis and electrochemical performance of PTCDI electrode:(a)The CV curves at different scan rates;(b)The corresponding plots of log(peak current)vs.log(scan rate)at each peak;(c)The capacitive contribution at different scan rates;(d)The galvanostatic discharge curves at different current densities[inset in(d):The galvanostatic charge/discharge curves at 0.5 A/g];(e)The rate capability;(f)Cycling stability at the current density of 0.5 A/g
2.6 PTCDI//δ-MnO2器件的电化学性能
将δ-MnO2纳米片与PTCDI 纳米粒子分别作为正极和负极材料,组装成扣式电池进行电化学性能测试。电解液选取0.5 mol/L的NH4Ac溶液。
PTCDI//δ-MnO2全电池在不同扫速下的CV曲线如图8(a)所示。从图中可以发现两对明显的氧化还原峰,分别位于1.1 V/1.3 V、0.5 V/1.0 V。图8(b)是PTCDI//δ-MnO2全电池在不同的电流密度下的恒电流放电曲线,在电压为0.5 V和1.0 V处可以看到两个较为明显的放电平台,这与CV曲线结果可以很好地对应。当电流密度为0.5 A/g时,PTCDI//δ-MnO2全电池的放电比容量为21 mA·h/g,随着电流密度的增大,全电池的放电比容量逐渐衰减。图8(c)展现了PTCDI//δ-MnO2全电池优异的倍率性能,当电流密度重新回到0.1 A/g时,容量可以达到100%的恢复。循环性能也是衡量电池性能的重要指标。如图8(d)所示,PTCDI//δ-MnO2全电池表现出良好的循环稳定性,在0.5 A/g 的电流密度下500 次循环中容量保持率约为92%,库仑效率接近100%。这与前文PTCDI 电极的良好的循环稳定性的测试结果具有密切联系。

图8 PTCDI//δ-MnO2全电池的电化学性能:(a)在不同扫速下的CV曲线;(b)在不同的电流密度下的恒电流放电曲线;(c)倍率性能;(d)在电流密度为0.5 A/g时的循环稳定性和库仑效率Fig.8 Electrochemical performance of PTCDI//δ-MnO2 full battery:(a)The CV curves at different scan rates;(b)The galvanostatic discharge curves at different current densities;(c)The rate capability;(d)Cycling stability and coulombic efficiency at the current density of 0.5 A/g
PTCDI//δ-MnO2水系铵离子电池电压窗口较高,一两块电池即可用于风扇、灯泡等常见电器电力的供给,显示出了巨大的实际应用潜力[如图9(a)~(c)所示]。

图9 (a)PTCDI//δ-MnO2全电池可以给小风扇供电;(b)、(c)PTCDI//δ-MnO2全电池可以给不同LED灯供电Fig.9 (a)PTCDI//δ-MnO2 full cell can easily power the small fan;(b),(c)PTCDI//δ-MnO2 full cell can easily power different LEDs
综上所述,相比于传统金属离子电池,水系铵离子电池具有诸多本征优势。
(1)成本。与金属载流子相比,NH4+更为廉价且环保,铵离子电池的制造成本、维护成本、运行成本和环境影响都具有明显优势。
(2)容量。一价非金属阳离子载流子存储的容量可与一价金属载流子相当,甚至更高。非金属离子的分子量普遍小于金属离子,某些特定材料的理论比容量由于质轻会更高。
(3)工作电压。非金属载流子具有特定的工作电压范围。在电化学反应过程中,实际输出电位与电解质离子的去溶剂化能力有关。减小嵌入离子去溶剂化过程的能量损失,可以使离子在更低的过电位下,获得更高的放电平台。由于NH4+具有更小的斯托克斯(Stokes)半径以及更低的去溶剂化能垒,理论上将有更多的NH4+进入主体材料进行嵌入反应,且此过程将比一价金属载流子(如Li+、Na+、K+)更快速。
(4)高倍率性能。即快速充电能力,对于间歇性能量转换装置尤为重要。非金属载流子具有较小的扩散能垒,有助于提高倍率性能。此外,小尺寸的非金属NH4+载流子理论上可以实现150~500 C的高倍率性能,而金属载流子的倍率性能通常低于100 C。
(5)循环稳定性。循环稳定性与电极的结构稳定性有关。非金属阳离子载流子由于体积小,对主体材料结构影响较小。可以极大程度地缓解材料的循环不可逆性和溶解问题。例如,金属Li+的电荷密度高,去溶剂化过程所需活化能较高,嵌入时所需能量较大,且与电极具有强静电相互作用,会导致电极的结构发生不可逆的坍塌或溶解。而非金属载流子NH4+和电极之间的相互作用主要依靠共价键(如氢键),可以使循环更加快速和稳定。
3 总结与展望
通过简单的KMnO4热分解法制备了层状的δ-MnO2材料。在三电极体系中对δ-MnO2纳米片和PTCDI纳米粒子进行了电化学测试,证明了二者可以作为的存储材料。对于δ-MnO2的储铵机理进行了探索,通过实验分析表明可以可逆地在电极材料中嵌入/脱出。本文首次以δ-MnO2纳米片为正极,PTCDI 纳米粒子为负极组装了扣式电池,在0.5 A/g 的电流密度下,经500 周的循环后容量保持率为92%左右,具有良好的循环稳定性。该扣式电池可以给小风扇和灯泡供电,具有一定的实际应用价值。
水系二次电池由于具有极高的安全性、较低的成本、环境友好等优点,被认为是极具应用前景的储能型电池。采用非金属作为水系电池的载流子可以实现大倍率、长循环的电化学性能。由于的四面体结构,较小的分子量,较小的水合离子半径等诸多优势,使得非金属电池有望获得优于金属离子电池的性能。通过对水系电池的研究,我们希望可以引起更多的电池领域的研究者们对于非金属离子作为电池载流子的关注,并逐步探索其后续的潜在应用。

