银鲳脾脏和肾脏组织细胞体外培养研究
王 燕, 舒凤玲, 陈东月, 王亚军, 解家松, 周素明
银鲳脾脏和肾脏组织细胞体外培养研究
王 燕, 舒凤玲, 陈东月, 王亚军, 解家松, 周素明*
(宁波大学 海洋学院, 浙江 宁波 315832)
为探究银鲳脾脏和肾脏组织细胞体外培养条件, 本研究采用组织块培养法对银鲳脾脏和肾脏组织进行原代培养. 实验选用DMEM/F-12、M199和DMEM等作为基础培养基, 在其中分别添加体积分数为10%、15%、20%的胎牛血清, 并添加青链霉素及庆大霉素以防细菌污染. 结果表明: 银鲳脾脏和肾脏组织在胎牛血清体积分数为20%的DMEM/F-12培养基中贴壁最好, 迁出细胞的种类最多, 细胞生长速度最快. 其中脾脏组织共迁出6种不同的细胞, 分别为: 免疫细胞、基质细胞、上皮样细胞、成纤维样细胞、造血灶和未知细胞; 肾脏组织共迁出3种细胞, 分别为: 上皮样细胞、巨噬细胞和成纤维样细胞.
银鲳; 脾脏; 肾脏; 细胞培养
银鲳()属鲈形目(Perciformes)、鲳科(Stromateidae)、鲳属(), 是我国沿海重要的经济鱼类之一, 主要分布于东海、南海、黄海、渤海等地区. 由于银鲳刺少、肉质细腻鲜美, 深受消费者的喜爱, 其市场需求量不断增大. 随着野生银鲳资源逐年减少, 以及我国禁渔期制度的执行, 捕捞银鲳已经无法满足市场的需求[1-2]. 因此, 银鲳的人工养殖及苗种繁育受到有关研究者的极大关注, 许多研究团队已开展银鲳人工繁殖的相关研究. 近些年, 银鲳的繁育及全人工养殖技术在宁波地区取得了重大突破[3-6], 但由于驯化时间短、养殖环境与野生环境存在较大差异等原因, 导致人工养殖的银鲳对环境中的病原微生物易感, 养殖过程中银鲳疾病频繁发生, 已成为银鲳养殖业亟待解决的问题[1].
细胞培养是细胞生物学研究方法的重要手段之一, 是推动生命科学领域发展的重要技术. 水产动物的细胞培养始于20世纪60年代, 最早被用于水产动物病毒的分离与纯化, 该技术对水产动物的疾病防治有着重大贡献[7-8]. Wolf和Quimby于1962年建立了世界上第一株鱼类细胞系–—虹鳟生殖腺细胞系(Rainbow Trout Gonadal Cell, RTG-2)[9]. 目前, 已建立的鱼类细胞系至少550株以上, 其材料主要源自鱼类的鳍、肌肉、表皮、肾脏、脾脏等不同组织. 随着鱼类细胞培养技术研究的深入, 其应用范围也从最初的病毒分离纯化扩展到鱼类的生理学、免疫学和病害防治等方面[10-11]. 脾脏和肾脏是鱼类重要的免疫造血器官, 在抵抗外来抗原的免疫调节过程中起到重要作用[12]. 目前已经有多种鱼类, 如草鱼()、花鲈()、赤点石斑鱼()、斑点叉尾()、松江鲈()、大黄鱼()、罗非鱼()等建立了脾脏及肾脏组织来源的细胞系[13-19]. 上述细胞系的建立为鱼类免疫及病毒性疾病的致病机理等基础研究提供了培养简单、遗传稳定的细胞模型和材料.
随着银鲳人工繁育及养殖技术的突破, 养殖银鲳的商业化道路已成为必然. 但目前对银鲳生理、遗传、营养及疾病等基础研究仍较为匮缺.
本文以银鲳脾脏、肾脏组织为研究材料, 通过组织块培养方法, 探索其离体培养条件, 旨在为银鲳脾脏、肾脏组织来源细胞系的建立及后续生理学、免疫学和病害防治等研究提供参考.
1 材料和方法
1.1 实验材料
实验银鲳购自宁波市象山港湾水产苗种有限公司, 体长(8±2)cm, 体质量(5.0±2.5)g.
主要试剂: DMEM(HyClone)、M199(HyClone)、DMEM/F-12(HyClone); 0.25%胰酶(含EDTA)、双抗(青霉素100IU·mL-1、链霉素100μg·mL-1);胎牛血清(FBS); 100mg庆大霉素; 25mg可溶性两性霉素B, 以上试剂均购自宁波镇海百川生物科技有限公司.
1.2 方法
1.2.1 培养基的配制
在3种培养液(DMEM/F-12、M199、DMEM)中分别添加10%、15%、20%胎牛血清, 50mg·mL-1庆大霉素、可溶性两性霉素B(3mg·mL-1)、100IU·mL-1青链霉素混合液配制成完全培养基.
1.2.2 组织分离及处理
将银鲳置于已消毒的托盘中, 用75%乙醇对银鲳进行体表消毒, 然后断尾放血, 移至超净台中, 用弯头镊子将银鲳的脾脏和肾脏取出, 置于装有2mL含抗生素(终质量浓度为100IU·mL-1的青链霉素混合液和100mg·mL-1庆大霉素、3mg·mL-1可溶性两性霉素B)的PBS的EP管中漂洗3次, 每次5min, 弃漂洗液; 然后分别加入1mL DMEM、M199、DMEM/F-12(添加终质量浓度为100IU·mL-1的青链霉素混合液和100mg·mL-1庆大霉素、3mg·mL-1可溶性两性霉素B)3种培养基进行消毒30min; 最后用剪刀将组织碎剪成1mm3组织块, 用上述3种培养基清洗2次, 每次5min.
1.2.3 肾脏和脾脏组织的原代培养
将经处理的组织细胞液(DMEM、M199、DMEM/F-12分别添加0.5%胎牛血清、终质量浓度100IU·mL-1的青链霉素混合液和100mg·mL-1庆大霉素)重悬后均匀接种于25cm2培养瓶中, 贴壁4h后分别添加3mL DMEM、M199、DMEM/F-12培养基(添加20%胎牛血清、终质量浓度100IU·mL-1的青链霉素混合液和100mg·mL-1庆大霉素), 并正置于26℃细胞培养箱中恒温培养. 随后在倒置显微镜下观察并记录. 根据细胞的迁出及生长状况, 每2~3d更换一半培养基.
2 结果
2.1 培养基对银鲳脾脏、肾脏组织细胞原代培养的影响
银鲳脾脏和肾脏组织细胞原代培养的实验结果见表1. 从表1可知, 在添加20%胎牛血清的3种基础培养基中, 银鲳脾脏和肾脏的组织块边缘都有细胞迁出, 其中DMEM和M199两种培养基中组织细胞迁出数量少、铺瓶率较低. 在随后培养过程中, 2种组织的组织块不会脱落, 但无细胞迁出; 而DMEM/F-12基础培养基中脾脏和肾脏组织块迁出细胞数量较多、铺瓶率高, 而且细胞的生长效果最好.
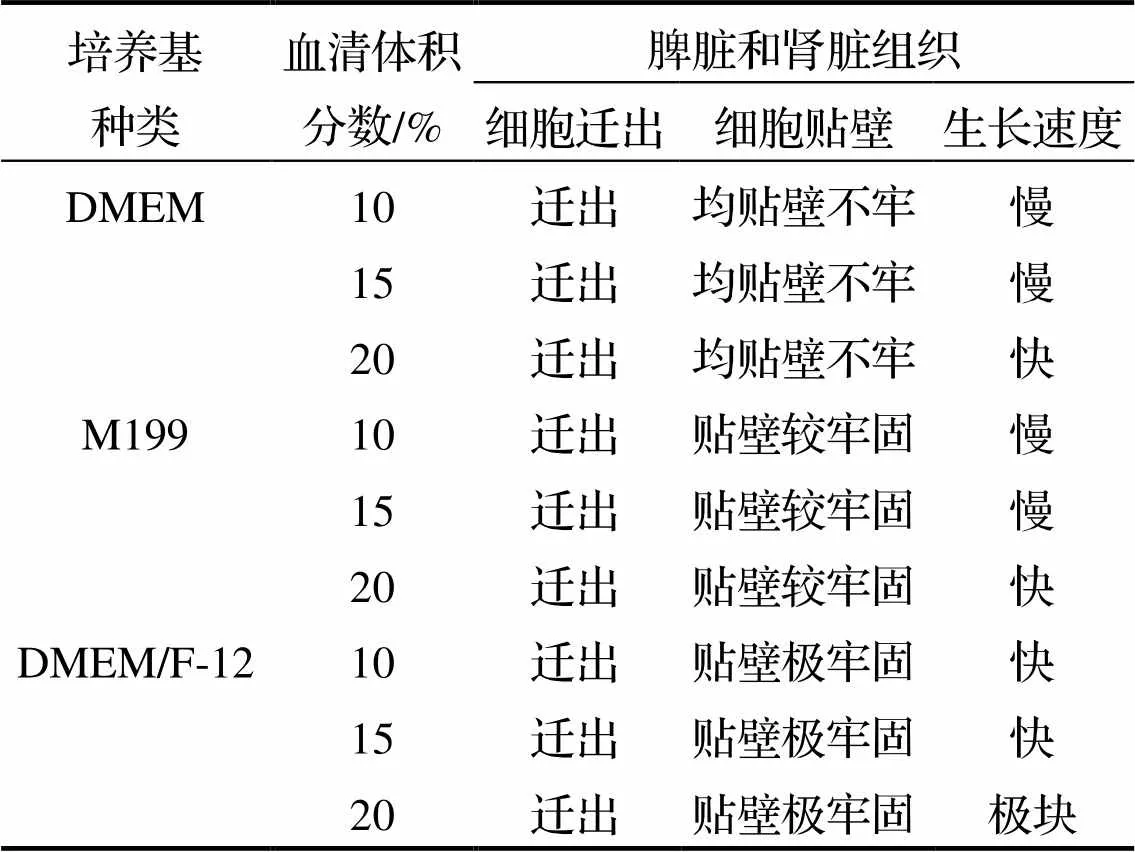
表1 银鲳脾脏、肾脏细胞原代培养基筛选
2.2 脾脏组织块迁出细胞形态和造血灶的产生
脾脏组织块接种贴壁5d后, 在添加20%FBS的DMEM/F-12培养基中大量细胞从组织块边缘迁出, 并且呈放射状排列在组织块周围, 按其形态和迁出顺序可以分为6种细胞(图1).
(1)A型细胞: 组织块接种贴壁后, 一些贴壁的植块在启动培养的第3天, 最先迁出少量全体通透的圆形(直径约10µm)或椭圆形细胞(图1(a)). 细胞个体多数较小, 细胞核清晰, 可以贴壁, 但贴壁不牢固. 培养第5天观察到部分细胞呈现椭圆形并伴有伪足生长, 迁出一些呈现马蹄形和三角形的细胞. (2)B型细胞: DMEM/F-12培养基中培养到第8 天, 观察到B型细胞从一些组织块边缘迁出(图1(b)). 这些细胞排列不均匀, 细胞质内存在大量黑色颗粒物质, 在细胞培养瓶底部以多层交叉网状结构存在, 细胞层质密、细胞贴壁牢固, 当细胞合成大片细胞层时在贴壁牢固的细胞层上出现一些零散的圆形细胞. (3)C型细胞: 在启动培养到第12天观察到C型细胞, 该细胞贴壁较牢固, 细胞形态为多角形、扁平状, 细胞排列紧密, 胞体内存在大量颗粒状物质, 细胞核不易辨清(图1(c)). (4)D型细胞: D型细胞与C型细胞同时出现, 是培养过程中一些组织块集中迁出的细胞(图1(d)). D细胞(长径50~120μm, 短径5~10μm)胞体多呈梭形、多角形和扁平星形等, 具有突起, 细胞颜色暗沉, 细胞核明显, 呈卵圆形, 一些细胞核中有2个核仁, 胞内含有许多小颗粒, 细胞呈交叉生长, 细胞贴壁极牢固. (5)E型细胞: 细胞大小不一、贴壁不牢, 最初依附于基质细胞生长, 表层出现一些全体通亮的圆形细胞, 单个零星分布, 慢慢聚集成簇, 成团块的细胞仍维持圆形, 逐渐变成小山样(图1(e)). (6)F型细胞: 细胞形态多样, 有不规则的三角形、梭形和圆形(图1(f)).

图1 体外培养的银鲳脾脏细胞
2.3 肾脏组织块迁出细胞形态
接种的肾脏组织块贴壁4d后, 大量的细胞开始从组织块的周围迁出, 并出现明显的生长晕(图2(a)). 开始的原代细胞是多种细胞共存, 随着培养时间的推移, 最终培养物中共产生3种不同形态的细胞(图2).
(1)A型细胞: 接种3~5d后的贴壁组织有细胞迁出, 细胞贴壁不牢, 细胞的胞核较小, 细胞呈现带有短小突起的圆形或椭圆形, 部分细胞带有较长伪足, 呈现不规则形状(图2(b)). (2)B型细胞: 在启动培养7d后, 一些植块边缘开始迁出B型细胞(图2(c)),迁出的细胞形态不一, 有的细胞呈现扁平状、多角形, 胞质内含有大量黑色颗粒. (3)C型细胞: 贴壁组织培养初期, C型细胞与B型细胞同时迁出(图2(d)), 细胞胞体呈现长梭形, 细胞交叉排列且没有生长方向, 一般形成复杂的网状结构. 当细胞不断增殖, 细胞排列也更加密集, 形成质密的细胞层, 此时细胞贴壁极牢固.

图2 体外培养的银鲳肾脏细胞
3 讨论
DMEM、M199和DMEM/F-12是鱼类细胞培养中广泛使用的基础培养基. DMEM相对于MEM含有丰富的氨基酸和维生素; M199适用于多种鱼类细胞的培养; DMEM/F-12营养成分丰富, 使用的血清较少[20-23]. Alvarez等[24]将DMEM/F-12培养基成功用于淡水鱼和海水鱼的鳍、肾等组织的培养. 李苗苗等[25]发现DMEM/F-12和L-15均适用于鳗鲡肾脏细胞的生长和增殖. Mauger等[26]在金鱼鳍条组织的体外培养中发现DMEM/F-12能够诱导培养物快速碱化, 因此不适合其鳍条组织细胞的增殖. 上述研究结果表明, 不同种类甚至同一种类不同组织迁出的细胞所需的培养基不同, 筛选合适的基础培养基是提高细胞在体外成活率的关键.
本研究选用3种培养基(DMEM、M199和DMEM/F-12)作为银鲳脾脏和肾脏等组织细胞培养的基础培养基, 经过对比发现DMEM/F-12对银鲳组织细胞的培养效果明显优于DMEM和M199(表1), 表明DMEM/F-12比较适合银鲳脾脏和肾脏组织细胞的体外培养.
胎牛血清是哺乳动物及鱼类细胞体外培养重要的添加成分, 能够为细胞提供生长所需的生长因子和各种营养物质, 但同时也含有一些对细胞增殖不利的物质[27-28]. 因此, 在对细胞进行离体培养时需要对胎牛血清的浓度进行优化. 本研究在对银鲳脾脏和肾脏组织进行离体培养时对添加的胎牛血清设置了3个不同的浓度梯度, 通过对比细胞迁出数量和增殖速度发现, 当胎牛血清浓度为10%和15%时, 脾脏和肾脏组织迁出细胞少、细胞的增殖速度慢; 而当血清浓度提高到20%时, 脾脏和肾脏组织块边缘迁出大量细胞, 而且细胞生长最快、效果最好. 上述结果说明银鲳脾脏和肾脏组织细胞对胎牛血清浓度的依赖性较强, 高浓度胎牛血清能刺激细胞迁出及增殖.
脾脏和肾脏是鱼类重要的免疫器官[29], 其中脾脏主要由血细胞、内皮细胞、网状细胞、巨噬细胞和黑色素巨噬细胞组成, 而肾脏主要由处于不同成熟阶段的血细胞、内皮细胞以及具有排泄和内分泌功能的细胞组成[30-32]. 在鱼类的特异性和非特异性免疫中, 脾脏和肾脏发挥着不可替代的作用, 脾脏的免疫防御功能仅次于头肾[33]. 本研究在对银鲳脾脏组织进行离体培养时发现有贴壁性不强、细胞较小、呈明亮的球状细胞(图1(a)), 这种细胞与Muñoz等[34]在鲈鱼(L)的血细胞体外培养中发现的淋巴细胞形态非常接近. 通过体外细胞染色发现, 该类型细胞核质比较多, 符合淋巴细胞特征, 因此推测该细胞类型为淋巴细胞. 王文君等[35]在大泷六线鱼脾脏细胞体外培养研究中得到一种基质细胞, 该细胞贴壁性较强, 其形态交叉分布, 在汇合之前就生长在其他细胞上, 以多层网状结构存在, 这种细胞与图1(b)细胞形态特征非常相似. 另外, 它们在生长及迁移过程中无接触抑制现象, 能重叠生长, 与Diago等[36]在虹鳟()头肾基质细胞系TPS的生长相符, 由此推测图1(b)细胞为基质细胞. 图1(c)细胞贴壁性较强、细胞形态多样、形状不规则, 为多边形, 胞体呈扁平的棱形, 细胞中含有小颗粒, 这种细胞与Flaño等[37]在虹鳟脾脏培养物中发现的上皮样细胞和Diago等[36]在虹鳟头肾基质细胞系培养中发现的上皮样细胞形态特征极为相似, 所以推测图1(c)细胞为类上皮样细胞. 图1(d)细胞或并排排列, 或交叉排列, 呈现出成纤维细胞样, 这在虹鳟鱼脾脏组织细胞培养[37]中以及虹鳟鱼脾脏外植体构建具有网状内皮特征的细胞系[38]中都有观察到, 故推测为成纤维样细胞. 基质细胞的类型多种多样, 结构多层化, 更换培养基培养一段时间后, 圆形相的亮细胞松散附着在基质上, 通常它们以小簇的形式出现, 其中一些发展成巨大的团块或堆积成类似“小山”样的细胞. 当将其脱离基质细胞进行单独培养时, 发现其出现停止增殖的现象, 所以图1(e)细胞是依附基质细胞生存. 这与Ganassin等[39]在虹鳟鱼脾脏组织细胞培养过程中发现的造血灶类似, 故推测图1(e)细胞为造血灶. 此外, 在脾脏组织迁出细胞中观察到一种贴壁性较强的细胞, 该细胞颜色较深、细胞排列紧密, 呈现卵圆形、扁平状、扇形等多种形态. 目前, 在鱼类脾脏组织细胞培养相关的文献中尚未见到有关此类细胞的描述, 因此对图1(f)细胞类型的确认还需进一步研究. 在对银鲳肾脏组织培养过程中, 也出现了多种类型细胞, 包括巨噬细胞、成纤维样细胞和上皮样细胞等. 而随着培养时间的延长, 巨噬细胞、成纤维样细胞数量逐渐减少直至消失, 最终类上皮样细胞在培养物中成为优势细胞. 随着培养时间的延长以及传代次数的增加, 类上皮样细胞形态呈扁平状、细胞间隙增大、细胞密度降低, 同时细胞增殖缓慢. 许多研究表明[40-42], 细胞的增殖与细胞的密度密切相关, 来源不同的细胞拥有不同的特性, 有的细胞比较依赖于高密度才能生长. 赵晶等[43]在分离培养小鼠胚胎干细胞时提出细胞的接种密度能够影响细胞的增殖. 本研究发现, 银鲳肾脏组织来源类似上皮样细胞, 对细胞密度要求很高. 细胞密度太低时, 细胞增殖缓慢、间隙增大、铺层时间延长, 同时容易造成细胞衰老; 细胞密度过高时, 培养基营养成分不足, 细胞呈现纤细状, 甚至卷曲脱落. 所以, 银鲳肾脏组织迁出细胞的体外培养条件还有待进一步研究.
4 结语
本研究以银鲳的脾脏和肾脏组织为材料, 用组织块培养法成功进行了银鲳脾脏和肾脏组织细胞原代培养, 发现在培养温度为26℃时, 银鲳的脾脏和肾脏组织细胞在添加20%FBS的DMEM/ F-12培养基中生长速度最快, 细胞迁出种类较多, 其中脾脏组织共迁出6种类型细胞, 肾脏组织共迁出3种类型细胞, 这可为银鲳脾脏和肾脏组织细胞株和细胞系的建立提供参考.
[1] 许跃, 钱冬, 周素明, 等. 养殖银鲳虹彩病毒感染的组织病理学分析及分子检测[J]. 水产学报, 2020, 44(9): 1416-1423.
[2] 施兆鸿, 谢明媚, 彭士明, 等. 温度胁迫对银鲳()幼鱼消化酶活性及血清生化指标的影响[J]. 渔业科学进展, 2016, 37(5):30-37.
[3] 魏秀锦, 张波, 单秀娟, 等. 渤海银鲳的营养级及摄食习性[J]. 中国水产科学, 2019, 26(5):904-913.
[4] 杨程, 高权新, 张晨捷, 等. 饲料中添加南极磷虾粉对银鲳幼鱼生长、非特异性免疫及抗氧化功能的影响[J]. 海洋渔业, 2019, 41(2):224-233.
[5] 周剑光, 张林, 张晨捷, 等. 银鲳染色体核型研究[J]. 海洋渔业, 2018, 40(1):97-101.
[6] 施兆鸿, 赵峰, 王建钢, 等. 舟山渔场银鲳人工授精及孵化[J]. 渔业现代化, 2009, 36(1):18-21; 34.
[7] 唐旖, 蔡灵, 杨明. 细胞3D培养技术及其在水产养殖上的应用[J]. 渔业研究, 2020, 42(3):288-292.
[8] 于淼, 管华诗, 郭华荣, 等. 鱼类细胞培养及其应用[J]. 海洋科学, 2003, 27(3):4-8.
[9] Wolf K, Quimby M C. Established eurythermic line of fish cells[J]. Science, 1962, 135(3508):1065-1066.
[10] 王艺舟. 中华鲟五种组织细胞系建立及青鱼生殖细胞标记基因的鉴定[D]. 武汉: 华中农业大学, 2020.
[11] 王贤丽. 几种重要海水养殖鱼类细胞系的建立、诱导分化及其应用研究[D]. 青岛: 中国海洋大学, 2009.
[12] 马佳乐, 侯萍, 王思瑶, 等. 全氟辛酸诱导斑马鱼脾脏损伤及白细胞介素表达紊乱的免疫毒效应研究[J]. 环境科学学报, 2016, 36(7):2687-2693.
[13] 左文功, 钱华鑫, 许映芳, 等. 草鱼肾组织细胞系CIK的建立及其生物学特性[J]. 水产学报, 1986, 10(1):11-17.
[14] Ye H Q, Chen S L, Sha Z X, et al. Development and characterization of cell lines from heart, liver, spleen and head kidney of sea perch[J]. Journal of Fish Biology, 2006, 69:115-126.
[15] Huang X H, Huang Y H, Sun J J, et al. Characterization of two groupercell lines: Application to studies of Singapore grouper iridovirus (SGIV) propagation and virus-host interaction[J]. Aquaculture, 2009, 292(3/4):172-179.
[16] 徐进. 斑点叉尾鮰肾脏细胞系建立与出血病病原学研究[D]. 武汉: 华中农业大学, 2012.
[17] 单莉娟. 松江鲈()肾细胞系的建立及生物学特性分析[D]. 大连: 大连海洋大学, 2015.
[18] 郑在予, 杨金先, 陈秀霞, 等. 大黄鱼肾脏组织细胞系(YCK)的建立[J]. 福建农业学报, 2017, 32(10):1051-1056.
[19] 赵建青, 贾鹏, 刘文枝, 等. 罗非鱼肾脏细胞系的建立及其生物学特性[J]. 中国水产科学, 2019, 26(2):382-390.
[20] Chen S L, Sha Z X, Ye H Q. Establishment of a pluripotent embryonic cell line from sea perch () embryos[J]. Aquaculture, 2003, 218(1/2/3/4):141-151.
[21] 辛林伟, 魏凌云, 李强, 等. 培养基对兔骨髓间充质干细胞体外扩增的影响[J]. 山东大学学报(医学版), 2009, 47(10):50-53; 59.
[22] 曾汝君, 马亚仙, 张郡, 等. α-MEM培养基和高糖DMEM培养基对RAW264.7细胞向破骨细胞分化的影响[J]. 中国骨质疏松杂志, 2018, 24(6):745-749; 790.
[23] 龙舒婷, 罗鹏佗, 张永馨, 等. 鱼类细胞培养的方法、条件及应用研究概述[J]. 生物学教学, 2020, 45(9):4-5.
[24] Alvarez M C, Otis J, Amores A, et al. Short-term cell culture technique for obtaining chromosomes in marine and freshwater fish[J]. Journal of Fish Biology, 1991, 39(6):817-824.
[25] 李苗苗, 吴斌, 林楠, 等. 鳗鲡肾脏细胞系的建立及其对鳗鲡疱疹病毒的敏感性[J]. 水生生物学报, 2020, 44(2):237-244.
[26] Mauger P E, le Bail P Y, Labbé C. Cryobanking of fish somatic cells: Optimizations of fin explant culture and fin cell cryopreservation[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 144(1):29-37.
[27] 徐金辉, 秦绪祯, 张鸿程, 等. 无血清培养基和有血清培养基对背根神经节生长的差异[J]. 中国组织工程研究, 2021, 25(13):2043-2048.
[28] 代金彩, 聂竹兰, 赵年桦, 等. 塔里木裂腹鱼尾鳍细胞系的建立及盐碱度对其增殖的影响[J]. 渔业科学进展, 2021, 8(3):1-12.

[30] 季益平, 匡思雯, 袁子, 等. 银鲳脾脏和头肾的形态与组织学特征[J]. 宁波大学学报(理工版), 2020, 33(4):1-5.
[31] 卢致远. 甘露寡糖对生长中期草鱼生产性能、免疫器官健康的作用及其机制[D]. 雅安: 四川农业大学, 2018.
[32] 雷雪彬. 草鱼免疫器官个体发育的组织结构和免疫细胞变化[D]. 上海: 上海海洋大学, 2013.
[33] Dalmo R A, Ingebrigtsen K, Bøgwald J. Non-specific defence mechanisms in fish, with particular reference to the reticuloendothelial system (RES)[J]. Journal of Fish Diseases, 1997, 20(4):241-273.
[34] Muñoz J, Esteban M A, Meseguer J.culture requirements of sea bass (L.) blood cells: Differential adhesion and phase contrast microscopic study[J]. Fish & Shellfish Immunology, 1999, 9(5):417-428.
[35] 王文君, 张志峰, 汪岷, 等. 大泷六线鱼脾脏细胞体外培养的研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(8):93-97.
[36] Diago M L, López-Fierro M P, Razquin B, et al. Establishment and characterization of a pronephric stromal cell line (TPS) from rainbow trout,W[J]. Fish & Shellfish Immunology, 1995, 5(6): 441-457.
[37] Flaño E, López-Fierro P, Álvarez F, et al. Splenic cultures from rainbow trout,: Establishment and characterisation[J]. Fish & Shellfish Immunology, 1998, 8(8):589-606.
[38] Moritomo T, Anderson D P, Schill W B. Establishment of a cell line with reticulo-endothelial characteristics from a rainbow trout spleen explant[J]. Fish Pathology, 1990, 25(3):165-169.
[39] Ganassin R, Bols N. Development of long-term rainbow trout spleen cultures that are haemopoietic and produce dendritic cells[J]. Fish & Shellfish Immunology, 1996, 6(1):17-34.
[40] 张丰, 李青, 秦绪军, 等. 细胞密度与细胞增殖关系的初步分析[J]. 医学研究生学报, 2006(1):23-25; 33.
[41] Jorgensen P, Tyers M. How cells coordinate growth and division[J]. Current Biology, 2004, 14(23):R1014-R1027.
[42] Prehn R T. Many growth factors may not be growth factors[J]. Cancer Research, 1992, 52(3):501-507.
[43] 赵晶, 董雅娟, 柏学进, 等. 饲养层细胞的接种密度对分离培养胚胎干细胞的影响[J]. 中国兽医学报, 2009, 29(4):494-501.
The primary culture of cells from spleen and kidney tissues of
WANG Yan, SHU Fengling, CHEN Dongyue, WANG Yajun, XIE Jiasong, ZHOU Suming*
( School of Marine Sciences, Ningbo University, Ningbo 315832, China )
Tissues from spleen and kidney of the silver pomfret were collected for primary cell culture using tissue piece cultivation method, in order to study the primary cell cultured conditions. DMEM, M199 and DMEM/F-12 supplemented with different concentrations of fetal bovine serum (10%, 15% and 20% FBS) and antibiotics (penicillin, gentamicin) were applied to prevent bacterial contamination. The results showed that tissues in DMEM/F-12 with 20% FBS had the best cell adherence and fastest cell growth, based on cell attachment efficiency and growth rate. The immune cells, stromal cells, epithelioid cells, fibroblast-like cells, and hematopoietic foci were present in the spleen tissue cultures of silver pompano. Hematopoietic foci cells were observed on the stromal layer. In cell cultures of silver pomfret kidney, there were mainly three types of cells. These were the epithelioid cells, macrophages and fibroblast-like cells. The establishment of cell lines from spleen and kidney of silver pomfret would benefit the research on the functions of the fish spleen and kidney.
; spleen; kidney; cell culture
S917.4; Q246
A
1001-5132(2022)04-0009-06
2021−08−18.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
浙江省重点研发计划项目(2019C02059); 宁波市公益项目(202002N3043); 宁波市自然科学基金(2019A610426).
王燕(1995-), 女, 江苏连云港人, 在读硕士研究生, 主要研究方向: 鱼类疾病. E-mail: 2793747318@qq.com
通信作者:周素明(1981-), 女, 湖北枣阳人, 博士/讲师, 主要研究方向: 水产动物疾病防控及健康养殖. E-mail: zhousuming@nbu.edu.cn
(责任编辑 史小丽)

