茉莉酸甲酯处理对脐橙果实青霉病及防御酶活性的影响
王印宝,吴 帆,肖刘华,彭文文,陈 明,陈金印,2,向妙莲*
(1.江西农业大学 农学院/江西省果蔬采后处理关键技术与质量安全协同创新中心/江西省果蔬保鲜与无损检测重点实验室,江西 南昌 330045;2.萍乡学院,江西 萍乡 337055)
【研究意义】柑橘是世界上重要的栽培果树,我国是柑橘生产大国[1],但柑橘果实采后腐烂严重,每年采后腐烂率高达30%左右[2]。赣南脐橙是江西赣州国家地理标志产品,年产量达百万吨。由意大利青霉(Penicillium italicum)引起的青霉病是赣南脐橙果实采后腐烂的主要原因,给赣南脐橙产业造成巨大经济损失。目前主要通过化学杀菌剂控制该病害,但长期使用杀菌剂导致病原菌产生抗药性和果品农药残留,进而带来危及人体健康和环境污染等潜在问题。因此寻求安全高效、绿色环保的防治方法成为研究赣南脐橙采后贮藏保鲜的热点。【前人研究进展】植物诱导抗病性(induced resistance)因其抗病周期长、不污染环境等优点,为果蔬采后病害防治提供了一条新途径[3]。茉莉酸甲酯(Methyl jasmonate,MeJA)广泛存在于多种高等植物中,外源应用能够激发植物防御相关基因的表达,诱导寄主产生抗病性,已成为果蔬采后病害防治研究的重要研究对象。近年来研究者发现,MeJA 处理可以有效控制采后柑橘果实绿霉病[4]以及番茄[5]和葡萄灰霉病[6-7],诱导柠檬[8]和苹果[9]果实防御酶活性的增加。同时,MeJA 通过缓解活性氧积累,有效减轻葡萄[10]和甜瓜[11]等果实贮藏病害的发生,提高果实贮藏品质。此外,Cao 等[12]表明MeJA 可减少枇杷炭疽病的发生,与其提高枇杷果实中β-1,3-葡聚糖酶和几丁质酶活性紧密相关。【本研究切入点】目前有关MeJA 诱导脐橙果实抗青霉病的报道较少。本课题组在前期预试验中发现MeJA 在调控脐橙果实抗青霉病中发挥重要作用,但MeJA 诱导抗病与脐橙果实防御酶活性关系需进一步探索。【拟解决的关键问题】本研究拟以‘纽荷尔’脐橙为试验材料,采用MeJA 熏蒸处理后接种P.italicum,测定脐橙果实病斑直径及其过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)、超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)和病程相关蛋白酶活性以及丙二醛(malondialdehyde,MDA)含量变化,探讨MeJA 诱导脐橙果实抗青霉病的效应及生理机制,为脐橙果实采后病害控制提供理论参考依据。
1 材料和方法
1.1 供试材料
1.1.1 试验用果‘纽荷尔’脐橙果实,于2020 年11 月12 日采自江西省赣州市南康县龙回镇,次日运回实验室。选出大小均匀、成熟度一致并无病虫害和机械损伤的果实作为试验用果。先用自来水清洗,再用0.05%次氯酸钠溶液浸洗5 min,最后自来水冲洗干净。室温下晾干后保鲜袋单果套袋,入库备用(冷库温度5~6 ℃)。
1.1.2 病原菌 意大利青霉(P.italicum)由江西农业大学农学院植物病理实验室提供。P.italicum从典型脐橙发病果实中分离,用PDA 培养基进行单孢纯化培养。试验前于恒温箱(25±1 ℃)培养5~7 d,用无菌水洗脱孢子,经灭菌脱脂棉过滤后,配置浓度为1.25×106spores/mL孢子悬浮液,备用。
1.1.3 MeJA和水杨苷异羟肟酸 茉莉酸甲酯(methyl jasmonate)95%,购自Sigma公司。称量224.3 mg茉莉酸甲酯,先用少许二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,再逐滴加入0.1% Tween-80 使其混合均匀,最后溶解在无菌蒸馏水中,定容至100 mL,配制浓度10 mmol/L,于4 ℃保存,使用时稀释至所需浓度。水杨苷异羟肟酸(salicyhydroxamic acid,SHAM,茉莉酸生物合成抑制剂)购自Sigma 公司。称取1.516 mg纯度99%的SHAM,加入无菌蒸馏水并定容至100 mL,配制浓度为100 μmol/L,待用。
1.2 抑菌活性测定
采用牛津杯法测定MeJA 对青霉病菌(P.italicum)的抑制作用。取1.1.2中浓度为1.25×106spores/mL青霉孢子悬浮液6 mL,加入到54 mL温度约45 ℃左右PDA培养基中摇匀,均匀倒入3个无菌培养皿制成含青霉菌平板。待平板凝固后,在培养皿中心放置直径为7 mm的无菌牛津杯,依次取100 μL浓度为25,50,100,500,1 000 μmol/L、经0.22 μm细菌微孔滤膜过滤的MeJA溶液注入牛津杯中,每个处理重复3次,置于(25±1)℃恒温培养箱。采用十字交叉法逐日测量抑菌圈直径,对照组用含0.1%Tween-80等量无菌水。
1.3 MeJA诱导脐橙果实抗青霉病的效应
1.3.1 最佳诱导浓度筛选 取1.1.1 中脐橙果实于6 L 熏蒸盒中,中央放置灭菌培养皿,分别滴加95%MeJA原液34.4,68.8,137.6,688.0,1 376.0 μL,使熏蒸盒内MeJA浓度依次为25,50,100,500,1 000 μmol/L,20 ℃下熏蒸处理果实。另设100 μmol/L 的SHAM 喷施,对照用无菌蒸馏水,24 h后于超净工作台上通风1 h 后接种。用接种针在果实赤道部等距离刺伤,伤口大小为直径1 mm,深度3 mm。注入浓度为1.25×106spores/mL的P.italicum孢子悬浮液20 μL,逐日记录果实发病情况,每处理10个果实,3次重复。采用十字交叉法测量病斑直径,按以下公式计算诱导效果:

1.3.2 有效持续时间筛选 采用1.3.1中最佳浓度MeJA在20 ℃下分别熏蒸0,12,24,36,48 h,其它步骤同上。
1.4 酶活性测定
1.4.1 果实取样 接种前24 h 用50 μmol/L MeJA 于密闭熏蒸盒中熏蒸脐橙果实,另设100 μmol/L 的SHAM 喷施和无菌蒸馏水熏蒸。每处理20 个果实,3 次重复,方法同1.3.1。接种后0,12,24,36,48,60 h取病健交界处组织5 g,磨碎后液氮速冻,于-80 ℃冰箱保存待用。
1.4.2 过氧化物酶(POD)活性的测定 根据曹建康等[13]方法稍加改进,其活性单位为每克样品每分钟在吸光度470 nm处吸光度增加0.01。按该计算公式计算POD活性:U=(OD470*V)(/Vs*m)。
1.4.3 多酚氧化酶(PPO)活性的测定测定 PPO 采用邻苯二酚法其活性单位为在吸光度420 nm 条件下每克样品每分钟增加0.01。按该计算公式计算PPO活性:U=(ΔOD420*V)(/Vs*m)。
1.4.4 超氧化物歧化酶(SOD)活性测定 SOD 活性采用试剂盒(南京建成生物技术有限公司,南京,中国)测定;每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
1.4.5 抗坏血酸过氧化物酶(APX)活性测定 APX活性采用紫外比色法测定[13]。每克样品(FW)APX酶促反应体系在290 nm 处OD 值降低0.01 为1 个APX 活性单位,单位是ΔOD290/min·g。计算公式:U=(ΔOD290*V)(/0.01*Vs*W)。
1.4.6 过氧化氢酶(CAT)活性测定 CAT 活性参考李合生方法[14]稍加改进,在吸光度240 nm 处每30 秒记录一次数据,其活性单位为每克样品每分钟吸光度变化0.01。按该计算公式计算CAT 活性:U=(ΔOD240*V)(/0.01*Vs*W)。
1.4.7 丙二醛(MDA)含量的测定 MDA含量用硫代巴比妥酸(TBA)比色法[15]测定,计算公式为:MDA浓度(μmol/L)=6.45×(OD532-OD600)-0.56×OD450,求样品的MDA 浓度,MDA 含量=MDA 浓度×提取液体积/植物组织FW,MDA单位为μmol/g。
1.4.8 几丁质酶(CHI)的活性测定 CHI活性测定采用试剂盒(Solarbio,北京,中国)测定。
1.4.9 β-1,3葡聚糖酶(GLU)活性测定 GLU活性测定采用试剂盒(Solarbio,北京,中国)测定。
1.5 数据分析
采用Excel 2018软件对数据进行统计整理,并用SPSS 20.0和DPS 9.50软件对数据进行处理分析,用Duncan’s新复极差法来比较各处理间的差异显著性。
2 结果与分析
2.1 MeJA对P.italicum的抑菌活性
接种5 d后观察比较培养皿中央牛津杯周围抑菌圈大小。如图1所示,与对照相比,25,50,100,500,1 000 μmol/L MeJA处理对P.italicum生长均无直接抑制作用。

图1 不同浓度MeJA对P.italicum的抑菌效果Fig.1 Inhibition effect of different concentrations of MeJA on P.italicum
2.2 MeJA诱导脐橙果实抗青霉病的效应
2.2.1 MeJA 不同熏蒸浓度处理诱导脐橙果实抗青霉病效应 由图2可知,与对照相比,50 μmol/L MeJA熏蒸处理脐橙果实,接种后第8天病斑直径显著降低,诱导效果最佳,达20.87%。其它浓度100,25,200,500和1 000 μmol/L MeJA诱导效果依次为11.53%、8.20%、6.10%、4.60%和4.10%。

图2 MeJA不同熏蒸浓度处理下诱导脐橙果实抗青霉病效应Fig.2 Effect of MeJA under different fumigation concentration treatments inducing resistance to blue mold in navel orange fruits
2.2.2 50 μmol/L MeJA 不同熏蒸时间处理诱导脐橙果实抗青霉病效应 由图3可知,与对照相比,接种前脐橙果实经MeJA熏蒸处理24 h和36 h诱导效果较好。接种后第4~10天均高于熏蒸12 h和48 h,其中接种后第4 天,熏蒸24 h 和36 h 诱导效果最佳,为27.11%和26.68%,高于熏蒸12 h 和48 h 诱导效果11.52%和3.66%(P<0.05)。
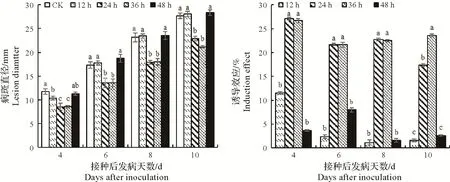
图3 MeJA不同熏蒸时间处理诱导脐橙果实抗青霉病效应Fig.3 Effects of MeJA under different fumigation concentrations inducing navel orange against blue mold
2.3 MeJA处理对脐橙果实防御酶活性和MDA含量的影响
2.3.1 MeJA 处理后脐橙果实防御酶活性的动态变化 如图4A 所示,MeJA 处理脐橙果实POD 活性随时间增加先升高后下降,且始终高于对照组。接种24 h后,MeJA 处理组POD活性开始达到峰值,依次高于对照组和SHAM处理组12.58%和45.3%(P<0.05)。PPO活性如图4B所示,接种36 h内MeJA处理组活性始终高于对照组和SHAM 处理组,接种后0~12 h,MeJA 处理组活性显著高于对照组和SHAM 处理组,分别为对照组和SHAM 处理组的2.64和2.09倍(P<0.05)。MeJA 处理后脐橙果实SOD 活性变化见图4C,接种24 h 后SOD 活性最强,显著高于对照组和处理组,在48 h,MeJA 处理组SOD 活性依次高于对照组和SHAM 处理组22.86%和87.25%。APX活性如图4D所示,MeJA 处理组始终高于对照组和SHAM 处理组,在接种60 h,MeJA 处理组APX 活性达到峰值,分别高于对照组和SHAM 处理组44.03%和58.03%,差异显著(P<0.05)。从图4E中可知,MeJA处理组的CAT酶活性始终高于对照组和SHAM处理组,接种后36 h达到峰值,分别为对照组和SHAM处理组CAT酶活性的1.13和1.22倍。

图4 MeJA处理对脐橙果实POD、PPO、SOD、APX和CAT活性的影响Fig.4 Effect of MeJA treatment on POD,PPO,SOD,APX and CAT activities in navel orange fruits
2.3.2 MeJA处理后脐橙果实MDA含量的动态变化 MDA含量如图5 所示,MeJA 处理组MDA 含量在0~36 h 高于处理组;接种后60 h,MeJA组MDA含量依次低于SHAM组和对照组29.3%和35.1%。
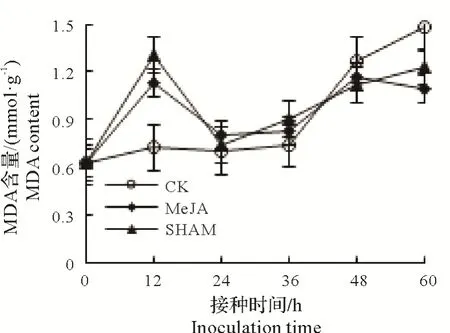
图5 MeJA处理对脐橙果实MDA含量的影响Fig.5 Effect of MeJA treatment on MDA contents of navel orange fruits
2.3.3 MeJA处理后脐橙果实病程相关蛋白活性的动态变化如图6A 所示,接种60 h内脐橙果实MeJA 处理组CHI活性高于对照组和SHAM 处理组。接种后0~48 h后MeJA处理组CHI活性均显著高于对照组和SHAM 处理组,其中接种后12 h CHI活性最高为0.89 U/g(P<0.05)。GLU 活性变化如图6B 所示,MeJA 处理组GLU 活性在24~60 h 内始终维持较高水平,接种后48 h 达到峰值,分别为对照组和SHAM处理组的1.28和1.53倍,差异显著(P<0.05)。

图6 MeJA处理对脐橙果实CHI和GLU活性的影响Fig.6 Effect of MeJA treatment on CHI(A)and GLU(B)activities in navel orange fruits
3 讨论与结论
诱导抗病是植物在自然生长环境中受到外界诱导因子刺激后,抵御病原侵染及逆境胁迫时自身发展出的一种抗病机制[16]。MeJA广泛存在于植物体中,作为诱导植物抗病性的重要外源信号物质,其作用可将植物信号传递到逆境环境中,提高植物抗逆反应[17]。本试验抑菌活性测定发现25~1 000 μmol/L Me-JA对青霉病菌(P.italicum)均无直接抑制作用,而在接种前采用MeJA熏蒸处理脐橙果实12~48 h后可减小青霉病斑直径。说明外源MeJA 减轻脐橙果实釆后青霉病可能是通过诱导提高果实自身的免疫反应而非直接抑菌作用。其中,50 μmol/L MeJA 熏蒸处理脐橙果实24 h能显著抑制青霉病斑扩展,诱导效果最佳为27.11%。该结果与MeJA 诱导辣椒抗青枯病[18]、水稻抗细菌条斑病[19]以及红小豆抗锈病[20]等研究结果类似。而盘柳依等[21]发现用10.0 mmol/L MeJA 对采后猕猴桃软腐病菌的抑菌率达100%,且在果实接种前用0.1 mmol/L MeJA熏蒸处理24 h诱导效果达26.85%;王英珍等[22]研究表明梨黑斑病菌在5 mmol/L和7 mmol/LMeJA 的PDA 培养基中菌落直径相比对照分别减少了62.9%和91.0%。由此推测MeJA 对病原菌的抑菌活性可能因处理浓度、处理方法和病原物种类不同而各异。
当病原菌侵染寄主植物时,其寄主体内POD可催化木质素前体的生成,促进木质素积累。而PPO则可将植物体内的酚氧化成醌,直接抑制病原菌生长。另有研究表明,SOD 活性变化可作为果实成熟衰老的重要指标,能有效清除植物体内的活性氧、维持活性氧平衡[23];APX 通过AsA-GSH 循环分解并清除细胞中产生的过量H2O2[24];CAT 是生物体内一种重要的抗氧化酶,可将H2O2分解为H2O 和O2[25]。外源MeJA可诱导上述防御酶活性提高,增强寄主植物防御病原菌侵染的能力[26]。本试验结果表明,MeJA处理提高了脐橙果实防御酶POD、PPO、APX 和CAT 的活性,该结论与MeJA 诱导辣椒抗青枯病[21]、水稻抗白叶枯病[27]和蓝莓抗灰霉病[28]结果类似。本试验中MeJA 处理组PPO 活性变化整体呈先上升后下降的趋势,其结果印证了许晴晴等[29]用MeJA处理蓝莓后PPO活性的变化规律。这可能因脐橙细胞遭到活性氧的攻击,PPO与作用底物接触发生反应活性开始升高,随着病原菌进一步侵染使果实衰老而活性下降;而MeJA处理组SOD 活性则先降后上升再下降,与余朝阁等[30]发现茉莉酸甲酯诱导番茄抗灰霉病试验SOD 活性变化类似。上述酶活性变化趋势各异可能与SHAM 和MeJA 预处理后接种柑橘青霉病菌,外源物质-寄主-病原三者之间互作关系错综复杂,在部分时间点上不同防御酶对诱导效应的作用不同有关。
MDA是膜脂质过氧化的重要产物,其含量可以直接反映对植物细胞膜的破坏程度,是寄主抗病能力的重要指标[31]。本试验MeJA 处理后脐橙果实中MDA 含量在0~36 h 高于对照组,48~60 h 其积累受到了抑制,该结果与王瀚博[32]用MeJA 处理蓝莓试验中MDA 含量变化趋势类似,其可能原因为SHAM、MeJA和柑橘果实以及青霉病菌互作过程中MDA等物质积累,MeJA对柑橘果实的正调控效应在后期表现更明显。当寄主遭受病原物或不良环境胁迫时,可产生一类特异性蛋白GLU 和CHI,这两种病程相关蛋白在寄主抗病反应中发挥重要作用[33]。本试验脐橙果实经MeJA 处理后,其病程相关蛋白CHI和GLU 活性相比对照和SHAM 处理有显著提高,脐橙果实对青霉病原菌的抗性增强。这一结果与MeJA 诱导甜樱桃抗青霉病[34]和猕猴桃抗软腐病[35]结论一致,说明MeJA 诱导脐橙果实抗青霉病可能与提高果实内病程相关蛋白活性有关。
综上所述,25~1 000 μmol/L MeJA 对脐橙青霉病菌无直接抑制作用,但熏蒸处理后均可提高果实对青霉病的抗性。MeJA 诱导脐橙果实抗青霉病可能通过激发脐橙果实防御酶(POD、PPO、APX 和CAT)以及病程相关蛋白(CHI和GLU)活性,降低MDA含量,延缓膜脂过氧化,从而减缓脐橙果实青霉病的发生,有关MeJA诱导脐橙果实抗青霉病的分子机制有待后续研究进一步探索。
致谢:江西省果蔬采后处理关键技术及质量安全协同创新中心项目(JXGS-03)对本研究给予了资助,谨致谢意!

