叶面及根际施用外源NO对盐胁迫下中华常春藤生理特性的影响
张 敏,李 燕,宁 朋,程小毛,黄晓霞
(西南林业大学 园林园艺学院/国家林业和草原局西南风景园林工程技术研究中心,云南 昆明 650224)
【研究意义】土壤盐渍化是限制植物生长发育的重要非生物胁迫之一,据统计,中国盐渍土总面积约为3.6×107hm2,占全国总可用土地面积的4.88%[1-2],由于不合理灌溉、过度施肥等因素的影响,盐渍土面积还在进一步扩大,已严重影响植物生存环境,干扰植物正常生长发育等过程[3]。因此,研究植物耐盐机制,采取合理措施提高植物耐盐性,开发利用盐渍土是亟待解决的问题。【前人研究进展】一氧化氮(nitric oxide,NO)是植物体细胞内可自由扩散的信号分子,参与植物生长发育和响应非生物胁迫等过程。研究表明,外施NO供体硝普钠(sodium nitroprusside,SNP),对缓解植物在非生物胁迫中遭受的毒害作用有一定的效果:铝胁迫下,根部浇灌SNP参与植株光能分配,提高了西瓜(Citrullus lanatus)叶绿素含量和光合能力[4];干旱胁迫下,叶面喷施SNP有效缓解了小麦(Triticum aestivum)幼苗的氧化损伤[5];镉胁迫下,叶面喷施SNP能促进花生(Arachis hypogaea)生长,提高光合色素含量,增强抗氧化酶系统的调节作用[6];盐胁迫下,根部浇灌SNP 可使山葡萄(Vitis amurensis)PSII 反应中心活性维持在较高水平[7]。前人研究表明SNP 既可根部施用,也可叶面喷施,对植物的抗逆性均起到了一定的提高作用,但何种施用方式缓解效果更佳,植物对NO 信号的感知方式以及运输途径等还需更深入的研究。【本研究的切入点】中华常春藤(Hedera nepalensisvar.sinensis)为五加科常春藤属常绿藤本,常攀援于假山、岩石以及房屋墙壁。因其枝蔓茂密、姿态优雅,管理简单,适应性强,被广泛运用于园林绿化和城市建设中[8]。目前关于中华常春藤的研究主要集中在景观应用和病理研究,对外源物质调控其耐盐性方面鲜有报道。【拟解决的关键问题】通过对植株进行盐胁迫处理、外施SNP 处理,探讨叶面和根际施用SNP 缓解盐胁迫伤害中华常春藤的效果,以期提高植株耐盐性及为盐渍化地区植被恢复的选择提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为西南林业大学校园内中华常春藤水培苗。供试试剂为NaCl 溶液和外源一氧化氮(NO)供体硝普钠(SNP,C5H4FeN6Na2O3)。
1.2 试验设计
试验在西南林业大学主教7 楼阳光温室内进行。于2020 年8 月在校园内剪取一年生半木质化中华常春藤枝条,清水培养两个月,生根后移栽至底部直径10 cm、高15 cm的培养瓶中,并对其进行根部遮光处理。选择健康且长势一致的苗木作为处理材料,用不含琼脂和蔗糖的DKW 培养基[9]进行水培。盐胁迫用相应浓度NaCl 配置于水培液;通过预实验处理,确定SNP 浓度为0.1 mmol/L,对植株进行叶面及根际施用。如表1所示,试验共设置7个处理组。每处理组5个重复,每瓶3株,处理期间,每两天更换1次培养液。SNP 叶面喷施,施用量为喷施叶面刚好有水珠掉下来(每瓶约10 mL),每天清晨喷施1 次,不喷施组用等量清水作为对照处理;SNP根际施用,以相应浓度配置于水培液。试验共处理15 d,处理结束后进行各项生理指标的测定。

表1 试验设计Tab.1 Experimental design
1.3 测定项目与方法
1.3.1 光合气体交换参数的测定 每处理组选择5 株植株的成熟叶片于晴朗天气的09:00—11:00 进行。用LI-6400 光合作用仪的标准叶室对植株叶片进行最大净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(C)i和蒸腾速率(Tr)的测定。测定时,对仪器进行校准调零,设置温度为24 ℃,CO2浓度为400 μmol/mol,光强为1 000 μmol(/m2·s),相对湿度为55%。
1.3.2 叶绿素荧光参数的测定 于20:30 暗适应30 min 后,采用PAM-2100(WALZ)调制式叶绿素荧光仪测定叶片叶绿素荧光参数[10]。
1.3.3 可溶性物质指标的测定 可溶性蛋白含量测定采用考马斯亮蓝法;脯氨酸含量测定采用茚三酮比色法;可溶性糖含量测定采用蒽酮比色法;淀粉含量测定参照Zhao等[11]的方法。
1.3.4 其他生理指标的测定 选择成熟叶片,用乙醇浸提法测叶绿素和类胡萝卜素含量[12];过氧化氢酶(CAT)活性测定参照Beers 等[13]的方法;过氧化物酶(POD)活性测定参照Lin 等[14]的方法;抗坏血酸过氧化物酶(APX)活性测定方法参照Yoshiyuki 等[15];超氧化物歧化酶(SOD)活性测定方法参照Huang 等[16];丙二醛(MDA)含量测定参照Dhindsa等[17]的方法。
1.4 数据分析
运用SPSS 19.0 和Origin 2017 软件对本实验所有数据进行分析和绘图,图表中数据值为均值±标准误,P<0.05表差异显著。
2 结果与分析
2.1 叶面及根际施用外源NO对盐胁迫下中华常春藤光合色素的影响
表2 显示,随着盐浓度的增加,中华常春藤叶绿素和类胡萝卜素含量均呈下降趋势,到300 mmol/L NaCl 处理下降到最低值,与CK 相比,分别降低了77%和75%。不同程度盐胁迫下叶面喷施SNP 均显著提高了叶绿素含量,且以100 mmol/L 盐浓度下叶面喷施SNP 处理增幅更为显著,相比100 mmol/L 盐处理,增加了78.9%;而根际施用SNP叶绿素含量虽有所上升,但均未达到显著水平。

表2 叶面及根际施用外源NO对盐胁迫下中华常春藤光合色素含量的影响Tab.2 Effects of applying exogenous NO with foliar and rhizosphere methods on photosynthetic pigment contents of Hedera nepalensis var. sinensis under salt stress
2.2 叶面及根际施用外源NO对盐胁迫下中华常春藤光合特性的影响
从图1 可知,随着盐胁迫程度加重中华常春藤Pn、Gs、Tr逐渐降低,且在300 mmol/L NaCl 处理下达到最低值,与CK 相比,分别降低了89%、62%和48%。而Ci随着盐胁迫浓度的增加而显著上升,与CK 相比,低和高浓度盐处理下分别上升了8%和21%。此外,盐胁迫下SNP 的不同施用方式均能降低植株叶片Ci值,增加Pn值,但各处理组间差异不显著,且盐与SNP交互作用对植株光合特性影响并不显著。
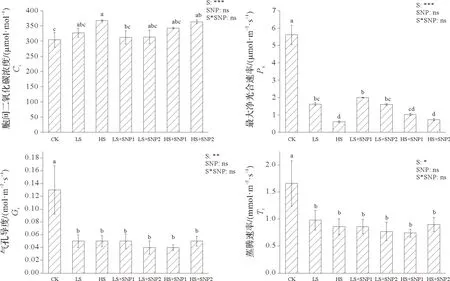
图1 叶面及根际施用外源NO对盐胁迫下中华常春藤光合特性的影响Fig.1 Effects of applying exogenous NO with foliar and rhizosphere methods on photosynthetic characteristics of Hedera nepalensis var.sinensis under salt stress
2.3 叶面及根际施用外源NO对盐胁迫下中华常春藤叶片荧光参数的影响
由表3 可知,中华常春藤叶片初始荧光(F0)在盐胁迫下逐渐上升,相较于CK,低和高浓度盐处理下分别上升了33%和58%。外施SNP有效抑制了F0的增加,且以叶面喷施抑制最为显著。此外,植株叶片最大荧光(Fm)、最大光化学量子产量(Fv/Fm)、实际光化学量子产量(Y(II))、非光化学淬灭系数(NPQ)、光化学淬灭系数(qp)、电子传递速率(ETR),均在300 mmol/L NaCl处理下降至最低值,与CK相比,分别降低了57%、49%、59%、66%、31%和59%,而外施SNP 能不同程度提高上述参数的值,且不论是低盐胁迫还是高盐胁迫下,均以叶面喷施SNP组变化更为显著。

表3 叶面及根际施用外源NO对盐胁迫下中华常春藤叶片荧光参数的影响Tab.3 Effects of applying exogenous NO with foliar and rhizosphere methods on chlorophyll fluorescence parameters of Hedera nepalensis var. sinensis under salt stress
2.4 叶面及根际施用外源NO对盐胁迫下中华常春藤抗氧化酶活性的影响
由图2可知,中华常春藤CAT、APX、POD活性均随着盐胁迫程度的加重而显著上升,且在300 mmol/L NaCl处理下达到巅峰值,分别是CK的3.0倍、3.4倍、5.8倍。盐胁迫下施加SNP进一步提高了CAT、APX、POD 活性,低盐浓度下叶面喷施和根际施用SNP组提升上述酶活性的水平相当,而高盐浓度下叶面喷施SNP组更能促进上述酶活性的提升。在300 mmol/L NaCl处理下,叶面喷施SNP组比未施用组植株CAT、APX、POD活性分别上升了36%、49%和70%。此外,无论是盐胁迫还是外施SNP处理,SOD活性与CK相比虽有上升,但均未达到显著水平。

图2 叶面及根际施用外源NO对盐胁迫下中华常春藤抗氧化酶活性的影响Fig.2 Effects of applying exogenous NO with foliar and rhizosphere methods on antioxidant enzyme activities of Hedera nepalensis var.sinensis under salt stress
2.5 叶面及根际施用外源NO对盐胁迫下中华常春藤丙二醛含量的影响
由图3 可知,低盐和高盐处理下MDA 含量相较于CK,显著上升了46%和88%。低盐胁迫下施加SNP虽使得MDA含量下降,但差异并不显著;而高盐胁迫下外施SNP能有效抑制MDA含量的上升,且叶面喷施和根际施用SNP组比未施用组分别降低了30%和16%。
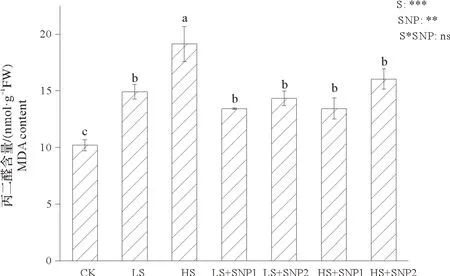
图3 叶面及根际施用外源NO对盐胁迫下中华常春藤丙二醛含量的影响Fig.3 Effects of applying exogenous NO with foliar and rhizosphere methods on MDA content of Hedera nepalensis var.sinensis under salt stress
2.6 叶面及根际施用NO对盐胁迫下中华常春藤可溶性物质含量的影响
由表4 可知,中华常春藤可溶性蛋白、脯氨酸、可溶性糖和淀粉含量在300 mmol/L NaCl 处理下达最大值,与CK 相比,分别增加了1.0 倍、1.4 倍、2.6 倍和0.9 倍。盐胁迫下外施SNP 提高了可溶性蛋白、脯氨酸、可溶性糖和淀粉含量,在100 mmol/L NaCl 处理下,叶面喷施和根际施用SNP 组比未施用组分别上升了23%/8%、41%/32%、69%/8%、36%/27%。在300 mmol/L NaCl 处理下,叶面喷施SNP 组比未施用组分别上升了13%、116%、31%、40%;而根际施用SNP 仅脯氨酸上升了25%,其他指标并无显著变化。

表4 叶面及根际施用外源NO对盐胁迫下中华常春藤可溶性物质含量的影响Tab.4 Effects of applying exogenous NO with foliar and rhizosphere methods on soluble substance contents of Hedera nepalensis var. sinensis under salt stress
3 讨论与结论
光合作用是植物获得能量和物质的来源,光合色素是光合作用的基础[18]。盐胁迫下,植物叶片类囊体膜结构遭到破坏,叶片光合色素含量降低,光合作用能力减弱[19],前人研究表明外施SNP可以缓解叶片叶绿素的分解,提高植株耐盐性[20-21]。本研究结果显示:光合色素含量在盐胁迫下显著降低,外施SNP后显著上升,这可能是因为SNP刺激了植株叶片叶绿素合成酶的活性,促进了类囊体膜蛋白复合体的稳定性,从而保护光合机构,提高光合色素含量[22],而低盐胁迫对植株叶片损伤较小,因此SNP 施用的缓解效果更为显著。植物光合作用也受Ci、Pn、Gs、Tr等因素的影响。本研究结果显示:盐胁迫下Pn显著下降,Ci却显著上升,外施SNP 对Pn、Ci并无显著影响。这一结果与杨妮等[23]在茶树(Camellia sinensis)的研究中“盐胁迫下施用外源亚精胺显著提高了植株叶片Pn、Gs、Tr的值”不同。这可能是因为盐胁迫抑制了叶肉细胞内的气体扩散,造成外源NO与受体结合受阻,CO2溶解度降低,导致光合稳定性降低,净光合速率变化不显著[24]。
叶绿素荧光参数的变化可以反映光合机构的状况,因此,叶绿素荧光被称为植物光合作用的探针。本研究结果显示:盐胁迫显著抑制了Fm、Fv/Fm、Y(II)、ETR的上升,促进了F0的上升,这可能是因为盐胁迫导致光能的吸收、传递和转换能力减弱,电子传递速率下降,ATP 和NADPH 合成受阻,光合作用受抑。盐胁迫下施加SNP 显著增加了Fv/Fm、Y(II)、ETR,这可能是因为外源NO 通过增加分配给碳和氮同化的光能来缓解盐胁迫带来的光抑制,这说明外源NO 间接地参与了植株光合作用过程,有利于维持PSII 反应中心的活性,提高光合作用能力,提高碳同化量[25]。同时,本研究结果亦显示:外施SNP 促进了qp和NPQ的上升,这说明盐胁迫抑制了植株叶片PSII 反应中心电子传递活性,植株光保护能力机制失效,而NO 作为一种信号分子显著提高了PSII 反应中心的活性,有利于光合作用同化物质的积累。这与杨美森等[26]对棉花(Gossypium hirsutum)幼苗的研究中指出“冷害胁迫显著降低了qp和NPQ,低温已导致PSII 反应中心遭到不可逆的损伤,而外源NO 避免了过量的光损伤,维持较高的PSII 反应中心的活性”的结果相似。
研究表明,盐胁迫下,植株体内活性氧水平升高,细胞膜损伤加重,导致植株遭受氧化胁迫,而添加适量浓度SNP 能够缓解过氧化反应对植株造成的伤害[27-28]。本研究结果显示:不同程度盐胁迫下施加SNP 均促进了抗氧化酶活性的增加,抑制了MDA 含量上升,这可能是因为NO 可直接与血红素铁结合,调节抗氧化酶活性,也可作为活性氧清除剂,直接清除ROS,或作为抗氧化系统诱导剂,诱导体内抗氧化酶活性的升高,来增强植株对盐胁迫的抗性[29]。此外,本实验中,SOD 活性在不同处理下均无显著变化,这可能是因为植株本身的SOD活性水平较高,在一定盐浓度内增长并不显著,也可能是因为植株对本实验下的盐浓度具有一定的耐性,SOD不作为主要的抗氧化酶。
研究表明盐胁迫会造成植物膜组分、透性及离子运输变化,使膜结构和功能受到伤害,对植物产生渗透胁迫,而外施SNP有利于渗透调节物质的积累,从而缓解盐害[30-31]。本研究结果显示:植株叶片可溶性物质含量在盐胁迫下显著上升,这可能是中华常春藤适应盐胁迫的一种方式,以此来调节细胞渗透势,维持细胞保水能力,提高植株抗盐性。施用SNP 后,其含量进一步上升,推测原因可能是NO 通过Na+/H+逆向转运蛋白转录来减少Na+的积累、增加K+/Na+比率,从而维持离子平衡,促进脯氨酸等可溶性物质的积累来缓解植株所遭受的盐胁迫[32]。
本研究结果亦显示:叶面喷施比根际施用SNP对中华常春藤受盐胁迫伤害的缓解效果更为显著,推测原因可能为叶面喷施SNP可通过叶片气孔进入保卫细胞,直接与胞内受体结合响应盐胁迫,而根际施用SNP 可能首先与植株根部的生长素等内源激素协同作用或通过激活丝裂原活化蛋白激酶(MAPK)参与根系调控[33],再与叶片受体结合其含量就相对较少,从而导致其效果相较于叶面喷施较差。但叶面喷施和根际施用SNP对植株抗盐性效果差异的作用机制还有待更深入的研究。
综上所述,盐胁迫显著抑制了中华常春藤的生理特性,而外源NO可以通过提高光合色素含量,增加光能吸收和传递效率,从而提高光合能力,缓解盐对植株的光合损伤;还可以通过提高抗氧化酶活性,清除活性氧,降低MDA 含量,保护植株免受氧化损伤;此外,NO 还能诱导可溶性物质的积累,降低细胞内的渗透势,维持膜内外离子平衡,减轻盐胁迫对膜结构的破坏,提高植株耐盐性,且相较于根际施用,叶面喷施的效果更好。

