6′′′-阿魏酰斯皮诺素对Aβ1-42 诱导损伤的SH-SY5Y 细胞保护作用研究
张 妹,张彦青, ,解军波 ,王 轻,戚务勤
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津中医药大学中药学院,天津 301617)
酸枣仁为鼠李科植物酸枣(Ziziphus jujubaMill.var.Spinosa(Bunge)Hu ex H.F.Chou)的干燥成熟种子,其作为卫生部颁布的第一批药食两用资源,具有温和、依赖性低、可长期服用等优点,是当前研究的热门品种。酸枣仁具有悠久的应用历史,是中医治疗失眠多梦的首选药物[1]。由于现代药理学研究的逐渐完善,酸枣仁的活性功能被进一步挖掘,现代研究证明酸枣仁具镇静催眠、抗焦虑、降血糖、降血脂、增强免疫等多种药理活性。黄酮类成分被认为是酸枣仁发挥药理活性的主要物质基础之一,目前,已经从酸枣仁中分离得到二十余种黄酮类单体,6′′′-阿魏酰斯皮诺素(6′′-Feruloylspinosin,6-FS)是酸枣仁主要的黄酮类成分之一,不同产区酸枣仁中6′′′-阿魏酰斯皮诺素含量约为0.26~0.88 mg/g[2−3]。近年多项研究表明该黄酮在神经功能调节方面表现出显著的生物活性[4−5],但其具体作用机制尚待进一步揭示。
由于现代生活压力及全球人口老龄化的日益加剧,阿尔兹海默症(Alzheimer's disease,AD)等神经退行性疾病,已经成为人类面临的最大公共健康挑战之一。截至2015 年,全世界4680 万人患有阿尔茨海默症(中国占有相当大的比重,约1/4)[6],预计2050年这一数字将达到1.52 亿。AD 的发生与β淀粉样蛋白(Amyloidβ,Aβ)的沉积密切相关,Aβ在脑内沉积形成的不溶性斑块可诱导神经元线粒体损伤,导致氧自由基大量积聚,进一步攻击核酸、蛋白质等生物大分子物质,最终导致大量神经元凋亡,损害大脑功能[7]。传统天然药物富含多样生物活性化合物,可以多环节、多靶点发挥神经保护作用,并且部分传统天然药物具有药食同源性,安全性高,已成为调节神经功能最为有效的手段之一[8−9]。本研究利用Aβ1-42诱导SH-SY5Y 细胞损伤,并给予酸枣仁黄酮类成分6′′′-阿魏酰斯皮诺素进行干预,从细胞活力、细胞氧化应激情况以及细胞线粒体状态等多角度探讨6′′′-阿魏酰斯皮诺素对Aβ1-42诱导损伤的SH-SY5Y细胞的保护作用及相关机制,为酸枣仁的应用与防治AD 药物的开发提供研究基础。
1 材料与方法
1.1 材料与仪器
人神经母细胞瘤细胞株(SH-SY5Y) 南开大学惠赠;6′′′-阿魏酰斯皮诺素 成都德锐可生物科技有限公司(货号:drk1727,纯度:≥98%);Aβ1-42上海吉尔生化有限公司(货号:SJ053487,纯度:≥95%);六氟异丙醇 北京天根生化科技有限公司;CCK-8 细胞增殖检测试剂盒 Biosharp 白鲨生物公司;活细胞/死细胞双染试剂盒(Calcein-AM/PI) 北京北奥莱博科技公司;B 细胞淋巴瘤/白血病-2 蛋白(Bcell lymphoma/leukemia-2,Bcl-2)、Bcl-2 关联死亡启动子重组蛋白(Bcl-xL/Bcl-2 associated death promoter,Bad)、β-肌动蛋白(Beta Actin,β-Actin)抗体abcam 公司;BCA 蛋白浓度测定试剂盒、蛋白提取试剂盒 北京索莱宝生物科技有限公司;活性氧(Reactive Oxygen Species,ROS)检测试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活力检测试剂盒、丙二醛(Malonic dialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;线粒体膜电位(mitochondrial membrane potential,MMP)水平检测试剂盒 碧云天生物技术研究所。
BP211D 电子分析天平 Sartorius AG;HNY2102恒温培养箱 天津市欧诺仪器仪表有限公司;TI-DH 600352 倒置荧光显微镜 日本尼康;SpectraMax®M3 多功能酶标仪 Molecular;PowerPac TMHC 蛋白电泳仪 Bio-rad。
1.2 实验方法
1.2.1 细胞培养及细胞给药方式 SH-SY5Y 细胞培养于含10%胎牛血清的培养基中,培养条件为37 ℃、5% CO2,细胞密度为70%~80%时进行传代。选取对数生长期细胞进行实验,细胞培养过夜后,给予含6′′′-阿魏酰斯皮诺素的培养基预处理2 h,再加入Aβ1-42寡聚体共同孵育24 h。
1.2.2 CCK-8 法检测细胞活力 按照文献介绍[10]的方法制备Aβ1-42寡聚体,细胞接种于96 孔板中。首先分析Aβ1-42对细胞活力的影响,培养过夜后,在含有Aβ1-42(0、0.1、0.5、1、5 和10 μmol/L)的培养基中培养24 h,结束后吸弃培养基,每孔加入100 μL CCK-8 工作液(10 μL CCK-8 溶液+90 μL DMEM),孵育4 h 后测定450 nm 处吸光度值,根据吸光值读数选择Aβ1-42的给药剂量。其次,分析6′′′-阿魏酰斯皮诺素对Aβ1-42诱导损伤的细胞活力的影响,细胞培养过夜后,首先利用含有不同浓度(1、5、10、20和40 μmol/L)6′′′-阿魏酰斯皮诺素的培养基预处理2 h 后,加入Aβ1-42共同培养24 h。只给予Aβ1-42,未给予6′′′-阿魏酰斯皮诺素的细胞为模型组细胞。细胞给药培养结束后,按照上述方法测定不同处理组细胞吸光度值。其中,OD对照是指具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度读数;OD空白是指没有细胞存在,单独具有培养基和 CCK-8 溶液的孔的吸光度读数。

1.2.3 AM/PI 染色法观察细胞形态 取对数生长期的SH-SY5Y 细胞接种于12 孔板中,分为以下5 组:对照组、Aβ1-42模型组(5 μmol/L)、6′′-阿魏酰斯皮诺素低剂量组(6′′′-阿魏酰斯皮诺素5 μmol/L+Aβ1-425 μmol/L)、6′′′-阿魏酰斯皮诺素中剂量组(6′′′-阿魏酰斯皮诺素10 μmol/L+Aβ1-425 μmol/L)及6′′′-阿魏酰斯皮诺素高剂量组(6′′′-阿魏酰斯皮诺素20 μmol/L+Aβ1-425 μmol/L)每组设置三个复孔。采用Calcein-AM/PI 双染法观察细胞形态,细胞培养结束后,加入Calcein-AM/PI 染色工作液避光孵育细胞(37 ℃,30 min)。使用荧光倒置显微镜在(490±10)nm 激发波长下观察活细胞与死细胞,另用545 nm 激发波长单独观察死细胞。
1.2.4 SH-SY5Y 细胞内ROS 水平测定 细胞培养及给药方式如1.2.3,培养结束后,加入DCFH-DA 活性氧染色工作液孵育细胞(37 ℃,50 min),孵育结束后加入DMEM 洗涤。用酶标仪测定激发波长502 nm,发射波长为530 nm 处的荧光强度值并利用荧光倒置显微镜进行观察。
1.2.5 SH-SY5Y 细胞内MDA 水平、GSH-Px 酶活力及线粒体膜电位水平测定 细胞培养及给药方式如1.2.3,培养结束后,依据试剂盒说明书介绍的方法收集及处理细胞,并测定细胞内MDA 水平及GSHPx 酶活力。用JC-1 法测定细胞线粒体膜电位,在细胞培养结束后加入JC-1 染色工作液孵育细胞(37 ℃,30 min),用酶标仪测定激发波长490 nm,发射波长为520 nm 及570 nm 处的荧光强度值并利用荧光倒置显微镜进行观察。
1.2.6 Western blot 分析 依据试剂盒说明书介绍的方法进行蛋白提取及浓度测定。SDS-PAGE 电泳分离蛋白后将其转至PVDF 膜上,用5%脱脂牛奶封闭处理1 h。添加一抗4 ℃孵育过夜,TBST 缓冲液洗净后,加入二抗4 ℃孵育2 h 后用TBST 缓冲液洗净。ECL 曝光显影,以β-actin 作为内参,利用Image J 软件对各个条带灰度值进行分析。
1.3 数据处理
使用Image J 软件对图片中荧光强度及条带灰度值进行分析,使用GraphPad Prism 8.0.2 进行统计分析,并通过t检验比较各组数据。实验数据以平均值±标准差()表示,与对照组比较:*P<0.05,有差异;**P<0.01,差异显著;***P<0.001,差异极显著,与模型组比较:#P<0.05,有差异,##P<0.01,差异显著,###P<0.001,差异极显著,所有实验均重复三次。
2 结果与分析
2.1 6′′′-阿魏酰斯皮诺素预处理抑制Aβ1-42 诱导的SH-SY5Y 细胞损伤
依照实验计划给予SH-SY5Y 细胞6′′′-阿魏酰斯皮诺素及Aβ1-42,并利用CCK-8 法检测细胞活力。Aβ1-42会对细胞造成损伤,且损伤程度呈剂量依赖性,结果如图1 所示:在不给予6′′′-阿魏酰斯皮诺素的情况下,1、5、10 μmol/L Aβ1-42给药均导致细胞活力下降,与对照组相比,Aβ1-421 μmol/L 组细胞活力降为89.17%,Aβ1-425 μmol/L 组细胞活力降为62.18%,Aβ1-4210 μmol/L 组细胞活力降为60.96%。其中,1 μmol/L Aβ1-42虽然导致细胞活力显著下降(P<0.01),但此时细胞损伤程度较低;Aβ1-425 μmol/L 组及Aβ1-4210 μmol/L 组细胞活力均极显著下降(P<0.001),且细胞活力下降程度相近,因此,本实验选择5 μmol/L 的Aβ1-42处理细胞构建损伤细胞模型。6′′-阿魏酰斯皮诺素预处理可以有效抑制Aβ1-42诱导的细胞活力下降,结果如图2 所示。与模型组相比,使用6′′′-阿魏酰斯皮诺素预处理可以剂量依赖性地增加Aβ1-42诱导损伤的SH-SY5Y 细胞活力,其中,6′′-阿魏酰斯皮诺素低剂量组(1、5 μmol/L)效果不显著(P>0.05),中剂量组(10 μmol/L)以及高剂量组(20、40 μmol/L)效果极显著(P<0.001),本实验选用5、10、20 μmol/L 6'''-阿魏酰斯皮诺素预处理细胞,研究6'''-阿魏酰斯皮诺素预处理对Aβ1-42诱导损伤细胞的保护作用,并分析6'''-阿魏酰斯皮诺素对细胞的保护作用是否具有浓度依赖性。
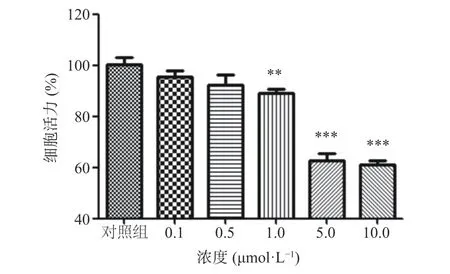
图1 Aβ1-42 对SH-SY5Y 细胞活力的影响Fig.1 Effect of Aβ1-42 on the viability of SH-SY5Y cells
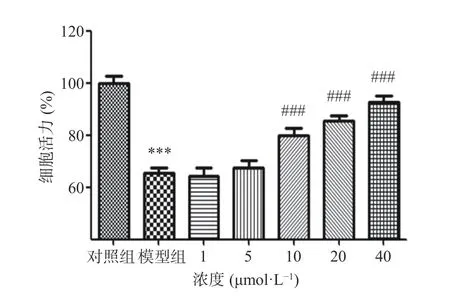
图2 6′′′-阿魏酰斯皮诺素对Aβ1-42 诱导损伤SH-SY5Y 细胞活力的影响Fig.2 Effect of 6′′′-feruloylspinosin on the viability of SHSY5Y cells damaged by Aβ1-42 induction
不同处理组Calcein-AM/PI 染色情况如图3 所示:对照组细胞生长情况良好,细胞多呈现椭圆形或梭形,生长密集,代表死细胞的红色荧光较弱;Aβ1-42处理24 h 后细胞出现损伤,细胞多呈圆形,细胞生长密度减小,死细胞数量增多,不同浓度6′′′-阿魏酰斯皮诺素预处理后,死细胞数量减少,并且细胞密度上升。说明Aβ1-42处理后,细胞受损,细胞生长密度降低、形态改变且死细胞数目增多,而6′′′-阿魏酰斯皮诺素预处理可以改善上述情况,降低Aβ1-42诱导的细胞损伤。
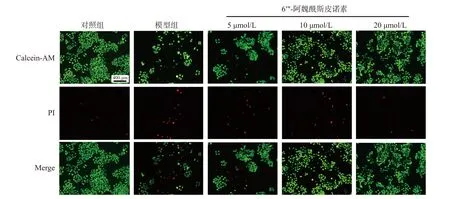
图3 6′′′-阿魏酰斯皮诺素对Aβ1-42 诱导损伤SH-SY5Y 细胞形态的影响(100×)Fig.3 Effect of 6′′′-feruloylspinosin on the morphology of SH-SY5Y cells damaged by Aβ1-42 induction (100×)
2.2 6′′′-阿魏酰斯皮诺素预处理缓解Aβ1-42 诱导的SH-SY5Y 细胞氧化损伤
SH-SY5Y 细胞内ROS 染色情况如图4(A)~图4(B)所示,与对照组相比,模型组细胞相对荧光强度极显著增强(P<0.001),6′′-阿魏酰斯皮诺素预处理组细胞平均荧光强度减弱,且呈现剂量依赖性。MDA 为氧自由基攻击生物膜中不饱和脂肪酸,生成的脂质过氧化产物[11];GSH-Px 是一种重要的抗氧化酶,可以催化还原型谷胱甘肽与过氧化氢反应,生成氧化型谷胱甘肽与水[12]。因此,MDA 水平以及GSHPx 酶活力常被用来衡量机体氧化损伤的程度及抗氧化能力的强弱。各组MDA 水平及GSH-Px 酶活力的检测结果如图4(C)~图4(D)所示,相较于对照组,模型组MDA 水平极显著增加,GSH-Px 酶活力极显著下降(P<0.001),与模型组相比,6′′′-阿魏酰斯皮诺素(20 μmol/L)预处理可以显著降低MDA 水平(P<0.01),并显著提高GSH-Px 酶活力(P<0.001)。
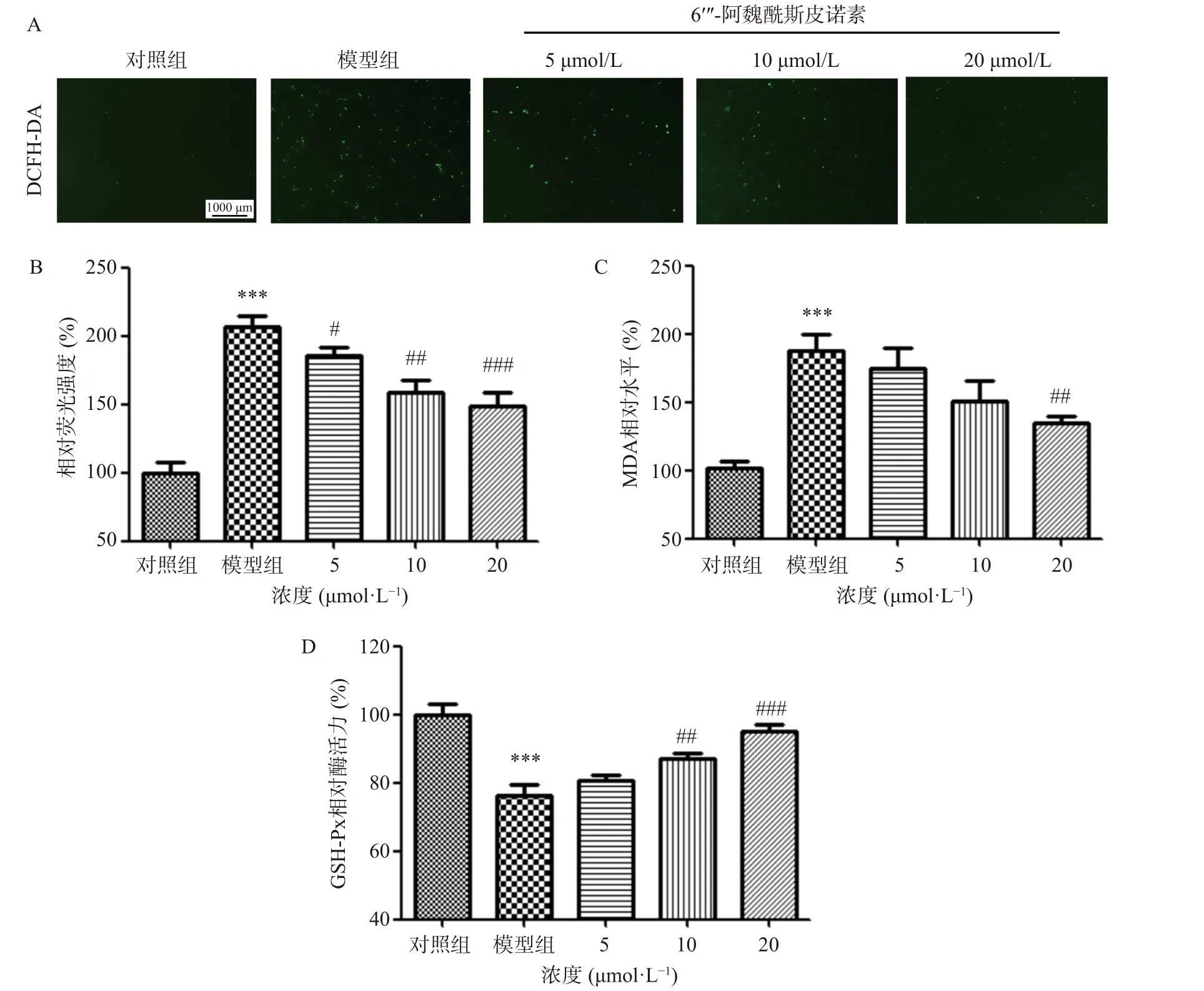
图4 6′′′-阿魏酰斯皮诺素对Aβ1-42 诱导损伤SH-SY5Y 细胞氧化应激情况的影响(40×)Fig.4 Effect of 6′′′-feruloylspinosin on the level of oxidative stress in SH-SY5Y cells damaged by Aβ1-42 induction (40×)
2.3 6′′′-阿魏酰斯皮诺素预处理抑制Aβ1-42 诱导的SH-SY5Y 细胞线粒体膜电位降低
各组细胞线粒体膜电位水平测定结果如图5 所示,对照组红色荧光较强,绿色荧光较弱,说明对照组中JC-1 多在线粒体基质中以聚集体存在,发出红色荧光,此时线粒体膜电位较高。模型组绿色荧光较强,说明模型组细胞线粒体膜电位极显著下降(P<0.001),此时,JC-1 从线粒体中扩散出来,以发出绿色荧光的JC-1 单体形式存在[13]。6′′′-阿魏酰斯皮诺素组(10、20 μmol/L)红色荧光强度增强,绿色荧光强度减弱,说明6′′′-阿魏酰斯皮诺素可以显著或极显著提高Aβ1-42诱导损伤SH-SY5Y 细胞线粒体膜电位(P<0.01、P<0.001)。
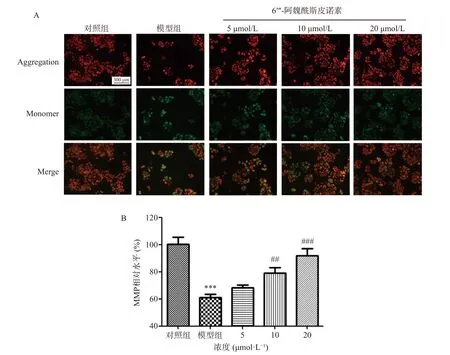
图5 6′′′-阿魏酰斯皮诺素预处理对Aβ1-42 诱导损伤SH-SY5Y 细胞膜电位水平的影响(100×)Fig.5 Effect of 6′′′-feruloylspinosin on the level of MMP in SH-SY5Y cells damaged by Aβ1-42 induction (100×)
2.4 6′′′-阿魏酰斯皮诺素预处理调节Aβ1-42 诱导损伤的SH-SY5Y 细胞内凋亡相关蛋白表达
6′′′-阿魏酰斯皮诺素及Aβ1-42对SH-SY5Y 细胞中凋亡相关蛋白表达的影响如图6 所示。相较于对照组,10 μmol/L 6′′-阿魏酰斯皮诺素单独处理组细胞凋亡相关蛋白表达无显著变化(P>0.05)。5 μmol/L Aβ1-42处理后细胞内Bad 蛋白表达极显著上调,Bcl-2 蛋白表达极显著降低(P<0.001);6′′′-阿魏酰斯皮诺素预处理组Bad 蛋白表达呈浓度依赖性地下降,Bcl-2 蛋白的表达呈浓度依赖性地上升,且与模型组差异显著(P<0.01)。6′′-阿魏酰斯皮诺素对健康细胞凋亡相关蛋白表达没有显著影响(P>0.05),但6′′′-阿魏酰斯皮诺素预处理可以调节诱导损伤细胞凋亡相关蛋白的表达,这表明6′′′-阿魏酰斯皮诺素对Aβ1-42诱导损伤的SH-SY5Y 细胞的保护作用可能与其调节凋亡相关蛋白表达的活性相关。
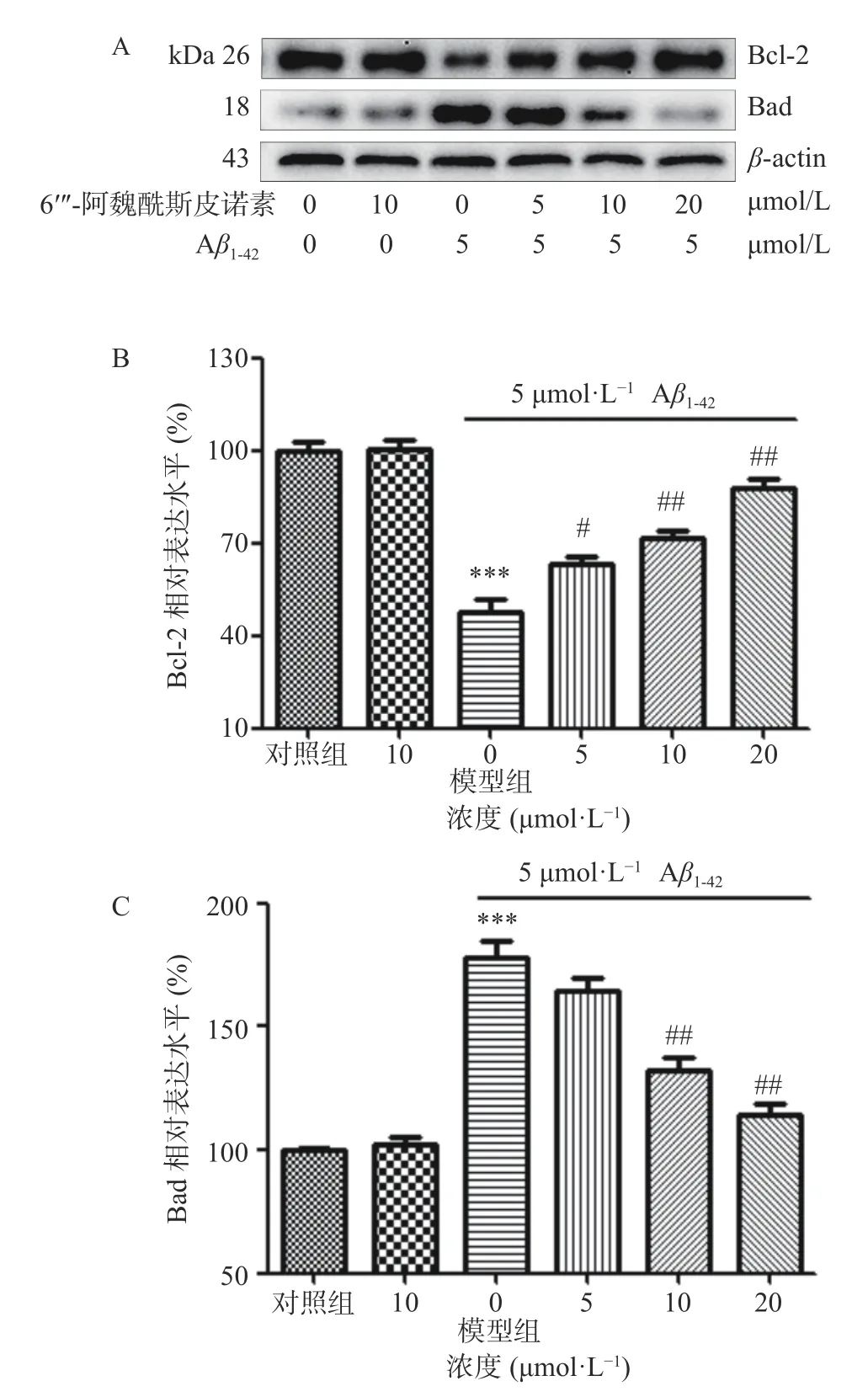
图6 6′′′-阿魏酰斯皮诺素对Aβ1-42 诱导损伤SH-SY5Y细胞凋亡相关蛋白表达的影响Fig.6 Effect of 6′′′-feruloylspinosin on the expression of apoptosis-related proteins in SH-SY5Y cells damaged by Aβ1-42 induction
3 讨论与结论
阿尔兹海默症的典型病理特征为微管稳定蛋白质过度磷酸化形成神经原纤维缠结(neurofibrillary tangle,NFT)及Aβ组成的胞外老年斑(senile plaque,SP)[14−15]。其中,Aβ是淀粉样前体蛋白(amyloidprecursor protein,APP)经β/γ裂解酶切割产生的含有39~43 个氨基酸的多肽[16−17]。早在20 世纪60 年代,研究者就在AD 患者脑内发现了Aβ原纤维,并明确Aβ与AD 的发生发展有着密切关系[18]。现代研究表明,Aβ低聚物及纤维体沉积在脑中,会引起神经细胞氧化应激、引发神经炎症、抑制海马区长时程增强效应等,导致神经细胞凋亡,从而损害患者的认知能力[19−21]。本研究利用Aβ1-42处理SH-SY5Y 细胞,构建神经细胞损伤模型,发现5、10 μmol/L Aβ1-42可以极显著降低SH-SY5Y 细胞活力(P<0.001),并改变SH-SY5Y 细胞形态。10、20 μmol/L 6′′′-阿魏酰斯皮诺素预处理可以提高损伤SH-SY5Y 细胞活力,增加细胞生长密度,改善细胞形态,这说明6′′′-阿魏酰斯皮诺素可以保护Aβ1-42诱导的损伤细胞,可能具有潜在的AD 治疗作用。
大量研究表明,Aβ是AD 发生发展过程中神经元氧化损伤的关键[22]。氧自由基的存在诱导AD 模型小鼠脑内Aβ的沉积并加速AD 病程发展[23],Aβ的存在也会损伤细胞抗氧化防御系统,导致细胞清除自由基的能力减弱[24]。丁轲等[25]采用活性追踪法对酸枣仁提取组分体外抗氧化活性进行比较,发现6′′′-阿魏酰斯皮诺素具有抗氧化活性。Yang 等[10]也发现6′′′-阿魏酰斯皮诺素可以减轻热应激诱导的秀丽隐杆线虫氧化损伤,延长秀丽隐杆线虫寿命。基于此,本研究分析了6′′′-阿魏酰斯皮诺素对Aβ1-42诱导损伤的SH-SY5Y 细胞的保护作用与其抗氧化活性的关系。结果表明,5 μmol/L Aβ1-42处理SH-SY5Y 细胞24 h 后,细胞内ROS 及MDA 水平升高并且抗氧化酶GSH-Px 酶活力极显著降低(P<0.001);20 μmol/L 6′′′-阿魏酰斯皮诺素预处理可以降低细胞内ROS 及MDA 累积水平并显著提高GSH-Px 酶活力(P<0.01、P<0.001),减低Aβ1-42诱导的SH-SY5Y 细胞氧化应激损伤。
线粒体功能障碍是AD 发生的早期事件,线粒体作为细胞能量的主要来源及氧化还原反应的重要场所,极易遭受氧自由基的攻击而造成损伤,表现为线粒体呼吸链电子传递障碍、线粒体渗透性肿胀破碎、线粒体膜通透性转换孔过度开放等[26−28]。Bcl-2 家族蛋白主要作用于线粒体外膜,与线粒体膜通透性及细胞凋亡密切相关[29]。正常情况下,Bcl-2 家族抗凋亡蛋白成员与促凋亡蛋白成员以异源二聚体形式存在。当细胞受到刺激后,Bcl-2 蛋白家族成员Bad 发生去磷酸化,并从其与分子伴侣蛋白结合组成的无活性复合物中解离,破坏异源二聚体结构,置换出大量促凋亡蛋白Bcl-2 相关X 蛋白(Bcl2-associated X protein,Bax)聚集到线粒体外膜上,导致线粒体膜通透性转换孔过度开放,细胞色素C 向胞质释放,激活caspase 联级反应,诱导细胞凋亡[30−31]。本研究结果显示,5 μmol/L Aβ1-42会导致SH-SY5Y 细胞线粒体膜电位极显著下降(P<0.001),并使抗凋亡蛋白Bcl-2 表达极显著降低(P<0.001),促凋亡蛋白Bad 表达极显著升高(P<0.001)。不同浓度6′′′-阿魏酰斯皮诺素预处理不仅可以上调Aβ1-42诱导损伤的SH-SY5Y 细胞线粒体膜电位并且可以调节Bcl-2 家族蛋白的表达,上调Bcl-2 蛋白表达,下调Bad 蛋白表达,其中,20 μmol/L 6′′′-阿魏酰斯皮诺素组效果显著(P<0.001、P<0.01、P<0.01)。
综上所述,6′′′-阿魏酰斯皮诺素可以抑制Aβ1-42诱导的SH-SY5Y 细胞损伤,其作用机制可能与6′′′-阿魏酰斯皮诺素抗氧化活性及调控Bcl-2 家族蛋白表达等活性相关。

