大白菜抗根肿病分子标记研究进展
刘栓桃,王树彬,王荣花,张志刚,李巧云,王立华,赵智中
(山东省农业科学院蔬菜研究所/国家蔬菜改良中心山东分中心/山东省设施蔬菜生物学重点实验室/农业部黄淮地区蔬菜科学观测实验站(山东),山东 济南 250100)
根肿病是由芸薹根肿菌(Plasmodiophora brassicae Woronin)侵染十字花科植株根部皮层细胞所引起的一种土传病害[1]。芸薹根肿菌是一类比较特殊的活体寄生的原生生物,在分类学上属于原生生物界、根肿菌门、根肿菌纲[2],几乎可以侵染所有十字花科植物的根部[1,3-5]。根肿菌以休眠孢子状态存活于土壤中,形态和大小不一[6],一般在酸性土壤中易侵染寄主植物[3]。植株根部细胞受病菌侵染和刺激导致细胞大量分裂、增殖,最终使根部形成大小不一、形状各异的肿瘤,因而称为根肿病。发病严重时将影响植株根部水分和营养物质的吸收和运输,导致地上部轻则萎蔫、生长发育缓慢,重则失绿乃至死亡[1,7],最终导致减产或绝产。该病害于18世纪在英格兰被广泛报道[3],20世纪20~30年代在全球多地被发现[8-10],日本于1892年[11]、韩国于1920年[1]相继发现,我国有文献记载的根肿病危害的报道始见于1956年[12]。目前根肿病已经成为全球范围内危害十字花科作物最重要的土传病害[1,13],随着人口和物质的全球化流动、农业机械化程度的不断提高以及农业机械跨区域作业的实施,根肿病的蔓延速度加剧,严重威胁十字花科蔬菜产业的安全生产。本文就大白菜(Brassica rapa L.ssp pekinensis)抗根肿病基因的遗传定位及分子标记开发研究进展做简要概述。
1 根肿菌抗源的筛选
大白菜是十字花科主要的蔬菜作物,在亚洲乃至全球都有种植。我国是大白菜起源地,虽然种质资源丰富,但根肿病的抗源材料十分稀缺。赵俊等[14]发现山西省农业科学院蔬菜所早年培育的直筒类型品种“晋菜三号”和“太原二青”在昆明市盘龙区表现抗病,关于这两个品种的抗性转育报道较少。
目前大白菜根肿病抗源多来自欧洲芜菁(B.rapa L.ssp rapifera),这与欧洲各国农业现代化发展较早有直接关系。芜菁作为养殖业重要饲料在欧洲大面积种植,20世纪20~30年代,随着机械化采收设备在一些大型农场的推广使用,导致根肿病大面积爆发,迫使农场主和政府重视抗病品种的选择。如在荷兰,个别农民自发选育了一些抗病品种,关于抗根肿病芜菁资源的筛选工作也率先得到开展[15-18]。“Jobe cut-leaves”是20世纪30年代由荷兰农场主自发选育的抗病品系并迅速得到推广,20世纪40年代抗性出现下降[16,17]。第二次世界大战以后至20世纪60年代中期,是抗病品种自主选育阶段,这一时期荷兰育种者选育了一批抗根肿病品种如“Barenza”“Mommersteeg’s cut-leaved”“Mommersteeg’s full-leaved”“Civasto-R”“Novitas”“Nobitter-R”“Gelria-R”“Civasto-heelblad-R”“Jobe-Heelblad”“Meetjeslander”“Waaslander”等[16,17]。
大白菜的抗性转育工作率先在日本开展[1,11,19,20],因为大白菜在日本有比较悠久的栽培历史和较大的种植面积,二战后伴随着日本经济的迅速复苏,根肿病在日本开始爆发。20世纪60~70年代日本从欧洲引进了抗病芜菁并开始了抗性的回交转育工作,所用抗源主要是饲用芜菁Gelria R、Siloga、Debra、Milan White以及ECD鉴别寄主ECD1~4[4,11,19,21-23]。至20世纪末,日本已先后选育出50多个抗根肿病大白菜杂交种,如“CR Kanko”“CR Kukai 65”“CR Ryutoku”“CR Utage 70”“CR W-1116”等[19,23]。
近年来随着农业机械跨区域作业的广泛实施,根肿病在中国各地开始流行,其危害有逐年加重的趋势。抗根肿病大白菜品种多数从日本与韩国引进,近年来也有了自主选育的抗根肿病大白菜杂交种,如山东德高种业有限公司选育的“德高CR117”、北京市农林科学院蔬菜研究中心选育的“CR京秋新3号”,其中“CR京秋新3号”的抗源来自大白菜杂交种“CR为民”[24]。
综上所述,大白菜中抗源主要来自欧洲芜菁,新选育的抗根肿病大白菜品种在某地种植数年后,由于土壤中根肿菌种群的变化或根肿菌本身的遗传变异,导致品种抗性逐渐下降,但原始芜菁抗源仍然保持较高抗性,原因可能为在回交转育过程中部分抗性基因丢失[17,19,23]。因此有必要对抗性基因进行全面的遗传定位,开发紧密连锁的分子标记或直接开发功能性分子标记,为利用分子标记辅助选择聚合多个抗性基因、选育持久抗根肿病大白菜新材料奠定基础。
2 大白菜抗根肿病QTL定位及分子标记开发研究进展
大白菜对根肿病的抗性由多基因控制,遵循主基因+微效多基因的遗传模式[4,22,23],迄今为止已经先后定位到23个抗根肿病位点,开发的标记有60多个[5,25],这些位点和标记主要集中在基因组的少数几个区域。
2.1 以Crr3为代表的A03-1抗性位点群及相关检测标记
在A03染色体上臂有5个抗性位点,分别是Crr3、CRk/CRky、CRd、BrA.CR.c、PbBa3.3[26-31],总计报道12个标记,根据各标记序列在BRAD(V3.0)数据库中的比对结果,发现大多数标记的位置介于15.04 ~16.33 Mb之间,相关抗性位点以及连锁标记信息详见表1。
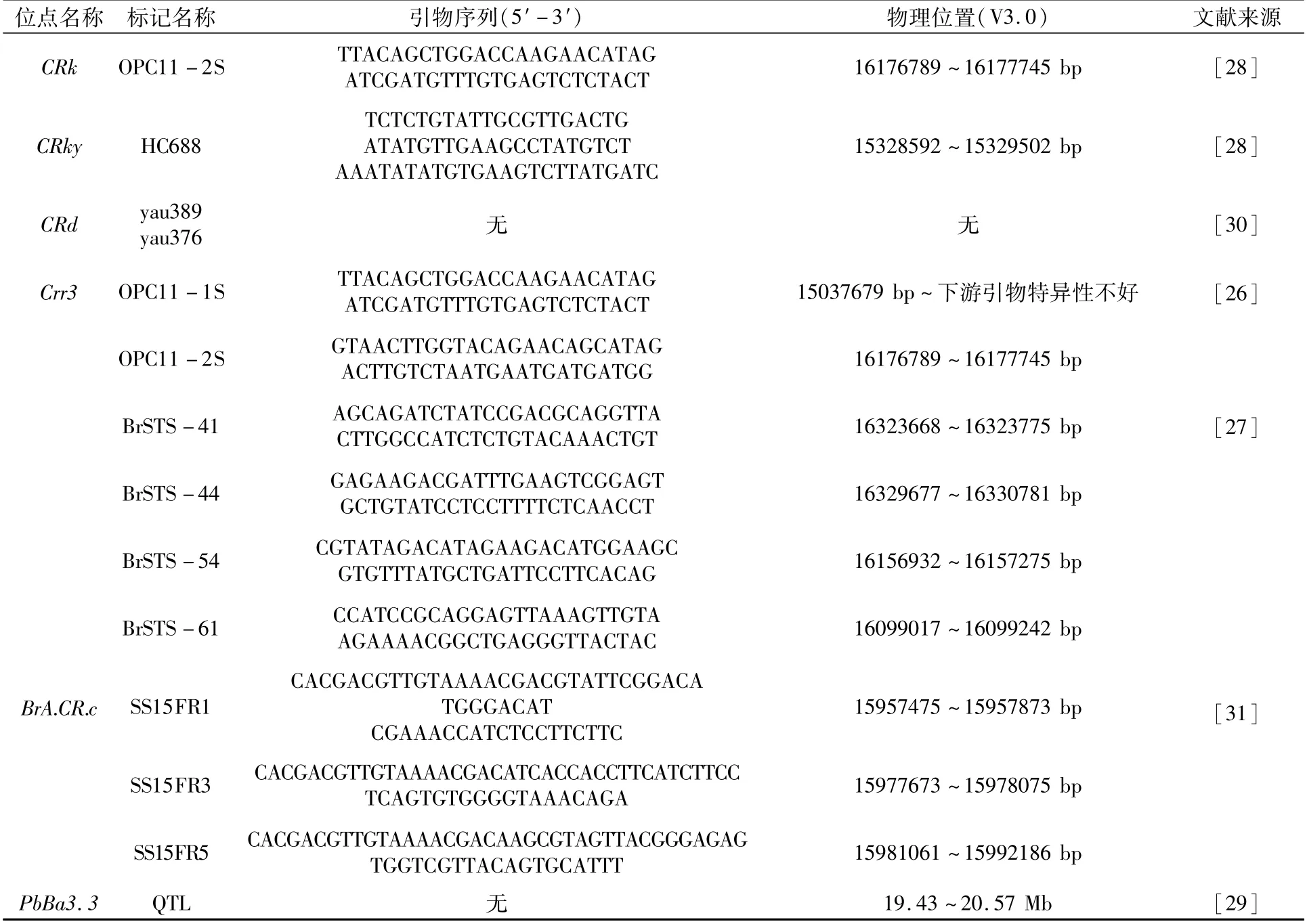
表1 A03-1抗性位点群
Crr3首先由Hirai等[26]于2004年报道,两个边界之间的标记分别是OPC11-1S和OPC11-2S,介于基因组A03染色体15 037 679~16 177 745 bp之间。Saito等[27]于2006年对其进行了精细定位,开发了4个紧密连锁标记,分别是BrSTS-41、BrSTS-44、BrSTS-54和BrSTS-61,介于16 099 017~16 330 781 bp之间。Sakamoto等[28]在邻近的区域发现了一个新位点,命名为CRk,指出与Crr3连锁的标记OPC11-2S与CRk连锁,但没有开发出新的标记。Chen等[29]于2013年发现了一个抗性QTL位点PbBa3.3,发现与Crr3紧密连锁的标记BrSTS-61与该位点连锁,但没有开发相应标记。Pang等[30]于2018年发现抗性位点CRd,两个SNP标记yau389和yau376分别位于CRd的左、右边界,相距60 kb;同时发现与Crr3连锁的标记BrSTS-61在所用的抗/感材料之间有多态性,并且推测CRd位于Crr3的上游。虽然Pang等没有给出标记的物理位置,但根据作者提供的4个候选基因(Bra001160、Bra001161、Bra001162和Bra001175)的物理位置,推测CRd介于15 977 460~16 089 616 bp之间。BrA.CR.c是最近发现的一个抗性QTL位点[31],3个共显性标记SS15FR1、SS15FR3、SS15FR5均与其连锁,介于15 957 475~15 992 186 bp之间。由此可见,上述5个位点的标记在A03染色体15 037 679~16 330 781 bp之间,相距约1 300 kb,从物理位置看它们位于A03染色体上游,因此称为A03-1抗性位点群。
2021年,Kopec等[32]在油菜中克隆了抗性基因Crr3Tsc,该基因对应油菜A基因组的功能基因BnaA03g29300D,在大白菜参考基因组中对应A03染色体上的Bra001175(15 145 899~15 152 027 bp)。
2.2 以CRa/CRb为代表的A03-2抗性位点群及相关检测标记
在A03染色体下臂,有9个抗性位点分别是CRa、CRb、CRbki、BraA3P5X/G.CRa/bKato1.1、BraA3P5X/G.CRa/bKato1.2、Rcr1、Rcr2、Rcr4和BrA.CR.a[22,33-43],根据报道的连锁标记的物理距离,主要集中在A03染色体23.72~26.52 Mb,称其为A03-2抗性位点群,先后报道的连锁标记有30多个(表2)。

表2 A03-2抗性位点群
CRa来源于ECD2,最早由Matsumoto等[22]于1998年报道,并开发了与抗性位点CRa连锁的RFLP标记HC352b和HC181,位于第三连锁群。由于该标记没有序列信息,因此无法定位CRa的物理位置。Matsumoto等[33]于2005年进一步用6个分离群体验证RFLP标记效果,发现两个RFLP标记都位于CRa位点的同一侧,同时在CRa位点另一侧开发了一个RAPD 标记E49380,距离CRa约4.6 cM,由于该RAPD标记序列太短,在BRAD数据库中没有比对到具体位置信息。Hayashida等[34]将RFLP标记HC352b成功转化成了比较方便检测的SCAR 标记,即HC352b-SCAR,该标记与CRa紧密连锁,介于24 740 847~247 40 998 bp之间。Matsumoto等[35]用一个与CRa紧密连锁的SCAR 标记SC2930进行标记辅助选择聚合育种,取得很好的效果,该标记正向引物是两个位点特异引物,在抗/感材料之间序列不同,标记介于25 990 052~25 990 865 bp之间。
CRb最早由Piao等[36]于2004年报道,将5个连锁的AFLP标记均转化成了SCAR标记和CAPS标 记,分 别 是 TCR02、TCR05、TCR08、TCR09、TCR10;根据标记序列比对结果,CRb介于A03染色体21 186 392 ~26 841 725 bp之间。Kato等[37]用抗根肿病大白菜杂交种Akiriso和CR Shinki构建F2群体,定位到一个与CRb紧密连锁的位点 CRbki,两侧标记分别是KBrH059N21F、KBrH129J18R,距离CRb分别为0.3 cM和0.4 cM,在25 372 383~25 968 035 bp之间。随后Kato等[38]对CRb进行了精细定位,进一步开发了两个紧密连锁标记KB59N07和B1005,介于25 372 516~25 551 199 bp之间。Fredua-Agyeman等[39]以ECD2为母本与两个感病亲本CR2599和CR1505分别配制了两个F2群体(pop1以CR2599为父本,pop2以CR1505为父本),用3个根肿菌生理小种(3H、5X、5G)接种鉴定并采用分群分析法(BSA)进行抗根肿病QTL定位,结果定位到两个抗性位点BraA3P5X/G.CRa/bKato1.1和BraA3P5X/G.CRa/bKato1.2,前者介于25 274 417~25 522 227 bp(KB69N05和B4732),后者介于25 601 419~25 860 581 bp(BGA06和KB29N19)。
综上,CRa、CRb所在的染色体区域为21 186 392~25 990 865 bp之间,在此区域内Hatakeyama等[40]图位克隆了CRb,序列分析发现其与Ueno等[41]鉴定的CRa是同一个基因,对应于参考基因组Bra019410、Bra019412和Bra019413三个基因的位置。另外,其他研究者用不同抗源材料和病原物在此区域内或附近又发现了几个抗病位点,如Rcr1[42,44]、Rcr2[43]、Rcr4[45]以及BrA.CR.a[31],前3个都是SNP标记,与BrA.CR.a连锁的是4个SSR 标记,综合4 个位点的物理位置,BrA.CR.a介于25 203 402~25 636 146 bp之间,正好落在CRa和CRb的目标区间内,称为A03-2抗性位点群。
2.3 以Crr1为代表的A08抗性位点群及相关检测标记
在A08染色体上臂10~13 Mb之间,报道了6个抗性位点,分别是Crr1/Crr1a、Crr1/Crr1b、Rcr3、Rcr9、BrA.CR.b以及PbBa8.1[4,29,31,46-49],有15个紧密连锁标记(表3)。

表3 A08抗性位点群
Crr1最早由Suwabe等[4]报道,发现与之连锁的SSR 标记BRMS-088,位于13 205 338~13 205 570 bp;随后又开发了3个更加紧密连锁的标记BSA1、BSA2、BSA7[46],将目标位点锁定在11 581 315~12 228 818 bp,对Crr1进行精细定位发现,该位点包含两个基因,即Crr1a和Crr1b。Hatakeyama等[48]对Crr1a进行了图位克隆,发现来自抗性材料的基因Crr1aG004编码一个TIRNB-LRR蛋白,而感病材料的基因Crr1aA9709则编码一个残缺的NB-LRR蛋白,即感病材料中缺失了TIR结构域中的大部分序列。在大白菜参考基因组中,与Crr1a同源性最高的基因是Bra020861(12 271 594~12 287 495 bp)。
Hirani等[31]在A08染色体发现一个抗性QTL位点BrA.CR.b,有5个SSR标记与之连锁,分别是S14R14、S11R11、S08R08、S07R07、S06R06,介 于11 961 933~12 433 896 bp,该位点包括Crr1。Chen等[29]在此区域发现一个抗性位点PbBa8.1,连锁分析发现该位点就是Crr1。紧邻Crr1还有两个位点即Rcr3和Rcr9,其中Rcr3定位于SNP标记A90_A08_SNP_M12和A90_A08_SNP_M16之间,Rcr9位于A90_A08_SNP_M28和A90_A08_SNP_M79之间,前者在10.00~10.23 Mb之间,后者在10.85~11.17 Mb之间[49],这两个位点可能与Crr1不同,由于都位于A08染色体上,与最早鉴定的Crr1位点毗邻,因此称为A08抗性位点群。
2.4 其它抗性位点及相关检测标记
除上述3个比较集中的抗性位点群外,在A01、A02和A06染色体上也发现了少数抗性位点。如位于A01的Crr2最早由Suwabe等[4]发现,与之连锁的有4个标记,即BSA3、BSA4、BSA5、BRMS-096,介于染色体5 589 394~6 352 275 bp之间[4,45],Chen等[29]报道的抗性位点PbBa1.1就是Crr2。在A02上有一个抗性位点CRc[28,35],与之连锁的抗性标记是B50、感病标记是m6R,抗性标记在24 Mb,感病标记提供的引物序列特异性不好,难以判断其在基因组中的位置。A06上有一个抗性位点Crr4[4],标记BSA6、BSA8和BSA9的正向引物特异性均不是较好,反向引物的位置范围跨度较大,介于10 572 479~20 638 046 bp之间,以上抗性位点均没有克隆过相关的功能基因。
3 抗病功能基因的特点
目前,A基因组中对应的3个抗性位点群即A03-1、A03-2以及A08均已经有功能基因被克隆和鉴定[32,40,47],根据相关文献报道,主要有以下特点。
3.1 开发标记的引物序列在抗/感材料之间高度保守
从已经克隆的3个位点的功能基因序列在抗/感材料之间的比对结果可以发现,所用检测标记的引物序列在抗/感基因之间恰好处于保守区域[32,40],这表明开发的紧密连锁标记(表1、2、3)仍然可以继续用于抗性位点的检测和标记辅助选择。
3.2 抗性基因在参考基因组中都有对应的基因
虽然大白菜参考基因组序列的提供者“Chiifu-401-42”不抗根肿病[40],但是所克隆的抗性基因在参考基因组中都有对应的功能基因,只不过在参考基因组中对应的基因序列与抗性基因之间存在一些差异。如在抗性油菜材料“Tosca”中,位于A基因组上包含Crr3Tosca基因在内的约7 kb的区域发生了局部的基因组重复,因此抗性材料“Tosca”中存在两个拷贝的抗性基因T1和T2[32],而Crr3Tosca对应大白菜参考基因组(V1.5)编码基因Bra001175,经过序列比对发现T1-cDNA和T2-cDNA与Bra001175的编码区分别有80.08%和77.23%的相似性,两者之间都有多处插入/缺失和较多SNP差异。抗性大白菜材料“1074RR”中,CRb位点所在的区域有6个串联重复的TIR-NB-LRR编码基因,分别是CRb_α、CRb_β、CRb_γ、CRb_δ、CRb_ε和Bra019410_R,而在“Chiifu-401-42”中,有3个预测的编码基因即Bra019410、Bra019412、Bra019413,其序列与上述6个来自抗性材料的ORF有超过80%的同源性[40]。另一个抗性基因Crr1aG004的mRNA序列(AB605024)[46]与 大 白 菜 参 考 基 因 组 的Bra020861(V1.5)的编码区有53.2%的相似性,二者主要区别在于Crr1aG004在5′端有一处较大片段的缺失,同时还有较多SNP差异。
由此可见,已经克隆的3个功能基因在参考基因组中都有对应的编码基因,且都属于TNL家族,因此可以依据抗性位点目标区域两侧紧密连锁标记之间编码基因的注释信息,筛选潜在的候选基因。
4 抗病位点候选基因筛选
已经克隆的抗病基因都属于TNL家族,据此对所有抗病位点目标区域内的编码基因进行了关键词筛选,选择Pfam_annotation和Swissprot_annotation有disease resistant、或有TIR、NB、LRR等结构域的基因,详见表4。除了已经证明的CRa和CRb[40]是相同的功能基因外,并没有直接的证据表明在同一个抗性位点群的其它几个抗性位点都是相同的功能基因,即使Crr1也包含两个不同的基因Crr1a和Crr1b[46]。因此在3个抗性位点比较集中的区域(A03-1、A03-2、A08),表4列出了其它候选基因以供参考。位于A02的Rcr8[48]和A06的Crr4[45]的定位区间或者没有注释信息如上所述基因,或者由于定位区间比较宽泛,具有上述注释信息的功能基因比较多,这两个位点的候选基因有待进一步精细定位以后再预测。

表4 抗性位点目标区间内抗性基因预测
5 总结与展望
一个抗病品种在某地推广种植数年后,由于田间根肿菌种群的变化或者根肿菌本身的遗传变异常常出现品种抗性下降的问题[17,19,23]。有些芜菁抗源材料即使经过多年种植仍然保持较高抗性,推测在利用芜菁进行大白菜抗性材料的回交转育过程中,有可能丢掉了部分抗性基因[19,23],这给利用芜菁抗源转育大白菜抗性材料提出了新的难题。一方面,建议根肿病高发区选取不同的抗病品种轮流种植,避免因单一品种连续种植造成根肿菌优势种群的改变;另一方面,通过分子标记辅助选择的方法将已经明确的抗性基因聚合在一个品种中,培育广谱抗根肿病品种。
由于根肿病抗性位点较多,即使采用标记辅助选择的手段,对已经发现的23个抗性位点而言,聚合育种并非容易实现。由于基因编辑技术可以精准地对生物体基因组特定目标基因进行修饰,因此,未来抗根肿病育种应适当关注根肿菌侵染大白菜的分子机制,鉴别更多的寄主关键因子,可利用基因编辑技术将寄主因子进行定点突变,使病菌无法入侵。基因编辑技术的实施需要创建不受基因型限制的大白菜高效遗传转化体系,以便为利用基因编辑技术直接在基因组层面阻断病菌侵染,为培育持久抗根肿菌大白菜新种质提供技术储备。

