光镊-受激拉曼光谱技术测量SO2与悬浮NaCl单液滴的氧化反应动力学速率常数
陈哲,刘湃,庞树峰,张韫宏,*
(北京理工大学化学与化工学院,北京 100081)
1 引言
大气硫酸盐是PM2.5(空气动力学直径小于等于2.5 μm的颗粒物)中重要的二次无机组分,它主要由大气中的SO2氧化转化而来[1]。SO2的氧化产物H2SO4挥发性极低,而H2SO4被中和形成的硫酸盐物种则具有极强的吸湿性,因此SO2氧化形成的S(VI)物种对大气气溶胶的成核、生长具有重要影响。外场观测研究发现,我国的雾霾形成过程中往往伴随着硫酸盐的快速、大量生成,充分说明二次硫酸盐对雾霾的爆发式生成和快速长大过程具有重要贡献2,3。目前,大致可以将大气硫酸盐的生成途径分为三类:一是气相中的SO2的均相氧化反应,涉及到SO2与OH自由基、Criegee自由基的反应[4];二是SO2在大气颗粒物表面的非均相反应,如在Al2O3、Fe2O3等矿尘颗粒表面的反应[5-7];三是SO2的液相氧化,包括与溶解氧化剂(H2O2、O3等)的反应或者云雾滴中过渡金属(Fe3+、Mn2+、Cu2+等)的催化反应[8-11]。然而,对于我国雾霾形成过程中硫酸盐的形成机制,迄今还没有统一的、结论性的认识,上述各种途径对实际大气中硫酸盐生成的贡献依然众说纷纭。例如,Wang等根据外场观测结果指出NO2、HONO液相氧化SO2途径对北京PM2.5颗粒中硫酸盐的生成具有重要贡献[8]。Li等采用S同位素分析法研究了不同反应途径对南京PM2.5颗粒中硫酸盐生成的贡献,发现过渡金属催化途径、O3/H2O2氧化途径起主导作用[12]。而Liu等对北京冬季雾霾的观测则发现,硫酸盐生成的主要贡献来自于H2O2液相氧化途径而非NO2途径[13]。此外,有关大气硫酸盐的形成机制当前还存在着另一个重要问题,即根据已知反应途径构建的空气质量模型在模拟实际大气中的硫酸盐生成量时,往往存在着低估的问题。特别是在重污染条件下,模型的预测值明显低于实际大气中的硫酸盐观测值,无法复现观测结果[14]。这一低估问题反映出实际大气环境中可能还存在未知的硫酸盐生成途径,而这些途径对硫酸盐生成的贡献不容忽视。由此可见,进一步深入研究大气硫酸盐的形成机制对弥合模型、观测差异,理解雾霾形成机制具有重要意义。
上述的三类硫酸盐生成途径往往需要强氧化剂的参与才能有效进行,而SO2直接与O2的反应则需要在过渡金属离子的催化下才能发生。但是,早期对于SO2氧化过程的研究发现,SO2在非催化的条件下也能够被O2氧化形成S(VI)物种,然而不同研究者报道的类似条件下的一级反应速率常数相差很大,差别可达4个数量级[15]。此外,这些研究往往在稀溶液或pH缓冲溶液体系中进行,而大气气溶胶由于环境湿度的影响,往往处于过饱和态,液滴中的离子强度较大。溶液相体系测得的反应动力学参数是否能够应用于气溶胶液滴体系解释硫酸盐的生成机制还存在疑问。
针对以上问题,为充分认识大气中SO2氧化生成硫酸盐的机制,就必须实现大气气溶胶中SO2氧化反应相关动力学参数的精确测量。由于大气气溶胶颗粒尺寸微小,其含水量还受到环境湿度(RH)的显著影响,因而往往处于过饱和态。对气溶胶颗粒与SO2反应过程进行实时、原位观测,并精确测定其动力学参数往往存在很大的挑战性。基于此,本研究以NaCl液滴为研究对象,利用光镊-受激拉曼光谱技术观测了SO2与悬浮NaCl单液滴在空气氛围下(O2为氧化剂)的反应过程。借助光镊-受激拉曼光谱技术,一方面可以稳定捕获、悬浮单液滴,模拟实际气溶胶液滴的悬浮状态。另一方面,悬浮的球形液滴作为光学共振腔在激光激发下会产生受激拉曼信号(即耳语回音模式,WGMs),利用WGMs可精确测定液滴的半径变化,精度可达纳米级,从而实现对液滴反应过程中硫酸盐生成量的实时、原位测定。本课题组前期的一些研究成果已证明光镊-受激拉曼光谱技术是研究气溶胶单液滴物理化学性质的一种优异手段[16,17]。本研究在凭借该技术观测NaCl液滴与SO2反应的同时,还考察了RH、SO2反应气体浓度改变引起的液滴离子强度、pH变化对反应过程的影响,并进一步对反应过程的机制进行了讨论。
2 实验部分
2.1 光镊装置
图1为本研究使用的光镊-受激拉曼光谱装置示意图,该装置主要由激光器、显微聚焦系统、光学拍摄系统、液滴样品池、光谱仪、湿度控制系统几部分构成。由532 nm半导体激光器(Laser Quantum, Opus 4W)发出的高斯激光束首先经由扩束器扩束,再射入100×油镜(Olympus UIS2 PlanCN, N.A. 1.25)的通光孔中。激光束经过显微物镜聚焦后在样品池内形成单光束梯度力势阱,一旦有微小液滴飘入激光聚焦区域就会受到光梯度力的作用,从而被捕获并稳定悬浮在聚焦激光的焦点位置。样品池的上下表面安装有玻璃窗片,以便聚焦激光从下至上射入样品池内,同时也为样品池上部的蓝光LED亮场照明光源提供通路。液滴被蓝光LED照亮后,其光学图像被CCD相机(Watec, model 231S2)采集。另一方面,悬浮液滴的背向散射拉曼信号经可逆光路返回后,被一凸透镜聚焦于光谱仪(Zolix Omnic λ-300i, 1200 g/mm)的入射狭缝上,实现液滴拉曼光谱的实时采集。
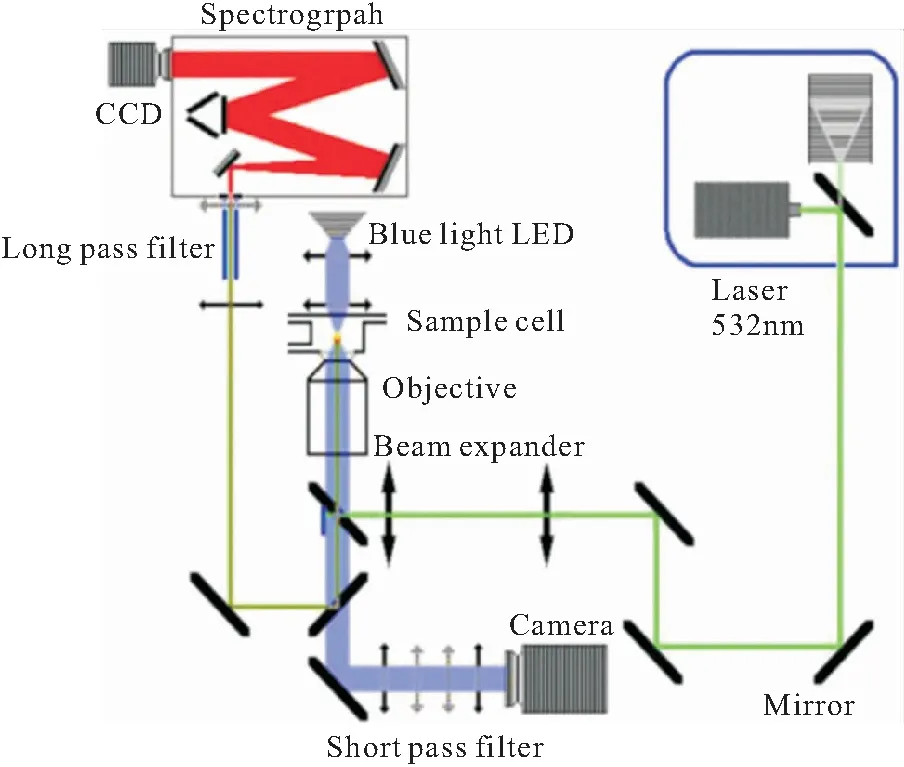
图1 光镊装置示意图Fig. 1 Schematic diagram of the aerosol optical tweezer
2.2 单液滴的捕获、悬浮及反应过程观测
NaCl气溶胶由一医用雾化器(Yuyue 402AI model)雾化0.5 M NaCl溶液产生,雾化器产生的NaCl液滴喷入样品池后即可被捕获、悬浮。通入样品池的各路气流采用质量流量计(Alicat Scientific, MC-1SLPM)调控流量,样品池内的RH、SO2浓度通过调节干、湿空气的混合比例、SO2占总气流量的混合比例实现调节。湿度计(Center Technology, Center-313)安装在样品池出口处,用于实时记录样品池内的RH变化。成功捕获液滴后,开始采集液滴的拉曼光谱,采集速率为1 frame/s。
2.3 数据处理方法
采集的液滴拉曼光谱既包含液滴中水的自发拉曼信号,也包含球形液滴的受激拉曼信号,即耳语回音模式WGMs。通过米氏散射模型拟合WGMs,可以得到液滴的半径、折射率信息。在本研究中,SO2与液滴反应会形成S(VI)物种使液滴吸水长大,导致其半径增长。通过液滴的半径增长,结合Zdanovskii-Stokes-Robinson (ZSR)关系[18]、E-AIM模型给出的S(VI)物种与吸水量之间的关系,即可确定反应过程液滴中S(VI)物种的生成量变化,确定反应速率d[S(VI)]/dt。此外,根据式1、式2还可进一步计算液滴的摄取系数、拟一级速率常数:
(1)
(2)
式中,d[S(VI)]/dt为S(VI)产物生成速率;vSO2为SO2分子的平均运动速度;As为液滴比表面积;[SO2]为气相SO2浓度;[S(IV)]为液滴中S(IV)物种的浓度。另外,在不同反应条件下,NaCl液滴内的各物种浓度、活度系数由各物种的溶解、解离平衡关系和Pitzer-Debye-Hückel方程计算得到[19]。
3 结果与讨论
3.1 80%RH条件下SO2在NaCl液滴中的氧化反应观测结果
首先观测了恒定RH下SO2与NaCl液滴的反应情况,相关结果如图2所示。反应条件设置为80%RH、SO2浓度0.5 ppm,图2(a)是反应过程中NaCl液滴WGMs峰位变化,可以看到在5000 s的反应过程中,WGMs峰位呈现向长波长移动的趋势,说明液滴的半径在随着反应的进行而逐渐增大。以初始时刻(t=0 s)642.9 nm处的信号峰为例,该峰在反应5000 s后移动至643.3 nm处,峰位向长波长处移动了约0.4 nm。在恒定湿度下,NaCl液滴的溶质浓度是一定的,而液滴在反应过程中出现半径增大,说明液滴在逐渐吸湿长大。这从侧面说明SO2与NaCl液滴发生了氧化反应,生成S(VI)物种,即SO2被氧化生成H2SO4,从而导致液滴内的溶质增加。为平衡溶质增加导致的液滴内溶质浓度增大,液滴便会吸收环境中的水分从而发生吸湿长大的现象。由于WGMs峰位变化只反映液滴的半径变化,为进一步验证反应是否有S(VI)产物生成,进一步考察了液滴在反应过程中SO42-的自发拉曼峰变化。图2(c)是反应过程中硫酸根的拉曼光谱变化,可以看到反应约200 s后在~561 nm(拉曼位移为~972 cm-1)处出现了一个微弱的SO42-峰(ν1(SO42-),该峰右侧~1080 cm-1处的宽峰可能来自于样品池玻璃窗片),该峰在后续的反应过程中始终存在。另一方面,从图2(d)中可以看到,ν1(SO42-)峰自约200 s出现后,其强度变化呈现随着反应进行而略微增大的趋势。因此,根据SO42-自发拉曼光谱的结果,说明SO2在NaCl液滴中确实发生了氧化反应,生成了S(VI)氧化产物H2SO4。

图2 (a)反应过程中NaCl液滴WGMs峰位变化;(b)液滴半径拟合结果及反应过程RH;(c)(d)反应过程SO42-的拉曼光谱及其峰强度变化(反应条件为80%RH,0.5 ppm SO2)Fig.2 (a) The WGMs of NaCl droplet during reaction process; (b) Fitting results of droplet radii and RH during reaction process; (c)(d) Raman spectra of SO42- band and its intensity change (Reaction condition: 80%RH, 0.5 ppm SO2)
图2(b)是使用米氏散射模型拟合WGMs得到的半径变化结果,可以看到恒定RH下(反应过程RH为80.4%±0.1%)液滴半径随反应进行逐渐增大,这和WGMs峰位移动反映的情况一致。对测得的半径进行线性拟合发现,半径的变化斜率为0.0010 nm/s,即液滴反应5000 s半径增大约5 nm。根据液滴半径随时间的变化关系,可以确定液滴反应过程中体积(即水含量)的增加量。本研究根据ZSR关系,认为液滴的水含量增加完全是由生成的S(VI)产物H2SO4吸水引起的,由此通过E-AIM模型给出的一定RH下H2SO4摩尔数与吸水量的关系,即可确定液滴中生成的H2SO4产物量变化。图3是计算得到的当前条件下反应5000 s,H2SO4生成量随时间的变化,根据液滴初始体积及图3中拟合直线的斜率(1.61×10-18mol/s),测得反应速率为1.77×10-6mol·L-1·s-1,进一步计算得到摄取系数γ=2.21×10-6。

图3 反应过程H2SO4生成摩尔数随时间变化结果Figure 3 The moles of formed H2SO4 during reaction process
3.2 RH、反应气浓度对SO2氧化反应过程的影响
大气气溶胶在实际环境中往往会经历较大范围的RH变化,从而影响气溶胶颗粒的水含量。而颗粒水含量的变化又会显著影响颗粒的相态、物种浓度及相关反应特性。为此,本研究考察了不同RH下SO2在NaCl液滴中反应的差异。图4是不同RH、SO2浓度条件下,拟一级速率常数k的变化情况。注意在RH改变时,NaCl液滴的pH也受到一定影响,SO2浓度一定而RH从~60%增加至~90%时,液滴pH升高约0.5个单位。从图4可以看到,当SO2浓度一定时,速率常数k随着RH的降低而显著下降。对于0.5 ppm SO2条件,RH为~60%时k = 0.25 s-1,而RH上升至~90%时k=0.01,下降了约1个数量级。对于5 ppm SO2的反应条件,RH对k值的影响也有类似的趋势。

图4 RH、SO2浓度对SO2氧化反应拟一级速率常数的影响Fig. 4 The effects of RH and SO2 concentration on the pseudo first-order rate constant of SO2 oxidation reaction
RH对k值的影响本质上是由于RH变化引起的液滴离子强度变化导致的。在本研究实验条件下,RH从~60%上升至~90%将导致NaCl液滴的离子强度从~9.5 mol/kg下降至~2.3 mol/kg,而反应的k值下降约1个数量级,这反映液滴离子强度的改变对SO2在液滴中的氧化反应具有重要影响。此外,前人的相关报道也发现了类似离子强度增大对SO2氧化反应的促进作用,如H2O2与SO2、NO2与SO2之间的液相氧化过程,离子强度的增大也明显促进这些反应的进行[9,20]。这些结果意味着大气气溶胶液滴在低RH、高过饱和态、高离子强度的条件下,SO2的氧化过程与体相稀溶液环境下的过程相比存在显著差异,将体相稀溶液条件测得的相关动力学参数应用于气溶胶体系时,其适用性应当格外注意。
另一方面,本研究还考察了SO2浓度变化对反应过程的影响。对于变化SO2浓度的体系,RH恒定在~60%。当SO2浓度由0.5 ppm增加至5 ppm时,液滴的pH从3.34下降至2.84(图3中三角点),同时反应过程的拟一级速率常数k也从0.25下降至0.16。这一现象说明,RH恒定即离子强度一定的条件下,SO2氧化反应的k值随pH的增大而略微减小,且在其他RH(离子强度)条件下也有类似的趋势。
3.3 SO2非催化氧化反应机制的讨论
对于SO2与O2进行的非催化氧化反应,早期的研究认为该反应过程是一个体相反应,即SO2先溶解进入液相环境中,而后形成的S(IV)物种(包括SO2·H2O、HSO3-、SO32-)再与液相环境中的O2反应形成S(VI)产物。因而,采用式(2)计算得到的拟一级速率常数是假设SO2与NaCl液滴的反应为体相过程,在此记为体相拟一级速率常数kaq。如图5下图所示,本研究三组条件下测定的kaq,受不同条件的影响其数值在10-3~10-1数量级变化。而文献报道的蒸馏水中的SO2与O2反应的kaq在10-5数量级[21],本研究的结果比报道的kaq值要高2~4个数量级,这说明SO2在NaCl液滴中应当不单单只有体相反应过程,否则kaq不会远远高于体相条件下的测定值。

图5 图5 界面(上图)、体相(下图)拟一级速率常数比较Fig.5 Comparison of interface (up) and bulk phase (down) pseudo first-order rate constant
近来的报道发现SO2无需溶解进入液滴体相,即可在酸性液滴的表面直接发生界面氧化反应生成S(VI)产物,该过程的反应速率常数要远远高于体相过程。文献报道的液滴界面反应速率的经验关系为[22,23]:
(3)
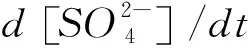
(4)
按照界面反应来处理实验结果,得到的kin如图5上图所示,kin值在101~102数量级,远高于体相的结果。而文献报道的HCl液滴中的界面反应,pH<4时kin值在103~104数量级,比本研究的实验值高2-3个数量级左右,这可能是由于实验技术以及液滴体系差异导致的。此外,在pH<3.5时kin报道值随着pH的减小而逐渐减小,这与本研究中恒湿变SO2浓度组数据(图5上图三角点)的变化趋势是一致的。总体而言,SO2在NaCl液滴中的非催化氧化反应表现出了远高于体相过程的拟一级速率常数,在按界面反应过程处理时得到的kin值与相关文献报道较为接近,这说明SO2与NaCl液滴发生的非催化氧化过程可能同时存在着体相反应和界面反应的贡献。
4 结论
综上所述,本研究利用光镊-受激拉曼光谱技术,对SO2与NaCl液滴在空气氛围下的氧化反应过程进行了实时、原位观测。反应过程中,S(VI)产物的生成将导致液滴吸水长大,而液滴半径纳米级的变化也能够被准确测定,反映了光镊-受激拉曼光谱技术是研究液滴反应过程的一种优异手段。此外,本研究进一步考察了RH、SO2浓度对反应过程的影响,结果表明RH由~60%增大至90%会导致反应过程的拟一级速率常数降低约1个数量级。而在恒定RH下,SO2浓度增加引起的液滴pH减小则会导致拟一级速率常数略微下降。此外,通过比较按体相过程、界面反应过程处理的拟一级速率常数,推测在本研究条件下,SO2与NaCl液滴的非催化氧化过程可能同时存在体相反应和界面反应的贡献。

