醒脑静抑制Notch信号通路减轻七氟烷引起的成年小鼠认知功能障碍
梁俊杰,韩姗姗,吴佳骏,柴高尚,赵鹏,张邓新
(1.江南大学无锡医学院,江苏 无锡 214122;2.江南大学附属无锡妇幼保健院,江苏 无锡 214002)
七氟烷是临床上最常用的吸入麻醉药之一,具有刺激小、诱导快、可控性好等优点[1]。但大量研究表明,七氟烷可引起术后认知功能障碍(Postoperative cognitive dysfunction, POCD),在老年患者中尤为明显。POCD是一种常见的术后并发症,定义为麻醉和手术后产生的一种新的认知障碍。POCD不仅增加其他并发症的发生率,延长住院时间,而且严重影响患者的生活质量[2-3]。目前,七氟烷引起POCD的机制尚不明确,其通过激活神经炎症反应从而导致POCD,是目前认为可能的作用机制。
炎症是许多病理过程的始动阶段。海马作为大脑学习和记忆的主要区域,海马炎症反应将对认知能力产生不利影响。研究表明,七氟烷通过多种机制激活中枢神经系统炎症。如Shao等发现七氟烷可激活NLRP3/Caspase-1信号通路,导致炎性细胞因子分泌,诱发“炎性瀑布效应”,引起神经炎症,损害认知功能[4]。Dong等发现七氟烷通过下调海马中的PPAR-γ活性,增加小胶质细胞调节的神经炎症反应,从而导致认知能力下降[5]。既往研究表明Notch信号通路在肿瘤的发生发展中发挥重要作用[6-9]。但近期研究表明Notch信号通路的异常激活与炎症相关,如过敏性气道炎症[10]、肾脏炎症[11]。然而Notch信号通路是否参与七氟烷诱导的海马神经炎症仍不清楚。
神经发生是指神经干细胞通过增殖、迁移、分化、成熟等步骤后,成为成熟神经元并与原有神经元形成功能性突触连接的过程[12],其主要发生在2个脑区:海马齿状回(DG)的颗粒下层(SGZ)和侧脑室室管膜下区(SVZ)[13]。海马神经发生在记忆形成中起着重要作用,并与突触可塑性密切相关[14]。神经发生的程度可以通过海马DG中神经前体细胞(NPCs)的数量来量化[15-17]。神经炎症与神经发生密切相关。研究表明,神经炎症释放过多的促炎细胞因子等炎症分子,对神经发生产生负面影响[18]。
醒脑静注射液(XNJ)是临床常用的脑保护药物,研究表明其对脑缺血再灌注损伤和脑梗死有显著作用[19-21]。然而,它是否对七氟烷诱导的神经炎症有影响尚未清楚。本研究旨在研究醒脑静注射液减轻七氟烷引起认知障碍的作用机制。
1 材料与方法
1.1 实验动物与模型
SPF级雄性C57BL/6J小鼠36只,8~12周龄,购自常州卡文斯实验动物有限公司,在无病原体环境中饲养。所有动物实验均经江南大学实验动物伦理委员会审核通过(伦理审批号:JN.No20201230c1401231[379])。待动物适应1周后,将36只小鼠随机分为3组:对照组(Con)、七氟烷(Sev)和七氟烷+醒脑静注射液(Sev+XNJ)组,每组12只。Sev+XNJ组小鼠于七氟烷麻醉前2 h腹腔注射醒脑静(10 mL·kg-1,给药剂量参照文献[22]方法),然后吸入3%七氟烷6 h。Sev组小鼠腹腔注射等量生理盐水后吸入3%七氟烷6 h。Con组小鼠除腹腔注射等量生理盐水外,其余均不加处理。七氟烷吸入时间和剂量参照文献[23]的方法。
1.2 主要试剂与仪器
七氟烷(批号:21050631)购自上海恒瑞医药有限公司。醒脑静注射液(批号:210311)购自无锡济民可信集团有限公司,BrdU粉末(货号:B5002)购自Sigma-Aldrich(上海)贸易有限公司。兔抗Notch1抗体(货号:Ab52627)、兔抗activated-Notch1 (NICD)抗体(货号:Ab8925)、兔抗Hes1抗体(货号:Ab71559)、兔抗BrdU抗体(货号:Ab152095)、山羊抗兔IgG H&L (Alexa Fluor®594)(货号:Ab150080)和山羊抗鼠IgG H&L (FITC)(货号:Ab6785)购自英国Abcam抗体公司。兔抗β-actin抗体(货号:49381)、辣根过氧化物酶标记的山羊抗兔IgG二抗(货号:L3012)购自美国Signalway抗体公司, 鼠抗Iba1抗体(货号:GTX632426)购自美国GeneTex抗体公司。BCA蛋白检测试剂盒(货号:P0012S)、RIPA裂解缓冲液(货号:P0013B)、SDS-PAGE蛋白上样缓冲液(货号:P0015L)购自上海碧云天生物科技有限公司。蛋白标记物(货号:WJ102)来自上海雅酶生物医药科技有限公司。高灵敏度ECL化学发光底物(货号:AR1172)购自武汉博士德生物科技有限公司。SDS-PAGE凝胶快速制备试剂盒(货号:BL522A)购自北京兰杰柯科技有限公司。Hifair®Ⅲ 1stStander cDNA Synthesis SuperMix for qPCR (gDNA digester plus)反转录试剂盒(货号:11141ES60)和Hieff®qPCR SYBR®Green Master Mix (No Rox)(货号:11201ES08)购自上海翌圣生物科技有限公司。所用引物由江苏GENEWIZ生物技术有限公司合成。
R620-S1型动物全身麻醉机购于深圳市瑞沃德生物科技有限公司。WMT-100 Morris水迷宫视频分析系统购自成都泰盟软件有限公司。CM3050S全自动冰冻切片机购自德国徕卡生物有限公司。全自动正置荧光显微镜购自德国蔡司集团。LightCycler 480Ⅱ自动荧光定量PCR系统购自罗氏集团。Tanon-2500b化学发光成像仪购自上海天能科技有限公司。
1.3 BrdU标记
5-溴-2'-脱氧尿苷(BrdU)粉剂溶于37 ℃生理盐水中,在七氟烷麻醉前2 d进行腹腔注射,注射剂量为100 mg·kg-1,每日2次,连续3 d。
1.4 Morris水迷宫测试
利用Morris水迷宫检测小鼠的认知行为能力。Morris水迷宫系统由一个圆形水箱组成,水箱被平均分为4个象限,平台位于其中一个象限并没入水面以下1 cm。小鼠在接受七氟烷麻醉前5 d进行定向航行训练,每天4个象限依次进行训练,连续5 d。每次训练的最小时间间隔为15 min。每次训练过程中,小鼠依次被置于水迷宫的4个不同象限,允许其在60 s时间内自由寻找水下隐藏平台,第1次踏上平台并在平台超过10 s的时间称之为逃避潜伏期(Escape latency),如其在60 s时间内仍无法寻找到平台,则人为引导其至平台处并停留30 s以巩固记忆。在第6天,小鼠在七氟烷或对照暴露后进行空间探索测试,此时撤去水下藏匿平台,让小鼠在60 s内寻找原平台位置,使用WMT-100 Morris水迷宫视频跟踪系统记录第1次找到原平台位置的时间(即逃避潜伏期)以及原平台穿越次数。
1.5 免疫荧光分析
将麻醉后的小鼠用生理盐水及4%多聚甲醛心脏灌流处死后取出其大脑,置于4%多聚甲醛中固定24 h,然后在含20%蔗糖的磷酸盐缓冲液(PBS)中放置2 d,然后转至含30%蔗糖的PBS中放置3 d进行梯度脱水处理。脱水完毕后脑组织用冰冻切片包埋剂包埋,然后按25 μm厚度进行冰冻切片。将切片用含0.5% Triton X-100的PBS溶液渗透30 min以溶解磷脂膜,并在室温下与封闭溶液(含5% BSA的PBS)孵育1 h。随后切片与一抗(稀释比为1∶200)在4 ℃环境中孵育过夜后,与荧光二抗(稀释比为1∶200)在室温下孵育2 h。然后在蔡司全自动正置荧光显微镜下观察[24]。
1.6 qPCR反应
将小鼠断颈处死后在冰上快速取出海马组织,用Trizol试剂提取总RNA,按反转录试剂盒说明书的方法,将1 μg RNA反转录为cDNA。在LightCycler 480上用定量扩增TNF-α、IL-6、IL-12p35和GAPDH的引物。GAPDH基因作为内参。目的基因mRNA表达水平呈倍数变化,并与GAPDH水平进行标准化。引物参照本团队前期研究[25]所设计,引物序列如表1所示。

表1 引物序列Table 1 Primer Sequences
1.7 Western blot实验
水迷宫空间探索试验后处死小鼠。快速取出脑组织样本,在4 ℃环境下分离海马。用RIPA裂解液匀浆裂解海马组织,随后在4 ℃,12 000 r·min-1条件下离心5 min取上清,用BCA蛋白检测试剂盒检测蛋白浓度。将样品蛋白与SDS-PAGE蛋白上样缓冲液充分混合并95 ℃加热10 min,待冷却至室温后用10%的SDS-PAGE分离,随后转移到硝化纤维素膜上,与5% BSA室温孵育1 h后,与Notch1抗体(稀释比1∶500)、NICD抗体(稀释比1∶500)、Hes1 抗体(稀释比1∶500)和β-actin抗体(稀释比1∶3 000)在4 ℃下孵育过夜,然后与辣根过氧化物酶标记的二抗在室温下孵育1 h。最后,利用Tanon-2500B化学发光成像仪检测蛋白条带,然后使用Image J软件检测条带的灰度值并进行统计分析。
1.8 统计学方法
2 结果
2.1 醒脑静注射液改善七氟烷诱导的小鼠空间学习记忆障碍
在第1~5天的定向航行训练中,各组在任何时间点的逃避潜伏期均无显著差异(图1A)。而空间探索试验的统计分析显示,3组间的逃逸潜伏期和平台穿越时间存在显著差异(P<0.05,P<0.01)。与Con组相比,七氟烷组的逃逸潜伏期显著增加(P<0.01),但吸入七氟烷前腹腔注射醒脑静,逃逸潜伏期显著降低(P<0.05)(图1B)。与Con组相比,七氟烷组的原平台穿越次数也明显减少(P<0.05,P<0.01);然而,与七氟烷组相比,Sev+XNJ组的平台穿越次数显著增加(P<0.05)(图1C)。与Con组相比,七氟烷组游泳轨迹极其混乱,但Sev+XNJ组游泳轨迹则相对集中于原平台位置附近(图1D)。
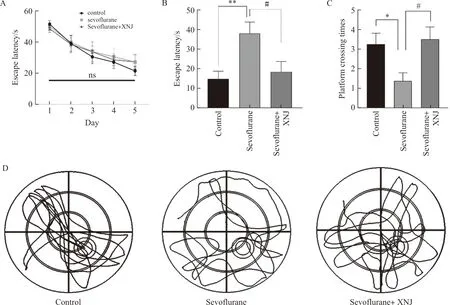
注:A.第1~5天定向航行训练各组小鼠逃避潜伏期;B.第6天空间探索实验各组小鼠逃避潜伏期;C.空间探索实验各组小鼠平台穿越次数;与对照组相比;D.空间探索实验各组小鼠典型游泳轨迹。与对照组相比,*P<0.05,**P<0.01;与Sev+XNJ组相比,
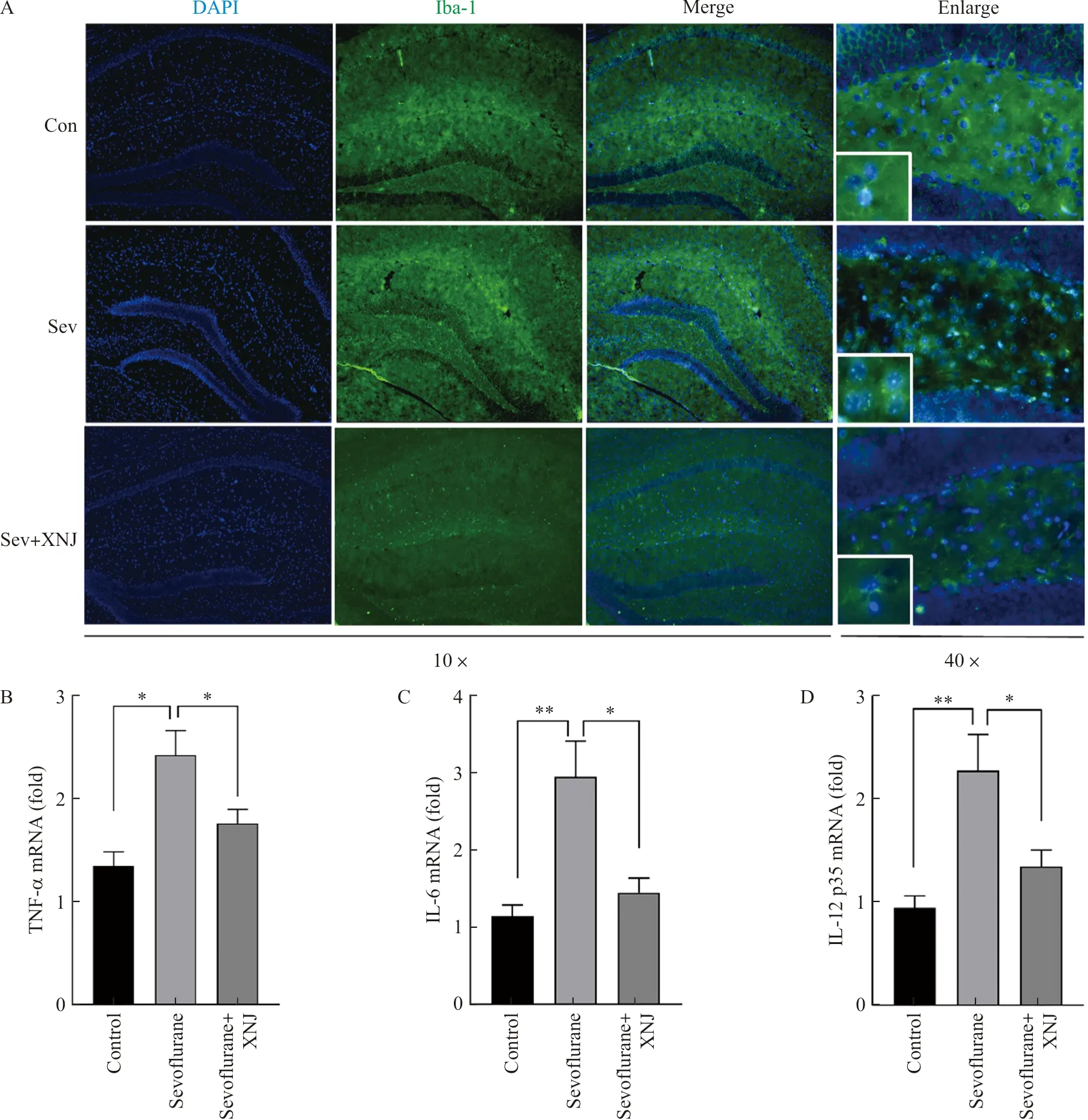
2.2 醒脑静注射液对七氟烷引起的海马炎症反应有抑制作用
小胶质细胞是中枢神经系统中的免疫细胞,其激活状态可反映炎症水平。本研究采用小胶质细胞的标志物Iba-1来观察小胶质细胞的激活状态。结果表明,与Con组相比,七氟烷组海马小胶质细胞显著被激活,具体表现为小胶质细胞的突起减少,胞体变圆。与Sev组相比,Sev+XNJ组小鼠海马小胶质细胞激活被抑制(图2A)。随后,通过qPCR技术检测各组海马的炎性细胞因子,结果表明,与Con组相比,Sev组的海马M1型促炎细胞因子如TNF-α、IL-6和IL-12 p35 mRNA水平显著上调(P<0.05,P<0.01)。与Sev组相比,Sev+XNJ组上述M1型促炎细胞因子mRNA水平下调(P<0.05),差异具有统计学意义(图2B~2D)。
2.3 醒脑静注射液可缓解七氟烷诱导的神经干细胞增殖功能障碍
为了检测神经干细胞在海马中的增殖情况,使用核苷酸类似物BrdU标记神经干细胞。免疫荧光实验结果显示,七氟烷对海马DG区颗粒细胞下层的神经干细胞增殖有明显的抑制作用,BrdU标记的阳性细胞数显著减少,而醒脑静注射液能缓解七氟烷对神经干细胞增殖的抑制效果,BrdU标记的阳性细胞数增加(图3A)。采用ImageJ软件对各组的BrdU阳性细胞进行量化。结果显示,七氟烷组DG区域BrdU阳性细胞数量明显低于其他2组,差异有统计学意义(P<0.05,P<0.01)(图3B)。
注:与Sev组比较,

注:比例尺=100 μm。与Sev组相比,
2.4 醒脑静注射液可抑制七氟烷诱导的Notch/Hes1通路过度激活
为探讨Notch信号通路在七氟烷诱导的术后认知功能障碍中的作用,我们采用Western blot观察各组Notch1、NICD和Hes1的表达情况。使用Image J软件对Notch1、NICD和Hes1的灰度值进行分析来量化蛋白的相对表达量。结果显示七氟烷组的Notch1、NICD和Hes1的蛋白相对表达量显著高于对照组和七氟烷加醒脑静组,差异具有统计学意义(P<0.05,P<0.01)(图4)。

注:与Con组相比,*P<0.05,**P<0.01;与Sev+XNJ组相比,
3 讨论
本研究探讨醒脑静注射液能否通过调节Notch信号通路,减轻七氟烷所致成年小鼠认知功能损害。正如预期的那样,我们发现3%七氟烷暴露6 h可导致成年小鼠认知功能障碍。免疫荧光结果显示海马小胶质细胞被激活,神经干细胞增殖受到抑制。qPCR和Western blot分析显示,七氟烷可上调海马组织中炎症细胞因子mRNA水平及Notch信号通路相关蛋白Notch1、NICD和Hes1的表达水平。醒脑静注射液预处理下调了海马Notch1、NICD和Hes1蛋白的表达,炎症细胞因子mRNA表达降低,抑制了小胶质细胞的激活并缓解了七氟烷引起的神经干细胞增殖障碍。Morris水迷宫测试是检测认知功能的经典行为学实验。在5 d的定向航行训练中,各组间逃逸潜伏期无显著性差异,即空间探索试验的差异可以认为是由七氟烷引起的。我们的研究表明醒脑静可以改善小鼠认知功能。综上所述,醒脑静注射液通过调节Notch信号通路减轻七氟烷诱导的学习记忆障碍。提示醒脑静注射液预处理可能是预防七氟烷致成年小鼠术后认知障碍的可行措施。
POCD是一种常见的术后并发症,但其确切的发病机制尚不清楚。人们普遍认为POCD可能是多因素的,这可能与年龄、教育水平、先前存在的心理健康状况和并发症[26]有关。近年来,麻醉与术后认知功能障碍的关系已成为麻醉学者研究的重点。越来越多的动物研究表明,手术中广泛使用的吸入性麻醉剂七氟烷可诱发POCD,特别是在老年小鼠中[27-29]。但亦有研究表明,七氟烷也可引起幼龄和成年小鼠学习记忆障碍[23,30-32]。已有多种机制揭示了七氟烷诱导认知障碍的机制,如神经炎症[33-35]、氧化应激[36]、自噬[37]和铁-葡萄糖代谢交叉功能障碍[38]。在众多机制中,七氟烷引起神经炎症导致POCD是研究得最为广泛的机制之一,但七氟烷是如何引起神经炎症的尚不清楚。
海马DG中的神经发生在海马功能中发挥着关键作用,神经干细胞增殖分化为成熟神经元,与现有的海马回路形成突触连接,并促进海马依赖的学习和记忆过程[39]。成人神经发生过程对病理条件高度敏感,越来越多的证据表明神经发生功能障碍可能在阿尔茨海默病[40]和抑郁症中发挥重要作用[41-42]。炎症作为病理过程的初始阶段,可引起一系列的级联反应,进而损害包括神经发生在内的其他功能。Tang等发现海马成纤维细胞生长因子2(调节中枢神经系统细胞增殖和存活的关键分子)的蛋白表达受到神经炎症的抑制[43]。Osman等发现促炎小胶质细胞负向调节神经干细胞存活[44]。然而,七氟烷诱导的神经炎症如何影响神经增殖功能仍需进一步研究。
Notch信号是通过细胞-细胞间的交流来实现的,其中一个细胞上的跨膜配体激活相邻细胞上的跨膜受体。在ADAM金属蛋白酶和γ-分泌酶复合物的帮助下,Notch受体被切割并释放出Notch胞内结构域(NICD,Notch的活化片段)。然后,NICD易位到细胞核,与CSL(也称为RBP-J)相互作用,调节下游基因如Hes家族成员的转录[45-46]。在生理条件下,Notch信号通路通过促进NSC增殖和抑制神经分化来维持神经系统自我更新。Notch信号通路由于具有促进细胞增殖的作用,在肿瘤发生发展领域得到了广泛的研究。然而,最近的研究逐渐表明Notch信号通路也与炎症密切相关。Qian等发现Notch信号通路的激活在脊髓损伤(SCI)后A1星形胶质细胞分化中起重要作用[47]。同样,Wu等发现Notch信号调节颞叶癫痫大鼠模型[48]中的小胶质细胞激活和炎症反应。然而Notch信号通路是否调控七氟烷诱导的海马炎症尚不清楚。因此,我们的研究旨在确定Notch信号通路在七氟烷诱导的炎症中的作用。研究结果表明七氟烷暴露后Notch信号通路过度激活,海马小胶质细胞激活增加,炎症细胞因子mRNA表达上调。这些结果提示Notch信号通路可能是使小胶质细胞极化至M1状态的促炎信号分子。
醒脑静是从传统中药安宫牛黄丸中提取的水溶性注射液,主要用于神经外科患者的脑保护。部分动物研究发现醒脑静注射液通过抗炎途径对脑缺血/再灌注损伤具有保护作用[19,49]。然而,它是否在七氟烷引起的POCD中发挥作用仍不清楚。本研究结果发现醒脑静注射液可以通过减轻海马神经炎症和神经干细胞增殖功能障碍来改善七氟烷所致的认知功能障碍,其机制可能与抑制七氟烷诱导的Notch信号通路过度激活有关。但醒脑静作为一种中成药,成分复杂,本研究未对其具体成分展开分析,后续研究应探讨何种单体成分在其中发挥具体作用。
综上所述,本研究结果发现醒脑静注射液通过抑制Notch1/Hes1通路,减轻了七氟烷诱导的海马神经炎症和神经干细胞增殖功能障碍,改善成年小鼠认知功能障碍。因此,该注射液有望成为临床预防七氟烷致POCD的一种新的治疗方法。

