lncRNA SH3BP5-AS1在肝癌中的差异表达及促进肝癌发生机制
徐 东,陆欢华,王晓亮,吴伟新
肝细胞癌(hepatocellular carcinoma, HCC)是目前常见的恶性肿瘤之一,病死率高,且该病的发病率和病死率呈现稳步上升趋势[1]。手术切除是治疗肝癌最有效的治疗方法,但高复发率、早期远处转移及对化疗和放疗的频繁抵抗导致预后不良[2]。因此,寻找有效的生物标志物对肝癌的早期发现和预后改善具有重要意义。长非编码RNA(long non-coding RNAs, lncRNAs)是一类位于细胞核或细胞质中,长度超过200 bp的核苷酸[3]。已经证实lncRNAs可以调节大脑发育、胚胎发育、组织分化和器官发生等[4-5]。最近的研究[6]表明,lncRNAs也参与了癌症中许多复杂的细胞过程。如SH3BP5-AS1在头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)中异常表达。然而,SH3BP5-AS1在肝癌发生发展中的作用尚不清楚。该研究旨在探讨SH3BP5-AS1在肝癌中的表达特点并分析其对人肝癌细胞株Hep 3B和Huh 7细胞增殖、凋亡、周期的影响。
1 材料与方法
1.1 组织样本与主要试剂
1.1.1病例资料与实验细胞 从在复旦大学附属中山医院青浦分院接受肝切除术的患者中收集了总共91对肝癌和肿瘤邻近组织。所有肝癌患者均未接受任何术前治疗,如射频消融、经导管动脉化疗栓塞、免疫治疗和靶向治疗。组织样本由2名组织病理学专家确认。所有样品立即在液氮中速冻,随后储存在-80 ℃用于RNA提取。正常肝细胞THLE-2和肝癌细胞系Huh 7、BEL-7405、SNU-387和Hep 3B均购自中科院上海细胞库。
1.1.2主要试剂 TRIzol试剂和RevertAid First Strand cDNA Synthesis Kit试剂盒购自美国麻省Thermo Fisher公司;SYBR® Premix Ex TaqTMⅡ购自大连宝生物公司;CCK-8、BeyoClickTMEdU-488细胞增殖检测试剂盒、FITC-Annexin V凋亡检测试剂盒和cycle TEST PLUS DNA试剂盒购自上海碧云天生物公司。引物序列合成购自深圳华大基因公司。
1.2 方法
1.2.1qRT-PCR法检测SH3BP5-AS1和跨膜蛋白6超家族成员2 (transmembrane 6 superfamily member 2, TM6SF2)在肝癌组织/细胞中表达 TRIzol试剂用于从HCC组织和培养细胞中分离总RNA。使用RevertAid First Strand cDNA Synthesis Kit试剂盒将总RNA逆转录为cDNA。qRT-PCR分析使用SYBR® Premix Ex TaqTMⅡ在ABI PRISM 7300序列检测系统中进行。采用2-ΔΔCt法计算SH3BP5-AS1和TM6SF2表达,由GAPDH归一化相对基因表达。SH3BP5-AS1引物序列(F:5′-ATCAGGCTCAGGTTTGCTCC-3′;R:5′-AGGCTAGCAGGGTAGTCTTCA-3′);TM6SF2引物序列(F:5′-CCCTAAGGTGCAGATGCTGA-3′;R:5′-CACGGTAGGTGAAGGGTGTG-3′)。
1.2.2沉默SH3BP5-AS1表达 设计并合成两对SH3BP5-AS1特异性小干扰RNA(small interfering RNA, siRNA)序列,si-SH3BP5-AS1-1序列(F:5′GCUGUUUAAUGUUCUUAAAUA-3′;R:5′-UUUAAGAACAUUAAACAGCCG-3′);si-SH3BP5-AS1-2序列(F:5′-GGAGACUAAGUGAAGACUACC-3′;R:5′-UAGUCUUCACUUAGUCUCCUG-3′)。通过转染试剂Lipofectamine 3000 转染至对数期的Hep 3B细胞。培养48 h后通过qRT-PCR法检测SH3BP5-AS1沉默效率。基于TCGA数据库可视化软件UALCAN[6]分析。
1.2.3细胞增殖活性检测 ① CCK-8法:以每孔5 000个细胞的密度种植到96孔板后,10 μl CCK-8试剂加入到每个孔中,孵育2 h后,使用酶标仪测量450 nm 处的吸光度。检测时间点分别为细胞贴壁后的0、24、48、72 h。② 细胞克隆形成实验:将500个细胞种植到细胞培养6孔板中。持续培养直至出现可见克隆,除去培养基,并用4%多聚甲醛溶液将细胞固定30~60 min,用0.1%结晶紫染色,拍照并计数。③ 流式检测EdU法:将细胞培养在12孔板上48 h后,按照BeyoClickTMEdU-488细胞增殖检测试剂盒操作,添加100 mg/L EdU试剂,孵育2 h,并用DAPI试剂对细胞核染色5 min,细胞悬液样品进行流式检测并分析EdU+阳性细胞比例。
1.2.4流式检测细胞凋亡和细胞周期 胰蛋白酶法收获细胞。在FITC-Annexin V和碘化丙啶双重染色后,使用FITC-Annexin V凋亡检测试剂盒,通过流式细胞仪进行细胞凋亡检测。使用cycle TEST PLUS DNA试剂盒对细胞进行氧化丙啶染色后,通过流式细胞仪进行细胞周期检测,并通过FACScan软件进行分析。

2 结果
2.1 SH3BP5-AS1在肝癌中表达水平qRT-PCR结果显示SH3BP5-AS1在肝癌组织中相对表达量为(3.46±0.80),在癌旁组织中相对表达量为(1.62±0.74),其在临床肝癌组织中高表达(P<0.05,图1A)。基于TCGA数据库可视化软件UALCAN分析,结果表明SH3BP5-AS1在大样本肝癌组织(n=371)中高表达,且在肝癌临床分期Ⅰ、Ⅱ、Ⅲ中同样高表达(P<0.05,图1B)。细胞水平检测结果显示,相对于正常肝细胞THLE-2,SH3BP5-AS1在不同肝癌细胞系Huh 7、BEL-7405、SNU-387和Hep 3B中表达均不同程度升高(P<0.05,图1C)。
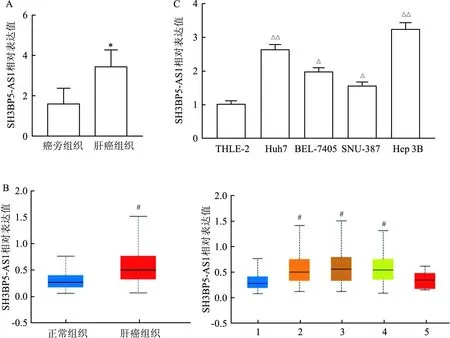
图1 SH3BP5-AS1在肝癌中表达水平
2.2 沉默SH3BP5-AS1表达效率检测Hep 3B细胞中,通过siRNA技术沉默SH3BP5-AS1表达后,qRT-PCR结果显示,SH3BP5-AS1在空白组中相对表达量为(1.02±0.09),在对照组中相对表达量为(0.98±0.05),在si-SH3BP5-AS1沉默组-1组中相对表达量为(0.16±0.03),在si-SH3BP5-AS1沉默组-2中相对表达量为(0.32±0.02),表达量分别降为之前的约1/6、1/3。沉默SH3BP5-AS1表达的Hep 3B细胞用于后续功能研究(P<0.01)。
2.3 沉默SH3BP5-AS1对Hep 3B细胞增殖的影响CCK-8结果显示,相较于对照组,si-SH3BP5-AS1沉默组-1和si-SH3BP5-AS1沉默组-2在48 h和72 h吸光度值(450 nm)均降低(P<0.05,图2A)。细胞克隆形成实验结果显示空白组、对照组、si-SH3BP5-AS1沉默组-1和si-SH3BP5-AS1沉默组-2细胞克隆数分别为(323.00±19.00)、(312.30±16.07)、(156.00±9.16)(F=111.80,P<0.05)和(181.70±15.63)(F=64.54,P<0.05)(图2B)。Edu结果显示空白组、对照组、si-SH3BP5-AS1沉默组-1和si-SH3BP5-AS1沉默组-2 Edu+阳性细胞比例分别为(25.42±1.20)、(25.85±0.77)、(14.69±1.13)(F=109.10,P<0.05)和(16.56±1.15)(F=73.76,P<0.05)(图2C)。以上结果均表明沉默SH3BP5-AS1具有抑制Hep 3B细胞增殖能力。
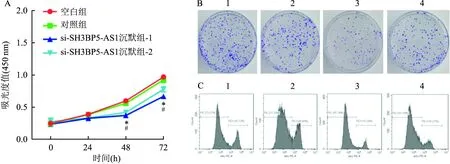
图2 沉默SH3BP5-AS1抑制Hep 3B细胞增殖作用
2.4 沉默SH3BP5-AS1对Hep 3B细胞凋亡的影响流式结果显示,空白组、对照组、si-SH3BP5-AS1沉默组-1和si-SH3BP5-AS1沉默组-2总细胞凋亡率分别为(12.77±0.80)、(13.58±0.63)、(26.47±0.82)和(23.56±1.47);与对照组比较,si-SH3BP5-AS1沉默组-1(F=31.25,P<0.05)和si-SH3BP5-AS1沉默组-2(F=26.06,P<0.05)总细胞凋亡率增加,差异有统计学意义(图3),结果表明沉默SH3BP5-AS1促进Hep 3B细胞凋亡能力。
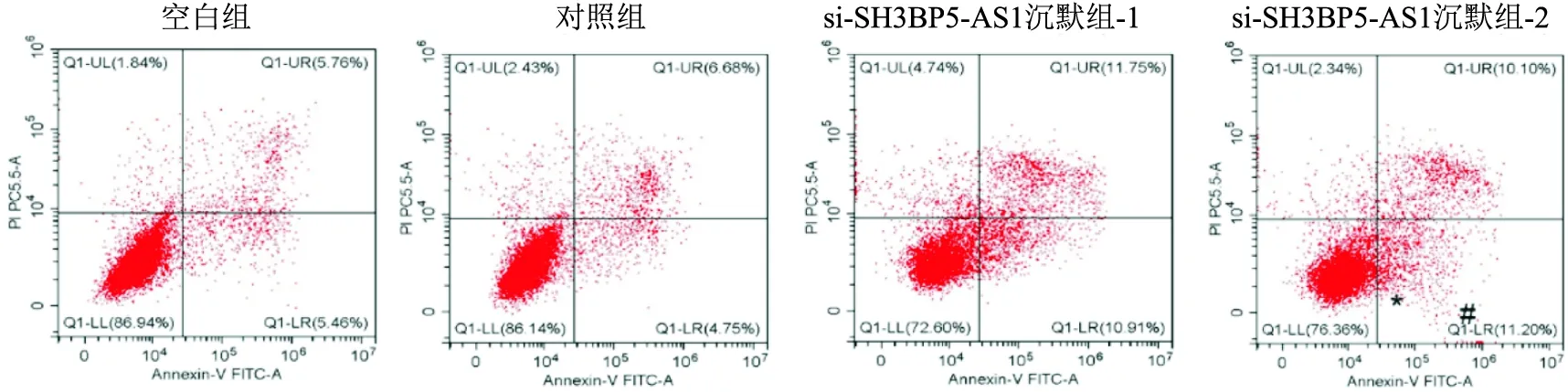
图3 沉默SH3BP5-AS1促进Hep 3B细胞凋亡作用
2.5 沉默SH3BP5-AS1对Hep 3B细胞周期影响流式结果显示空白组、对照组和SH3BP5-AS1沉默组处于G1期细胞的比例为(20.05±3.49)、(20.86±1.89)、(35.95±2.70)和(33.59±2.03)(P<0.05),处于S期细胞的比例为(22.68±7.52)、(24.74±1.09)、(27.29±6.98)和(30.17±10.55),处于G2期细胞的比例为(57.27±4.97)、(54.40±2.40)、(36.76±9.66)和(36.24±10.39)。见图4。结果表明,与对照组相比,沉默SH3BP5-AS1组G1期细胞增多。
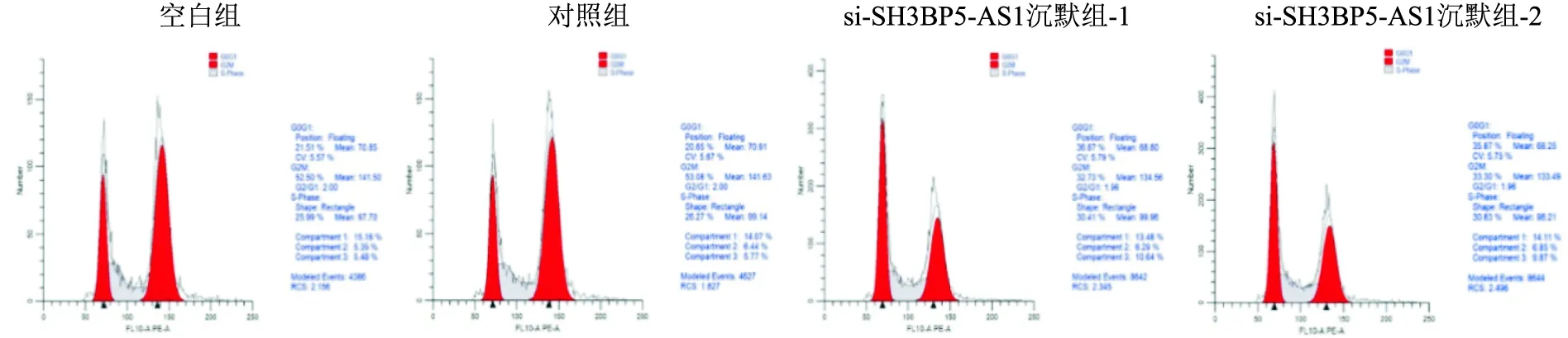
图4 沉默SH3BP5-AS1对Hep 3B细胞周期影响
2.6 SH3BP5-AS1和TM6SF2在肝癌组织中表达负相关qRT-PCR检测沉默SH3BP5-AS1细胞中TM6SF2的表达情况,结果显示,与对照组相比,沉默SH3BP5-AS1组中TM6SF2呈现高表达(P<0.05,图5A)。基于肝癌组织中SH3BP5-AS1和TM6SF2表达量,统计并分析表达相关性,结果显示两者在肝癌组织中表达负相关(R2=0.26,95%CI:-0.39~-0.19,P<0.05,图5B)。
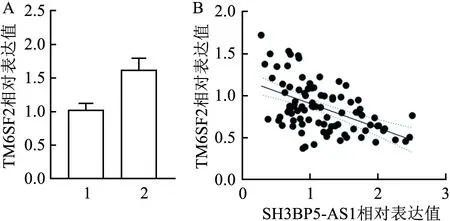
图5 SH3BP5-AS1和TM6SF2在肝癌组织中表达负相关
3 讨论
肝癌是全球第6大常见癌症,也是癌症相关死亡的主要原因之一。虽然目前肝癌的诊断和治疗已经取得了重大进展,但肝癌患者的长期生存率仍然很低。肝癌预后不良主要有两个原因:一是肿瘤复发;二是原发性肿瘤在剩余肝脏的发展/转移[7]。肿瘤转移是一个复杂的过程,涉及多种基因改变。越来越多的学者[8]开始关注肝癌发生和发展过程中多种因素的协同作用,包括miRNA、lncRNA和表观遗传因素等。在过去的几年中,诸多lncRNAs在肝癌发展/转移中的重要性已经被证实。Huang et al[9]研究表明lncRNA-MIAT通过吸附miR-214促进肝癌细胞的增殖和侵袭;Chao et al[10]研究表明lncRNA-D16366在大样本肝细胞癌患者组织和血清中含量较对照组明显降低,其表达受肿瘤大小、HbsAg、门静脉癌栓、Child-Pugh评分、治疗和肿瘤转移的影响,可作为HCC的独立诊断和预后指标。Lee et al[11]在针对79例肝癌患者的前瞻性研究中,表明外周血lncRNA-ATB与肝癌TNM分期及T分期、门静脉血栓形成等预后因素有关,表明lncRNA-ATB的升高是病死率和疾病进展的独立预测因子。
lncRNA SH3BP5-AS1是SH3BP5的反义转录本1,长度为5 592 bp。目前有关SH3BP5-AS1在肿瘤研究中较少,仅检索到的文献是Lina et al[6]在研究HNSCC中,应用加权基因共表达网络分析(WGCNA)对与HNSCC预后相关的lncRNAs共表达模块进行分析,结果表明SH3BP5-AS1可以作为HNSCC的独立预后因子,主要参与血管发育、分解代谢过程的正向调节和生长调节等生物学过程。该研究旨在探索SH3BP5-AS1在肝癌中的差异表达及其促进肝癌发生的可能机制。首先,基于收集到的临床肝癌样本,通过qRT-PCR定量检测SH3BP5-AS1表达量,结果显示其在肝癌组织中高表达;同时,通过TCGA数据库在线分析网站UALCAN,表明SH3BP5-AS1在大样本肝癌组织(n=371)中高表达;此外,细胞水平检测结果同样显示SH3BP5-AS1在不同肝癌细胞中高水平表达。以上均表明SH3BP5-AS1在肝癌中高表达,其在肝癌发生发展中发挥重要作用。为了研究SH3BP5-AS1在肝癌细胞中的潜在功能,该研究通过siRNA技术沉默SH3BP5-AS1表达,qRT-PCR结果显示设计的2个平行si-SH3BP5-AS1均是有效的,选择沉默效率更高的si-SH3BP5-AS1-1用于后续实验。
肿瘤细胞增殖活性与其生长、转移、复发和浸润等生物学行为及预后密切相关[12]。该研究通过CCK-8、细胞克隆形成实验和Edu方法检测si-SH3BP5-AS1后Hep 3B的增殖,结果一致表明,沉默SH3BP5-AS1抑制肝癌细胞增殖能力。细胞凋亡,也称为程序性细胞死亡,是在特定时间段内活跃发生的基因调控的细胞死亡过程。该研究结果显示沉默SH3BP5-AS1促进Hep 3B细胞凋亡能力。细胞凋亡是细胞生长分化调节的重要手段,又是机体免受肿瘤危害的重要保护机制,癌变了的细胞发生凋亡的能力通常极低,而增殖能力则相应增强,这直接导致了瘤细胞快速而病态地分裂增殖[13],表明SH3BP5-AS1可能通过抑制凋亡促进肿瘤生长。在肿瘤中,常见调节细胞周期机制和频率元件的错乱反映出异常的细胞周期对肿瘤恶性增殖表型的重要性[14]。该研究结果显示,沉默SH3BP5-AS1组G1期细胞增多,说明沉默SH3BP5-AS1可能将肝癌细胞阻断在DNA合成前期,从而抑制细胞增殖。
TM6SF2主要表达于与载脂蛋白B(APOB)-脂蛋白产生相关的组织中,包括肝脏、小肠和肾脏,提示在脂蛋白代谢中可能发挥作用。该课题组前期研究[15]表明TM6SF2在肝癌中表达降低,该研究表明TM6SF2在沉默SH3BP5-AS1肝癌细胞中高表达,且基于肝癌组织中SH3BP5-AS1和TM6SF2两者表达负相关,提示SH3BP5-AS1可能基于TM6SF2发挥作用。
综上所述,该研究表明SH3BP5-AS1是一个重要的促癌非编码RNA。该研究可为肝癌患者的肿瘤靶向治疗提供理论基础。

