粘质沙雷氏菌高产发酵灵菌红素的工艺优化及抗病毒活性
葛 明,冯 佳,李 莹,焦裕冰,申莉莉,王凤龙,李 斌,李文刚,刘东阳,王 勇,江连强,张明金,闫芳芳,杨 宇*,杨金广*
粘质沙雷氏菌高产发酵灵菌红素的工艺优化及抗病毒活性
葛 明1,冯 佳1,李 莹1,焦裕冰1,申莉莉1,王凤龙1,李 斌2,李文刚2,刘东阳3,王 勇3,江连强3,张明金4,闫芳芳5,杨 宇5*,杨金广1*
(1.中国农业科学院烟草研究所,青岛 266101;2.四川省烟草公司,成都 610017;3.四川省烟草公司凉山州公司,四川 西昌 615000;4.四川省烟草公司泸州市公司,四川 泸州 646000;5.四川省烟草公司攀枝花市公司,四川 攀枝花 617000)
为提高粘质沙雷氏菌S3菌株的灵菌红素产率,本研究对粘质沙雷氏菌S3发酵过程中重要的发酵条件参数和关键组分进行逐项优化,并验证了发酵液灵菌红素提取物对本氏烟草病毒的抑制效果。结果表明,最佳培养基配方为:丙三醇0.5%,蛋白胨1.5%,氯化钠0.5%,氯化钾0.25%;最佳发酵条件为:接种量为10%,装液量为60%~70%,pH恒定为6.0,培养温度为28 ℃,振摇速度160 r/min,发酵周期为60 h。在该发酵条件下,既有利于粘质沙雷氏菌菌体生长,又能够使灵菌红素的产量达到最大化。按照该优化条件进行发酵后,其灵菌红素提取物溶液喷施于接种TMV、CMV和PVY的本氏烟,烟叶中TMV、CMV和PVY病毒量分别为空白对照的12.61%、29.41%和17.69%,对病毒的抑制效果优于氨基寡糖素。试验所得的发酵制备条件能够提高灵菌红素产量,提取物具备显著抗病毒特性,具有产业化开发潜力和经济应用价值。
粘质沙雷氏菌;灵菌红素;发酵条件优化;植物抗病毒剂
灵菌红素(Prodigiosin)是由粘质沙雷氏菌()及其他多种细菌产生的一种天然次生代谢产物,其中粘质沙雷氏菌产生的灵菌红素的生物活性较好[1]。灵菌红素具有3个吡咯组成的甲氧基吡咯骨架,几乎不溶于水,但易溶于极性较大的有机溶剂,在不同pH条件下呈现不同的颜色[2]。近年来研究表明,灵菌红素在抗细菌[3]、抗病毒[4]、抗真菌[5]、免疫调控[6]以及纯天然工业染料[7]等方面具有广阔的应用潜力。本实验室已初步揭示了灵菌红素可以诱导寄主植物产生抗病毒特性[8],激活农作物抗病毒免疫调控。
目前,灵菌红素可以通过化学合成法[5]和微生物发酵法[9]制备。然而化学合成法相对困难,反应步骤复杂,产率低,难以实现大规模生产;而目前国内对灵菌红素发酵过程的研究主要使用摇瓶培养,对发酵罐发酵过程研究较少[10]。在发酵过程中,次级代谢产物的合成不仅受制于碳氮源的快速消耗及其分解产物的积累[11],还受磷酸盐等的调节。对次级代谢产物合成途径的调控,最终要归结到发酵培养基以及培养条件的调控上。通过对这些因素的调控,以最大限度地调节代谢向合成产物方向进行,实现高产的目的。
烟草花叶病毒(TMV)、黄瓜花叶病毒(CMV)和马铃薯Y病毒(PVY)是危害烟草、马铃薯、番茄、辣椒等茄科作物的常见病毒,尤其对烟草等主要经济作物的生产造成极大危害且难以防治[12],然而,目前低毒、高效、低残留的天然抗病毒药剂的选择仍然较少[13]。
在前期研究的基础上,本研究对粘质沙雷氏菌S3摇瓶发酵生产灵菌红素的发酵条件和发酵液组分进行优化,确定最佳发酵液组分和发酵培养参数,为灵菌红素的高产工业化提供试验基础;同时对灵菌红素抗病毒活性进行初步验证,结合农业产业化需求,以最大经济性实现粘质沙雷氏菌S3的灵菌红素产量和抗病毒活性的双重提升。
1 材料与方法
1.1 材料
供试菌株-S3(GenBank:MK411566.1)由中国农业科学院烟草研究所植保中心病毒实验室获得并保存。已完成对该菌株的形态学观察、生理生化鉴定、16S rDNA鉴定[14]。
供试烟草:本氏烟(),由中国农业科学院烟草研究所植保中心病毒实验室提供。
病毒毒源:TMV、CMV、PVY毒源植株均保存于中国农业科学院烟草研究所植保中心病毒实验室。
平板培养基:LB固体培养基;种子培养基:牛肉膏0.5%,蛋白胨1.5%,氯化钠0.5%,超纯水97.5%;发酵培养基:按照1.2.5试验结果对种子培养基进行改进。
主要试剂:牛肉膏、葡萄糖、氯化钠、氯化镁、氯化钾、丙三醇、油酸及蔗糖购于国药集团化学试剂有限公司;蛋白胨及吐温80购于Sigma-Aldrich贸易有限公司;酵母粉购于北京奥博星公司;LB肉汤、琼脂粉购于北京索莱宝科技有限公司。
1.2 方法
1.2.1 培养方法 取保存于−80 ℃的粘质沙雷氏菌菌株,在LB固体平板培养基上过夜活化后,挑取单菌落分别置于装有50 mL种子培养基的100 mL三角瓶中,28 ℃,160 r/min条件下培养24 h,得到种子液。向发酵培养基加入体积总量10%的种子液,在28 ℃,pH 6.0,160 r/min条件下发酵60 h。
1.2.2 菌体生物量测定 取20 mL发酵液装入已知质量的50 mL离心管中,10 000 r/min离心20 min,弃上清,用蒸馏水洗涤后再离心,重复2次,余下的湿菌体置于80 ℃烘箱中烘干至恒重,测菌体干质量。
1.2.3 灵菌红素含量测定 采用比色法测定,取发酵液0.5 mL,加入酸性甲醇(pH 3.0)4.5 mL,混合均匀,静置30 min萃取胞内色素,离心后取上清液检测吸光度534[2],用以表示灵菌红素产量。
1.2.4 培养条件的优化 依次进行以下条件的优化,每次都将上一优化结果应用于下一因素的优化。光照强度:0、100、500、1000 cd;pH值:4.0、5.0、6.0、7.0、8.0;温度:22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃;振摇速度:0、60、100、160、180、200 r/min。发酵60 h后,测定每组发酵液中菌体干质量和灵菌红素产量。
1.2.5 培养基成分的优化 在初始发酵培养基和已优化因素的基础上,对最佳碳源、氮源、无机盐种类进行优选。碳源:0.5%的葡萄糖、蔗糖、丙三醇和牛肉膏;氮源:1%的无机氮源物质硫酸铵、氯化铵和有机氮源物质蛋白胨、酵母粉、尿素;无机盐:0.2%的MgCl2、CaCl2、KCl、MgSO4。发酵60 h后,测定每组发酵液中菌体干质量和灵菌红素产量。
1.2.6 灵菌红素的获取 将粘质沙雷氏菌发酵液和乙酸乙酯按照1∶1体积混合,期间多次搅拌,加速灵菌红素的萃取;乙酸乙酯处理发酵液2~3 d后,取红色上清(滤去不溶性杂质)至旋转蒸发仪上进行蒸发,得到灵菌红素粗提物[15],再通过层析纯化获得灵菌红素精提物。
1.2.7 抗病毒活性的测定 取新鲜毒源叶片研磨匀浆后,在本氏烟叶片上摩擦接种病毒,24 h后用浓度为10 μg/mL的灵菌红素溶液喷释植株,等量去离子水和10 μg/mL的氨基寡糖素溶液分别作为空白对照和阳性对照。72 h后提取系统叶总RNA,反转录[16],进行qRT-PCR进行病毒量的检测,以测定抗病毒活性。
1.3 数据分析
试验数据采用SPSS 19.0软件进行统计分析,应用Kruskal-Wallis t检验进行差异显著性分析,并使用GraphPad Prism 8制作图表。
2 结 果
2.1 发酵条件对灵菌红素的影响
2.1.1 光照强度对灵菌红素产量的影响 由图1可知,光照强度对粘质沙雷氏菌体的生长没有显著影响,但是对灵菌红素的产量影响显著。无光照时灵菌红素的产量最多,534为0.443。随着光照强度的增加,灵菌红素的产量不断下降,光照越强下降的比例越大。
2.1.2 pH对灵菌红素产量的影响 由图2可知,粘质沙雷氏菌体质量和灵菌红素产量都随着初始pH的变化而发生变化,当pH值为6.0时两者的量均达到最大值,菌体干质量浓度为1.906 g/L,534达0.416。因此,pH 6.0是粘质沙雷氏菌高产灵菌红素的最优pH。
2.1.3 培养温度对灵菌红素产量的影响 由图3可知,培养温度在22~32 ℃的范围内,随着温度的上升粘质沙雷氏菌体质量和灵菌红素产量均先增多后减少。菌体干质量浓度在培养温度为30 ℃时最大为1.934 g/L;灵菌红素产量在温度为28 ℃时最高,534为0.413。
2.1.4 振摇速度对灵菌红素产量的影响 由图4可知,速度在0~200 r/min范围内变化时,随着振摇速度增大,粘质沙雷氏菌生长速度加快,菌体富集增多;然而其合成的次级代谢产物灵菌红素产量先随振摇速度的加快而增多,但是继续增快时,发酵液中次级代谢产物的产量减少。由于本试验的目的在于后期分离纯化灵菌红素,因此要选择最适代谢灵菌红素的发酵条件,故最佳振摇速度为160 r/min。
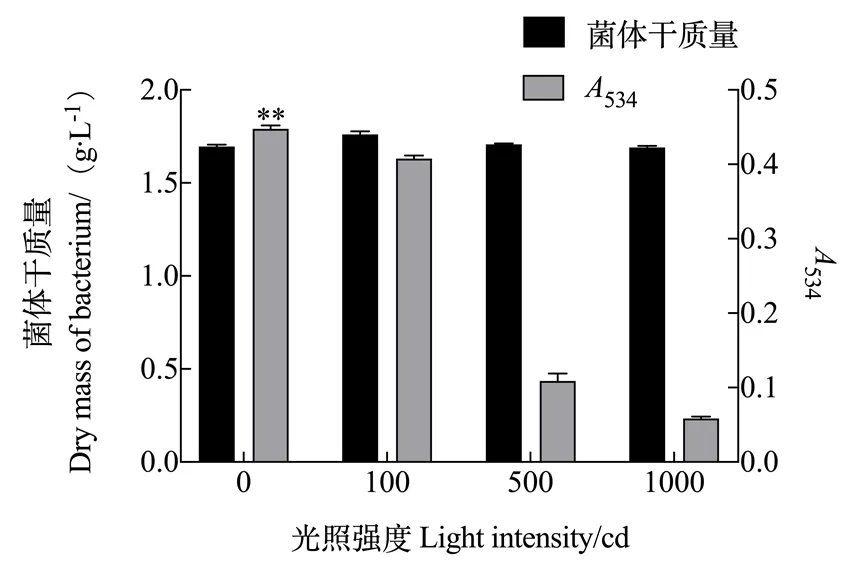
注:误差线表示3组重复的标准差,**表示差异显著(p<0.05)。下同。
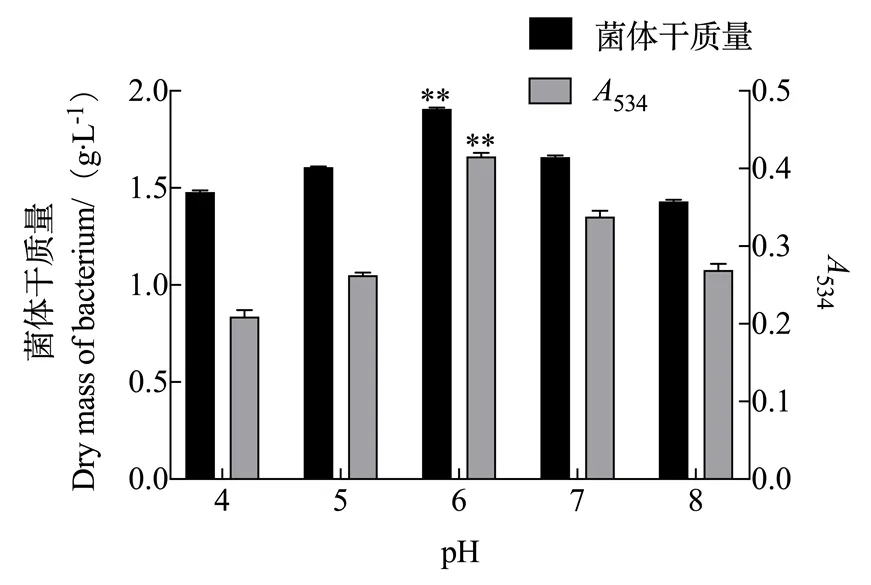
图2 pH对灵菌红素产量的影响
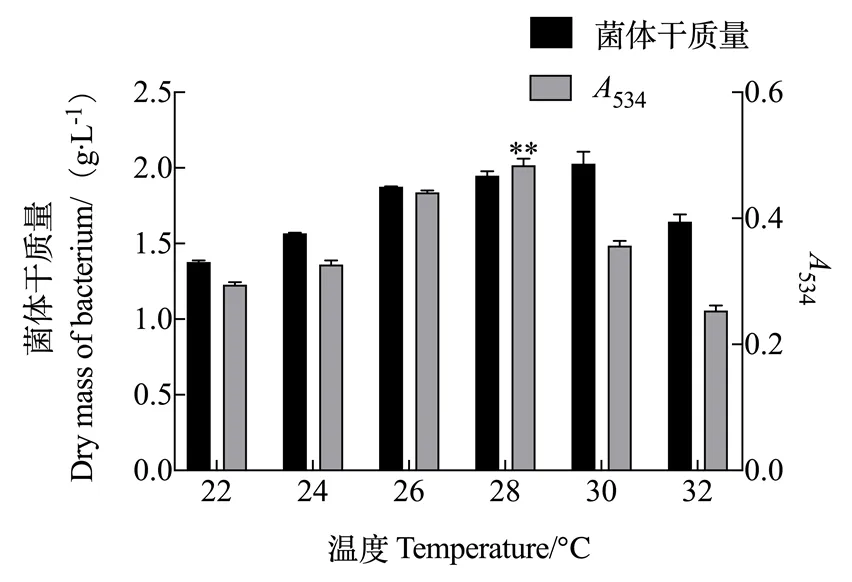
图3 温度对灵菌红素产量的影响
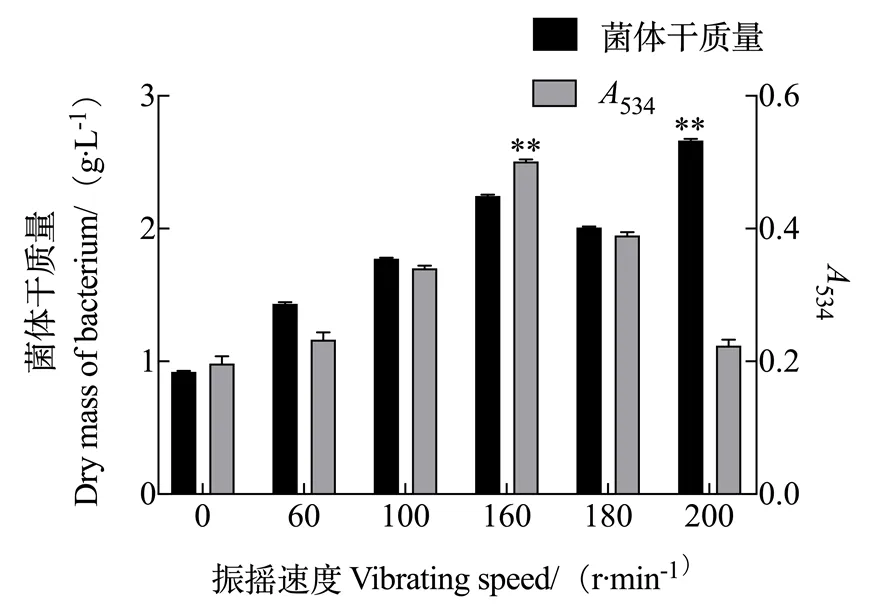
图4 振摇速度对灵菌红素产量的影响
2.2 发酵液组分的优化
2.2.1 碳源对灵菌红素产量的影响 由图5可知,粘质沙雷氏菌发酵的过程中,以丙三醇为碳源物质时灵菌红素的产量最高,534为0.943。当选择牛肉膏作为碳源物质时,虽然粘质沙雷氏菌菌体质量增长显著,但严重限制了灵菌红素的合成。因此根据试验的结果,将丙三醇定为粘质沙雷氏菌发酵合成灵菌红素的最佳碳源物质。
2.2.2 氮源对灵菌红素产量的影响 由图6可知,添加无机氮源硫酸铵和氯化铵时,粘质沙雷氏菌的干质量和灵菌红素的产量均较少;将无机氮源换成有机氮源时,灵菌红素的产量有显著增加,尤其是添加蛋白胨时灵菌红素的产量最高,534达到了0.964。添加酵母粉后,虽然菌体质量达到了最大值,但菌体生长过于迅速,抑制了灵菌红素合成。因此,蛋白胨是粘质沙雷氏菌发酵高产灵菌红素最合适的氮源物质。
2.2.3 无机盐对灵菌红素产量的影响 由图7可知,当以无机盐作为单因素时,分别添加MgCl2、CaCl2、KCl、MgSO4四种不同无机盐时,灵菌红素的产量均不同程度增加,说明Mg2+、Ca2+、K+均能起到促进灵菌红素合成的作用,并且其中促进作用最为显著的是K+,同时粘质沙雷氏菌菌体的生长量也有所增加。根据上述结果,为了得到高产量的灵菌红素,粘质沙雷氏菌S3发酵培养基需要添加无机盐KCl起到促进作用。
2.3 灵菌红素的抗病毒活性
如图8所示,分别接种TMV、CMV和PVY后,灵菌红素提取物处理组的病毒含量与空白对照组相比均非常低,TMV、CMV和PVY的病毒积累量分别是空白对照的12.61%、29.41%和17.69%,差异显著,抑制效果优于氨基寡糖素。可见,灵菌红素对TMV、CMV和PVY的侵染复制具有较强的抑制作用,说明喷施灵菌红素溶液对烟草病毒病有较好的防治潜力。
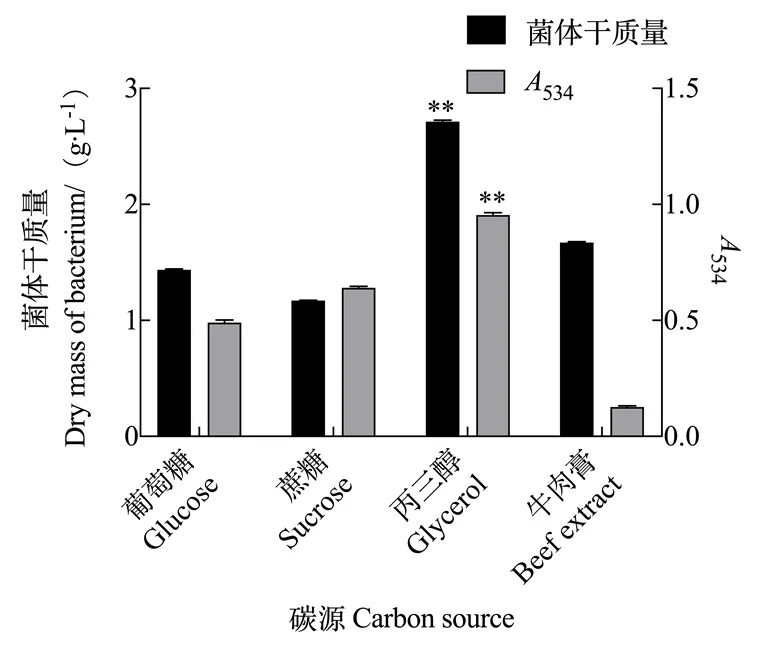
图5 碳源对灵菌红素产量的影响
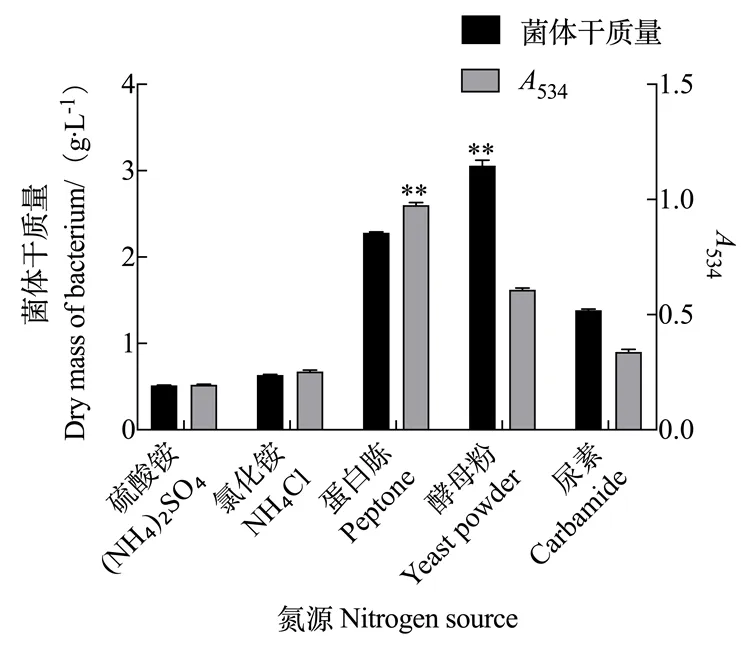
图6 氮源对灵菌红素产量的影响
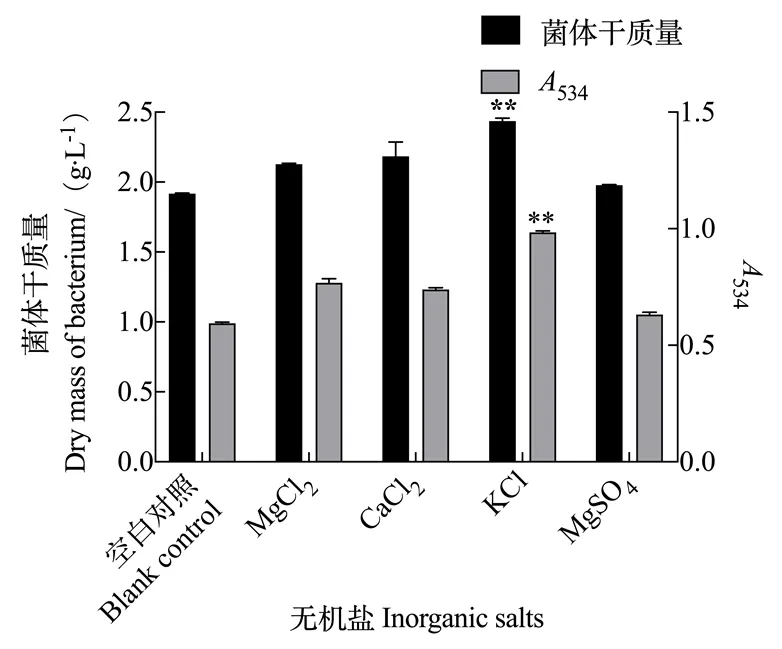
图7 无机盐对灵菌红素产量的影响
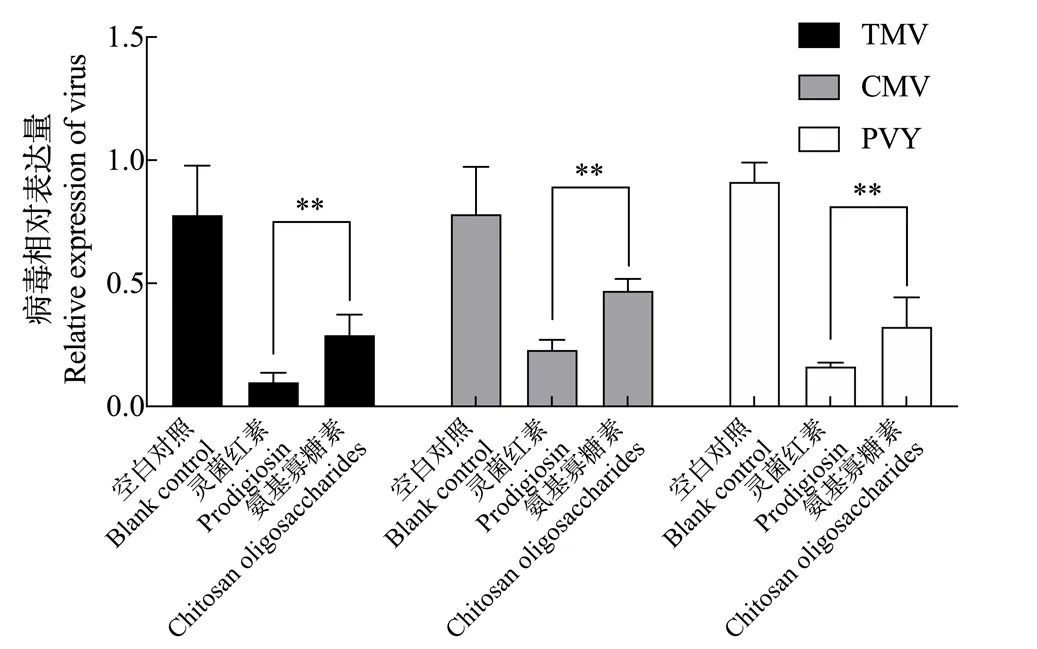
图8 灵菌红素的抗病毒效果
3 讨 论
在动物病毒病防治应用研究中,灵菌红素主要通过改变细胞内pH[17]、阻断细胞自噬[18]、裂解DNA分子[19]等多种方式抑制多种病毒感染、增殖。本研究证明了灵菌红素可以有效抑制烟草病毒病的侵染和复制。在国际市场上,灵菌红素制剂价格高昂,生物合成效率较低,应用成本较高,这是其难以在医学和农业领域进行推广的主要因素。特异性产生灵菌红素的粘质沙雷氏菌S3菌株的稳定生长代谢是高通量获得灵菌红素的保障。
光照能促进多种微生物和植物的生长、繁殖和运动等生命活动,但相关文献表明灵菌红素对光敏感,光照不利于其合成[20]。发酵过程中有光照射会使得灵菌红素的产量大幅度减少,表明粘质沙雷氏菌的发酵应尽量避光。pH的变化影响着机体的代谢和生长繁殖,粘质沙雷氏菌的生长过程会改变发酵液pH,从而使灵菌红素合成受阻[9],因此在培养过程中要不断调节发酵液的pH,以保持pH的恒定。温度是影响微生物生命活动的重要因素,在粘质沙雷氏菌发酵过程中保持适合的培养温度,有利于缩短其发酵周期和提高灵菌红素产量。本研究中粘质沙雷氏菌发酵产灵菌红素的适宜温度为28 ℃,这与已报道的粘质沙雷氏菌产灵菌红素的最佳发酵温度28 ℃一致[21-22]。微生物发酵工艺过程中,摇瓶转速直接影响发酵基质的传递和微生物对营养物质的利用,并且在一定水平上影响着发酵液中的溶氧程度[20],最终决定发酵生产能力和产品质量。本试验发现,摇瓶发酵时振摇速度在160 r/min时有利于菌体的代谢生长,为工业化高产灵菌红素提供帮助。
微生物的生长繁殖和发酵产物的合成都需要碳源和氮源物质。价格更为低廉的碳源有利于在工业化生产灵菌红素的过程中降低成本。适量添加的丙三醇在提高灵菌红素的产量方面具有一定优势,且不会漂浮在发酵液上方阻碍气体交换[23]。微生物发酵使用的氮源分为有机氮源和无机氮源。无机氮源成分单一,质量较稳定,可被快速利用;有机氮源营养丰富,因而微生物在含有机氮源的培养基中常表现出生长旺盛、菌体浓度增长迅速等特点[24]。灵菌红素的基本分子结构是三个吡咯环[2],其合成原料来源于氨基酸。无机盐具有很多生理作用,如组成组织和细胞的结构,有些为无机或有机化合物以构成酶的辅基、激素、维生素、蛋白质和核酸的成分,或作为多种酶系统的激活剂,参与许多重要的生理功能,并且无机盐离子参与调节细胞膜的通透性,确保渗透压水平正常以及pH值稳定[25]。通过试验,我们确定产灵菌红素的粘质沙雷氏菌最佳发酵液成分为丙三醇、蛋白胨、氯化钠、氯化钾。
研究结束后,在生产工厂按照本研究优化后的发酵培养条件在50 L-5 T发酵罐中进行了发酵,发现可有效提高灵菌红素的产量,相较于报道的500~2000 mg/L的灵菌红素产率[26]也维持在较高水平。由于粘质沙雷氏菌属于兼性厌氧菌,因此发酵液溶氧值建议溶氧探头实时监控,保持微量通气即可。pH可用pH探头实时监控,并通过发酵系统软件恒定为pH 6.0。发酵温度控制在28 ℃,罐内搅拌转速保持在160 r/min。
随着人们食品安全意识的提高和环保观念的增强,现代农业更加关注农药应用导致的健康损害以及环保问题[27],重污染的化学农药逐渐退出市场,需要低毒、高效、低残留的天然农药不断推陈出新。作为一种新型的植物免疫诱抗剂,灵菌红素生产成本的降低不但有利于其抗病毒活性的基础研究,更有巨大的市场推广潜力。
4 结 论
本研究确定粘质沙雷氏菌S3制备灵菌红素的最佳发酵培养基为:丙三醇、蛋白胨、氯化钠、氯化钾、吐温-80质量分数分别为0.5%、1.5%、0.5%、0.25%、0.3%;发酵工艺参数为:接种量10%,装液量60%~70%,发酵周期60 h,培养温度28 ℃,振摇速度160 r/min。优化后的发酵培养基和发酵条件可有效提高灵菌红素的产量,对于规模化制备灵菌红素具有重要指导意义。
[1] HEJAZI A, FALKINER F R. Serratia marcescens[J]. Journal of Medical Microbiology, 1997, 46(11): 903-912.
[2] 傅奇. 灵菌红素产生菌的筛选鉴定及其发酵条件优化[D]. 南昌:南昌大学,2011:1-3.
FU Q. Screening and identification of a prodigiosins-producing strain and optimization of its fermentation conditions[J]. Nanchang: Nanchang University, 2011: 1-3.
[3] BLAPENDA J C, SILVA P A, VICALVI M C, et al. Antimicrobial activity of prodigiosin isolated from Serratia marcescens UFPEDA 398[J]. World Journal of Microbiology&Biotechnology, 2015, 31: 399-406.
[4] KUIVANEN S, BESPALOV M M, NANDANIA J, et al. Obatoclax, saliphenylhalamide and gemcitabine inhibit Zika virus infection in vitro and differentially affect cellular signaling, transcription and metabolism[J]. Antiviral Research, 2017, 139: 117-128.
[5] NISHA, KUMAR K, KUMAR V. Prodigiosin alkaloids: recent advancements in total synthesis and their biological potential[J]. RSC Advances, 2015, 5(15): 10899-10920.
[6] DERHOLM S, ANASTASINA M, ISLAM M M, et al. Immuno-modulating properties of saliphenylhalamide, SNS-032, obatoclax, and gemcitabine[J]. Antiviral Research, 2016, 126: 69-80.
[7] CHAUHAN K, DALSANIYA P, PATHAK H. Optimization of prodigiosin-type biochrome production and effect of mordants on textile dyeing to improve dye fastness[J]. Fibers & Polymers, 2015, 16(4): 802-808.
[8] 毕建华,杨金广,欧阳明安,等. 黏质沙雷氏菌次生代谢物对TMV的抑制机理[J]. 中国农业科学,2014,47(5):912-922.
BI J H, YANG J G, OUYANG M A, et al. Secondary metabolites produced by Serratia marcescens as an inhibitor against TMV[J]. Scientia Agricultura Sinica, 2014, 47(5): 912-922.
[9] WILLIAMSON N R, FINERAN P C, LEEPER F J, et al. The biosynthesis and regulation of bacterial prodiginines[J]. Nature Reviews Microbiology, 2006, 4(12): 887-899.
[10] 陈艳,谌颉,张佑红,等. 灵菌红素分批发酵过程的溶氧和补料调控[J]. 化学与生物工程,2015(8):56-59.
CHEN Y, CHEN J, ZHANG Y H, et al. Regulation of dissolved oxygen and replenishment in the wholesale fermentation process of prodigiosin[J]. Chemical & Bioengineering, 2015(8): 56-59.
[11] DEUTSCHER J. The mechanisms of carbon catabolite repression in bacteria[J]. Current Opinion in Microbiology, 2008, 11(2): 87-93.
[12] TILMAN D, CASSMAN K G, MATSON P A, et al. Agricultural sustainability, and intensive production practices[J]. Nature, 2002, 418(6898): 671-677.
[13] STANKOVIC N, SENEROVIC L, ILIC-TOMIC T. Properties and applications of undecylprodigiosin and other bacterial prodigiosins[J]. Applied Microbiology Biotechnology, 2014, 98(9): 3841-3858.
[14] QIN Y, WANG J, YANG J, et al. Purification and characterization of a secretory alkaline metalloprotease with highly potent antiviral activity fromstrain S3[J]. Journal of Agricultural and Food Chemistry, 2019, 67: 3168-3178
[15] 毕建华. 黏质沙雷氏菌次生代谢物对TMV的抑制机理研究[D]. 北京:中国农业科学院,2014.
BI J H. Secondary metabolites produced byas an inhibitor against TMV[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[16] 张万红,冯佳,杨金广,等. 山东烟区首次发现番茄斑萎病毒侵染[J]. 中国烟草科学,2020,41(5):87-91.
ZHANG W H, FENG J, YANG J G, et al. The infection of TSWV was first found in shandong tobacco growing areas[J]. Chinese Tobacco Science, 2020, 41(5): 87-91.
[17] CHAMPA D, ORLACCHIO A, PATEL B, et al. Obatoclax kills an aplastic thyroid cancer cells by inducing lysosome neutralization and necrosis[J]. Oncotarget, 2016, 7(23): 4453-34471.
[18] YU L, WU W K, GU C, et al. Obatoclax impairs lysosomal function to block autopHagy in cisplatin-sensitive and-resistant esopHageal cancer cells[J]. Oncotarget, 2016, 7(12): 14693-14707.
[19] DARSHAN N, MANONMANI H K. Prodigiosin and its potential applications[J]. International Journal of Food Science and Technology, 2015, 52(9): 5393-5407.
[20] SHAHITHA S, POORNIMA K. Enhanced production of prodigiosin production in[J]. Journal of Pharmaceutical Sciences, 2012, 2: 138-140.
[21] 王春玲. 灵菌红素生物合成与分离纯化研究[D]. 合肥:合肥工业大学,2004:24-26.
WANG C L. The biosynthesis and purification of prodigiosin[D]. Hefei: Hefei University of Technology, 2004: 24-26.
[22] 韦凤. 产灵菌红素粘质沙雷氏菌发酵条件优化及色素性质的研究[D]. 金华:浙江师范大学,2012:11-12.
WEI F. Studies on fermentation optimization and pigments' qualities of prodigiosins production Serratia marcescens[D]. Jinhua: Zhejiang Normal University, 2012: 11-12.
[23] 占剑峰. 磷脂酶A1的发酵制备、分离纯化及催化特性的研究[D]. 合肥:合肥工业大学,2013:32-34.
ZHAN J F. Study on production, purification and catalytic characterization of phospholipase A1[D]. Hefei: Hefei University of Technology, 2013: 32-34.
[24] 沈萍,陈向东,卫扬保. 微生物学[M]. 北京:高等教育出版社,2009.
SHEN P, CHEN X D, WEI Y B. Microbiology[M]. Beijing: Higher Education Press, 2009.
[25] 赵春海,阚振荣. 无机盐及微量元素对乙酰乳酸脱羧酶发酵活力的影响[J]. 中国酿造,2005(6):8.
ZHAO C H, KAN Z R. Effects of inorganic salts and trace elements on the fermentation of α-Acetolactate decarboxylase[J]. China Brewing, 2005(6): 8.
[26] 张丹峰,杨培周,操丽丽,等. 粘质沙雷氏菌摇瓶发酵产灵菌红素的工艺优化[J]. 食品科学,2015,36(13):119-124.
ZHANG D F, YANG P Z, CAO L L, et al. Optimization of shake flask cultivation conditions for prodigiosin production by[J]. Food Science, 2015, 36(13): 119-124.
[27] 王红. 转型期农药市场发展的影响因素与趋势分析[J]. 新农业,2021(17):86-87.
WANG H. Analysis of the factors and trends affecting the development of the pesticide market during the transition period[J]. New Agriculture, 2021(17): 86-87.
Process Optimization and Antiviral Activity of High Yielding Prodigiosin from
GE Ming1, FENG Jia1, LI Ying1, JIAO Yubing1, SHEN Lili1, WANG Fenglong1, LI Bin2, LI Wengang2, LIU Dongyang3, WANG Yong3, JIANG Lianqiang3, ZHANG Mingjin4, YAN Fangfang5, YANG Yu5*, YANG Jinguang1*
(1. Institute of Tobacco Research of CAAS, Qingdao 266101, China; 2. Sichuan Province Company of China Tobacco Corporation, Chengdu 610017, China; 3. Liangshan Prefecture Company of Sichuan Tobacco Corpoation, Xichang, Sichuan 615000, China; 4. Luzhou City Company of Sichuan Tobacco Corpoation, Luzhou, Sichuan 646000, China; 5. Panzhihua City Company of Sichuan Tobacco Corpoation, Panzhihua, Sichuan 617000, China)
In order to improve the yield of prodigiosin in the industrial fermentation of-S3, the important fermentation condition parameters and key components of the fermentation broth of-S3 were optimized, and the inhibitory effect of the extracts of fermentation broth on viral diseases was verified. The results showed that the best medium formulation was: 0.5% of glycerol, 1.5% of peptone, 0.5% of sodium chloride and 0.25% of potassium chloride. The optimal fermentation conditions were: 10% inoculum, 60%-70% loading, constant pH of 6.0, incubation temperature of 28 ℃, stirring speed of 160 r/min, and 60 h fermentation cycle, which not only facilitated the growth of-S3, but also maximized the production of prodigiosin. After fermentation under the optimized conditions, the extract solution of prodigiosin was sprayed oninoculated with TMV, CMV and PVY, and the amount of TMV, CMV and PVY viruses in leaves was 12.61%, 29.41% and 17.69% of that in the blank control, respectively. The inhibitory effect on viruses was better than that of chitosan oligosaccharide. The fermentation conditions obtained from this study can improve the yield of prodigiosin, and the extracts have significant antiviral property, which has the potential for industrial development and economic application value.
; prodigiosin; optimization of fermentation conditions; plant antiviral agent
S435.72
A
1007-5119(2022)03-0020-06
10.13496/j.issn.1007-5119.2022.03.004
山东省自然科学基金(ZR202103070049);中国烟草总公司重大科技项目[110201901041(LS-04),110101601024(LS-04)];四川省烟草公司科技项目(SCYC202008);河南省烟草公司洛阳市公司科技项目(2020410300270076);云南省烟草公司科技项目(2020530000241011)
葛 明(1996-),男,在读硕士,主要从事分子病理学研究。E-mail:18653008590
,E-mail:杨 宇,405425592@qq.com;杨金广,yangjinguang@caas.cn
2021-10-05
2022-05-31

