血必净注射液及其成分对肥大细胞脱颗粒作用的影响*
刘 玲,王 红,朱星宇,郭志花,崔永伟**
1 南京市溧水区中医院,南京 211200;2 扬州大学医学院附属医院,南京 211200;3 江苏护理职业学院,淮安223003
血必净注射液是由红花、赤芍、川芎、丹参、当归等5 味中药经提取后,辅以葡萄糖和聚山梨酯80制备而成。主要功效是化瘀解毒,用于温热类疾病、因感染诱发的全身炎症反应综合征;还可配合治疗多器官功能失常综合征的脏器功能受损。然而其说明书和文献中都提及血必净注射液有皮肤潮红、皮疹、瘙痒、呼吸困难、心悸、甚至过敏性休克等副反应,还有心血管系统[1]、呼吸系统[2]、消化系统[3]等方面的不良反应,且多发生在注射后30 分钟内[4]。
有研究表明,中药注射剂危及生命的严重不良反应主要是以肥大细胞脱颗粒释放组胺为主的过敏及类过敏反应[5],因此研究血必净注射液中的功能性成分致敏的意义显得尤为重要。现结合《中国药典》及文献中的有效成分和可能致敏成分,研究血必净注射液及其含有的10 种化合物(结构见图1)对P815 细胞脱颗粒、氨基己糖苷酶和组胺释放的影响,为评价该注射液的致类过敏性提供参考。
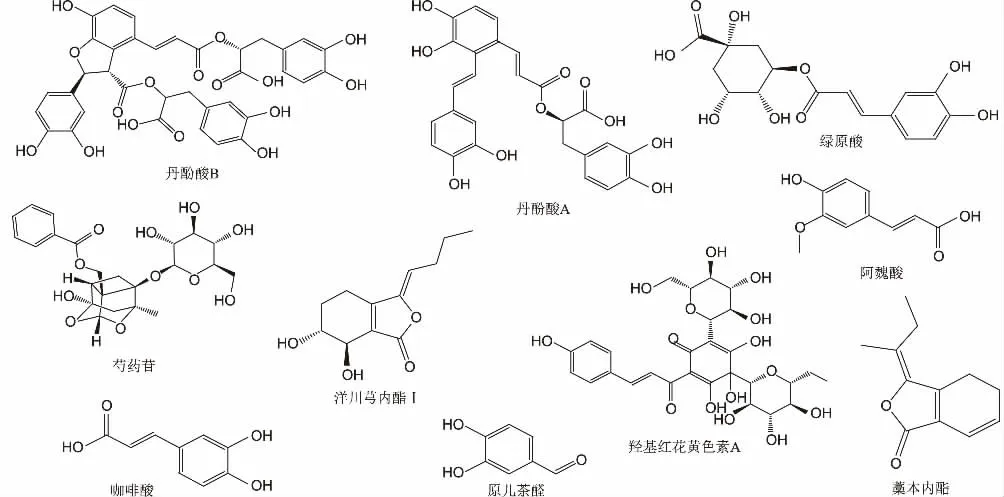
图1 血必净注射液中10 种化合物结构式
1 仪器与药品、试剂
1.1 仪器
生物倒置显微镜(日本Olympus IX51);酶标仪(美国BioTek ELx800);超净工作台(中国苏州净化SW-CJ-1FD);台式恒温振荡器(中国上海精宏实验设备有限公司THZ-312)。
1.2 药品与试剂
对照品:羟基红花黄色素A(批号R17D10F106127),芍药苷(批号L07M9Q60533),丹酚酸A(批号Z23D10X106625),丹酚酸B(批号P20J10F93457),咖啡酸(批号W16O10B100366),阿魏酸(批号L03A9D57744),洋川芎内酯Ⅰ(批号P16A10F85918),藁本内酯(批号R19D10F106243),绿原酸(批号Y22M8K36544),原儿茶醛(批号TO1013FB14),以上对照品纯度均≥98%,均购自上海源叶生物科技有限公司;血必净注射液购自天津红日药业(规格:10 mL/支,批号2002211)。
12 孔细胞培养板(美国Corning Incorporated 3599);组胺ELISA检测试剂盒(英国Abcam ab213975)。
CCK-8 细胞计数试剂盒(江苏凯基生物技术公司,KGA317);中性红(中国 Aladdin N108712-25g);氨基己糖(美国Sigma N9376);生物活性化合物C48/80(美国Sigma 088M4120V);Dulbecco's modifiedeagle medium(DEME)培养基(江苏凯基生物技术公司KGM12800-500);胎牛血清(FBS)(美国GIBCO 10100147);实验用水为超纯水。
1.3 细胞株
P815 细胞购于江苏凯基生物技术公司。
2 试验方法
2.1 溶液配制
含药培养基:各单体化合物用DMSO 配制成1 mol·L-1的母液,用时以培养基1∶1000 稀释成工作液(1 mmol·L-1),血必净注射液用时以培养基1∶10 稀释成工作液(10%,设定其对应浓度为1 mmol·L-1),再依据各个试验浓度用培养基稀释成相应浓度。
氨基己糖溶液:称取5 mg 氨基己糖溶解于1 mL的0.1mol·L-1柠檬酸盐缓冲液中,配制成14mmol·L-1的氨基己糖储备液。使用时,加入13 mL 的0.1 mol·L-1柠檬酸盐缓冲液稀释成1 mmol·L-1氨基己糖工作液。混匀后使用0.22 μmol·L-1微孔过滤膜除菌,1.5 mL EP 管分装,保存于-20 ℃低温冰箱中。
0.1mol·L-1Na2CO3/NaHCO3溶液:分别称取0.8401 g NaHCO3及1.0599 g Na2CO3溶于超纯水中,混匀后定容至100 mL。
2.2 细胞培养
将P815 细胞培养于完全培养基(含有10%胎牛血清的DMEM 培养基)中,置于37 ℃、5% CO2恒温培养箱中培养。待细胞达到80%~90%汇合时,弃去培养基,加入适当的0.25%胰蛋白酶,使胰酶溶液均匀铺在细胞表面,置于恒温培养箱中消化,待细胞变圆后加入等体积的含血清的培养基终止消化,用移液器将细胞从培养瓶壁吹下,转移至15 mL 离心管中,1000 r·min-1离心5 min,弃去上清液,加入适量的完全培养基吹打混匀,按1∶2 的比例传代。
2.3 10%抑制浓度(IC10)测定
细胞消化、计数、配制成浓度为5×104个/mL 的细胞悬液,在96 孔细胞培养板中,每孔加入100 μL细胞悬液,将该培养板置于37℃、5% CO2培养箱中培养24 h。用完全培养基稀释药物至所需浓度,每孔加入100 μL 相应的含药培养基,同时设立空白对照组,每组重复3 个(n=3),置于37 ℃、5% CO2培养箱中培养48 h。取出后每孔加入10 μL CCK-8 溶液,在培养箱中继续培养2 h,摇床轻轻混匀10 min,酶标仪于λ=450 nm 波长下,测定吸光度A 值,计算抑制率。
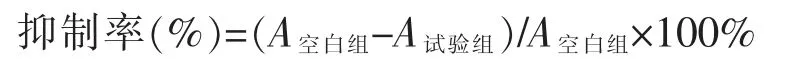
采用SPSS 软件计算血必净注射液及各化合物的IC10值。
2.4 对P815 细胞脱颗粒及生物活性介质释放的测定
取对数生长期的P815 细胞,计数1×104个/mL接种于12 孔板中,接种体积为1 mL,置于37 ℃、5%CO2培养箱中培养24 h,弃去培养基。试验组加入1 mL IC10浓度的各单体化合物及血必净注射液,空白对照组加入1 mL 完全培养基,阳性对照组加入1 mL C48/80(60 μg·mL-1)刺激,每组重复3 个(n=3),于2 h 终止反应,收集反应液。
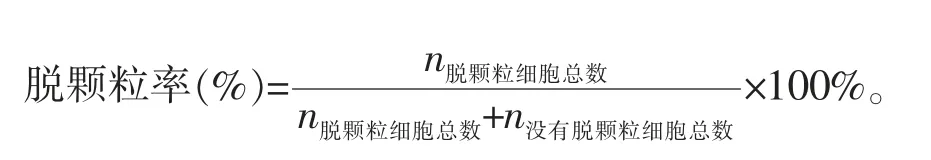
2.4.1 细胞脱颗粒百分率测定 以PBS 小心冲洗2次后,每孔加入500 μL 的1 中性红染液,轻轻拍打培养板侧面,于37 ℃染色3 min。随机计数100 个细胞,记录其中脱颗粒细胞的个数,计算其百分率。
2.4.2 组胺释放量测定 以各成分的IC10为刺激浓度,通过ELISA 法测定组胺释放量,取上清液,按Histamine ELISA 检测试剂盒说明书进行操作,检测上清液中组胺的释放量。
2.4.3 氨基己糖苷酶释放量测定 按“2.4”项下方法操作,收集上清液,加入0.1% Triton-100 细胞裂解液,将全部膜裂解,释放细胞内的氨基己糖苷酶,得到细胞裂解液。取各组离心后的细胞上清液和裂解液100 μL 加入到96 孔酶标板中,同时再加入1 mmol·L-1氨基己糖溶液。置37℃细胞培养箱中反应45min。反应完毕加入150 μL 终止液(0.1 mol·L-1Na2CO3/NaHCO3)终止反应,15min 内用酶标仪测定λ=405nm处各孔反应液的吸光度A 值,结果减去阴性对照后,以上清液中氨基己糖苷酶释放量与氨基己糖苷酶释放总量之比,衡量试验组刺激后氨基己糖苷酶的净释放量。
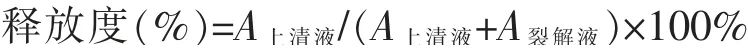
2.5 数据处理
以SPSS 20.0 计算各浓度组分的吸光度均数,并计算每一组分的IC10。组胺、氨基己糖苷酶释放率及脱颗粒率结果均采用单因素方差分析,对比各试验组与空白组统计学差异。P<0.05 为显著性差异。
3 结果
3.1 10%抑制浓度(IC10)测定
由表1 可知,在最大给药浓度下(1000μmol·L-1),阿魏酸对P815 细胞的抑制率最高,达到30.92%,其他各成分均低于20.0%。表明血必净注射液及其10种化合物并不会显著抑制P815 细胞增殖。运用软件计算各组的IC10值,由图2 可知,化合物中阿魏酸的IC10值最小,为81 μmol·L-1;丹酚酸B 的IC10值最大,为847 μmol·L-1,两者相差近10 倍。本品为含有多种组分以及各种辅料的混合溶液,其对P815 细胞的IC10值为331 μmol·L-1,与部分化合物相近。
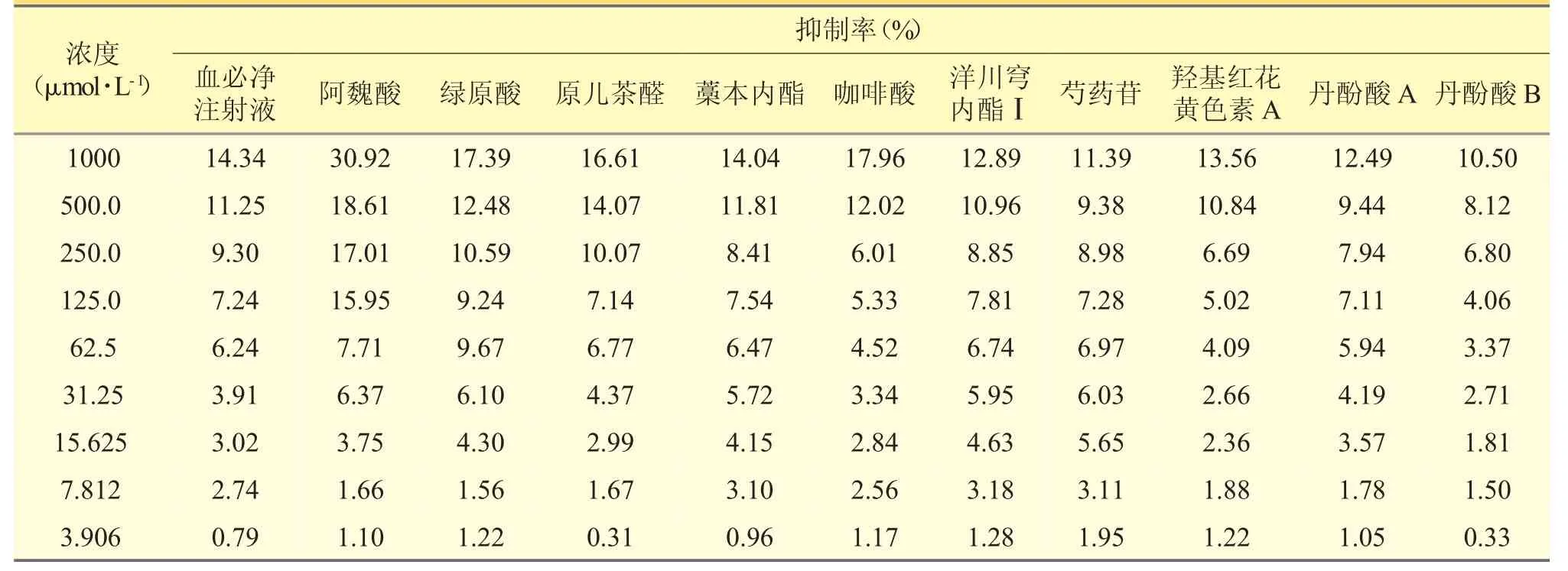
表1 血必净及其主要组分对P815 细胞的抑制作用(n=3)
3.2 细胞脱颗粒百分率测定
由图3 可知,各组细胞的脱颗粒百分率与空白组相比,C48/80、绿原酸、蒿本内酯、咖啡酸、丹酚酸B 和血必净注射液组细胞的脱颗粒百分率存在极显著差异(P<0.001);原儿茶醛(P<0.01)、羟基红花黄色素A 和丹酚酸A(P<0.05)组有显著性差异;其余各组与空白组相比,无显著性差异(P>0.05)。

图3 本品主要组分对P815 细胞脱颗粒百分率(%)的影响(n=3)
3.3 组胺释放量测定
由图4 可知,各试验组上清液中组胺释放量与空白组相比,除羟基红花黄色素A 组以外,其余各成分组及血必净注射液组均存在显著性差异(P<0.05),其中绿原酸、咖啡酸对组胺释放的影响最大,组胺释放量达6 ng·mL-1以上,高于阳性药C48/80 组。
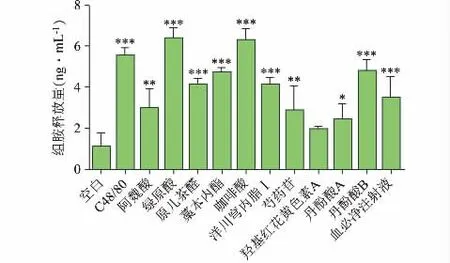
图4 本品主要组分上清液中组胺释放量(ng·mL-1)(n=3)
3.4 氨基己糖苷酶释放量测定
由图5 可知,空白组上清液中氨基己糖苷酶的释放度最低,各试验组与空白组相比,阿魏酸、芍药苷组与丹酚酸A 组均无统计学差异,原儿茶醛、蒿本内酯、洋川芎内酯Ⅰ、羟基红花黄色素A、丹酚酸B 组和血必净注射液组的氨基己糖苷酶释放量显著高于空白组(P<0.05),而阳性药、绿原酸、咖啡酸组与空白组相比存在极显著性差异(P<0.001),3 组上清液中氨基己糖苷酶的释放度均高于50%。
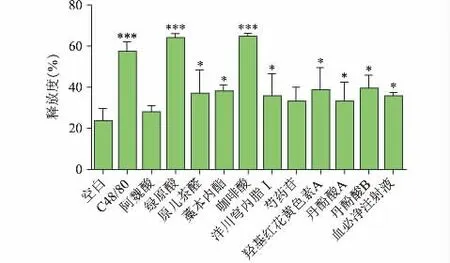
图5 本品主要组分上清液中氨基己糖苷酶释放度(%,n=3)
4 讨论
4.1 化学成分选取
选取的10 个化合物是基于血必净注射液的体内物质基础,结合《中国药典》[6]中规定的相关中药材的含量测定标准及文献报道有显著药理活性或有潜在致敏性的化学成分。羟基红花黄色素A、芍药苷、阿魏酸和丹酚酸B 是各中药材在药典中规定的含量测定成分,原儿茶醛、迷迭香酸、绿原酸、咖啡酸、丹酚酸A 和藁本内酯既是血必净注射液的成分[7],也是药理作用显著的有效成分。藁本内酯、咖啡酸、原儿茶醛和洋川芎内酯Ⅰ[8-10]具有抗炎功效,原儿茶醛还可以促进血管舒张[11];绿原酸能抗氧化、抗菌、调节免疫[12];丹酚酸A 可抗心肌缺血损伤[13]。
其中咖啡酸是绿原酸的主要代谢产物,而绿原酸一方面有很好的药理活性,另一方面临床使用中含绿原酸的中药注射剂不良反应较多,且过敏反应最为常见[14]。丹酚酸A 和丹酚酸B 可能与黄疸等相关不良反应有关[15]。藁本内酯可能通过孕烷X 受体途径引发药物代谢酶的诱导效应,导致代谢性药物相互作用的发生[16]。因此,选取10 种化合物考察其对P815 细胞脱颗粒、氨基己糖苷酶和组胺释放的影响,为评价血必净注射液的致类过敏性提供参考。
4.2 试验模型以及给药浓度的选取
近年来,常用于研究体外过敏的细胞模型有P815、RBL-2H3 和Ku812 细胞。有文献研究表明,同RBL-2H3 相比,在相同刺激条件下,P815 细胞活化后脱颗粒时间出现更早、程度更高[17];相对于RBL-2H3 和Ku812 细胞,P815 细胞更适合作为一种早期、稳定、敏感的肥大细胞脱颗粒体外检测模型[18]。故本试验选取P815 细胞作为体外过敏模型。
由于10 种化学成分理化性质不同,对P815 细胞生长的影响也不尽相同,因此采用CCK-8 法测定各化合物不同浓度下对P815 细胞的抑制率,通过软件算出各化合物相应的10%抑制浓度作为给药浓度。各化合物在该浓度条件下,在一定时间内,对P815 细胞的生长影响一致,最大程度保证在试验过程中各组细胞状态一致,对后续脱颗粒、组胺和氨基己糖苷酶的测定影响最小。
4.3 对P815 细胞的影响
由试验结果看出,与空白组相比,血必净注射液中含有的绿原酸和咖啡酸能极显著地引起P815细胞脱颗粒、释放组胺及氨基己糖苷酶;原儿茶醛、蒿本内酯和丹酚酸B 对P815 细胞的脱颗粒及组胺释放有较大影响,也能一定程度上影响氨基己糖苷酶的释放,与所引文献中可能导致药物不良反应或相互作用的化合物基本一致。此外,血必净注射液本身也会显著引起P815 细胞脱颗粒和释放组胺,并一定程度上增加氨基己糖苷酶的释放。
综上,本次试验结果可一定程度上为评价血必净注射液的致类过敏性提供初步参考;但本试验仅采用了体外P815 细胞模型,且样品也是未经人体吸收代谢的原型成分,其过敏机制以及引起过敏反应的物质基础还需要结合生物体内分布代谢的过程,并运用体内外模型进行深入研究。