白菜小孢子超低温保存及复苏后胚状体诱导
谭舒心 张淑江 章时蕃 张 慧 李国亮 刘希童 刘雨佳 孙日飞 李 菲
(中国农业科学院蔬菜花卉研究所,北京 100081)
随着植物游离小孢子培养技术的发展,利用小孢子培养诱导单倍体/双单倍体(DH)植株用于育种等科研领域的研究日益受到关注。十字花科芸薹属蔬菜在我国栽培历史悠久,种质资源丰富,在蔬菜生产中占据重要地位。多年来芸薹属植物游离小孢子培养技术的研究始终是科研人员关注的热点之一,近几年针对白菜培养体系的优化已取得有效进展(李菲 等,2014;伍健缤 等,2021),并有力推动了白菜小孢子培养技术在育种等科研领域的广泛应用。目前,小孢子培养技术在加速十字花科芸薹属作物种质纯化、DH 群体的图谱构建以及重要基因定位研究中发挥了显著优势(李智军 等,2021)。但在细胞培养范畴,小孢子的收集受供体植株生长周期和栽培条件的极大影响,不能持续获取优质、高生活力的小孢子,是阻碍小孢子培养技术更广泛应用的主要障碍。例如二年生的大白菜,在缺少人工气候室的情况下,利用温室、大棚等设施栽培亦可在每年3—5 月大白菜盛花期收集到适宜诱导胚状体的小孢子,但是一旦进入高温季节,植株病害严重,则难以继续收集小孢子,使相关科研工作无法按计划推进。因此,如何持续获取高生活力的小孢子对推动白菜细胞工程研究的顺利开展具有重要意义。
超低温冻存技术为妥善保存白菜小孢子提供了可能。超低温冻存是指以液氮为冷源,贮存温度保持在-196 ℃的长期贮存生物材料的方法(Wang et al.,2011)。在超低温条件下,生物材料活体细胞的物质代谢几乎完全停止,处于“活力停滞”(stagnant vitality)状态(David,2010)。因细胞、组织及器官在低温保存过程中遗传特性不会发生改变,在“活力停滞”状态下可减缓甚至停止生物材料的新陈代谢和老化过程(宋友远 等,2016),且不发生遗传变异并维持生物材料的高活力,达到安全、有效地长期保存珍稀种质资源的效果(Pedro et al.,2008)。
关于植物组织超低温冻存的方法已有研究报道(何庆虎,2019),冻存对象主要涉及原生质体、愈伤组织、体细胞胚、花粉、种子等(殷晓辉 等,1996;王子成和邓秀新,2002;谢玉明,2003;张守梅 等,2005;余露 等,2007;Bai et al.,2011;Pio et al.,2012;Souza et al.,2018)。前人研究发现,细胞在-15~-5 ℃下通常会出现低温冷害现象,细胞内的脂质膜、微管在进行有丝分裂或细胞减数分裂时纺锤体发生不可逆变化,导致细胞无法正常分裂而死亡(Moussa et al.,2014)。在超低温冻存中植物细胞液内也同样存在冷害现象(Harding,2004),因此在超低温冻存中需添加必要的冷冻保护剂(孙嘉莹 等,2019),目前广泛应用的冷冻保护剂主要为二甲基亚砜(DMSO)、甘油等(文彬,2011),但此类渗透性冷冻保护剂本身具有毒性,会使蛋白质发生变性,从而造成细胞的损伤,对冻存对象具有一定毒害作用(张美娜 等,2019)。
植物小孢子为单倍体的单细胞,新鲜提取的小孢子在进行细胞悬浮培养时极易受培养环节的温度、光照、振荡、培养基成分等诸多因素干扰而使细胞停止发育,这可能是科研人员至今还未将超低温冻存技术应用于植物小孢子的原因。本试验利用超低温冻存技术对10 份白菜材料小孢子开展冻存复苏研究,建立白菜小孢子超低温冻存复苏的胚状体诱导体系,以期获得维持高生活力小孢子长期保存的有效方法,为白菜单倍体诱导相关试验的顺利开展提供技术支持,推动芸薹属植物细胞工程研究。
1 材料与方法
1.1 试验材料
供试10 份白菜材料均由中国农业科学院蔬菜花卉研究所白菜课题组提供,包括8 份结球白菜和2 份青梗菜(表1)。
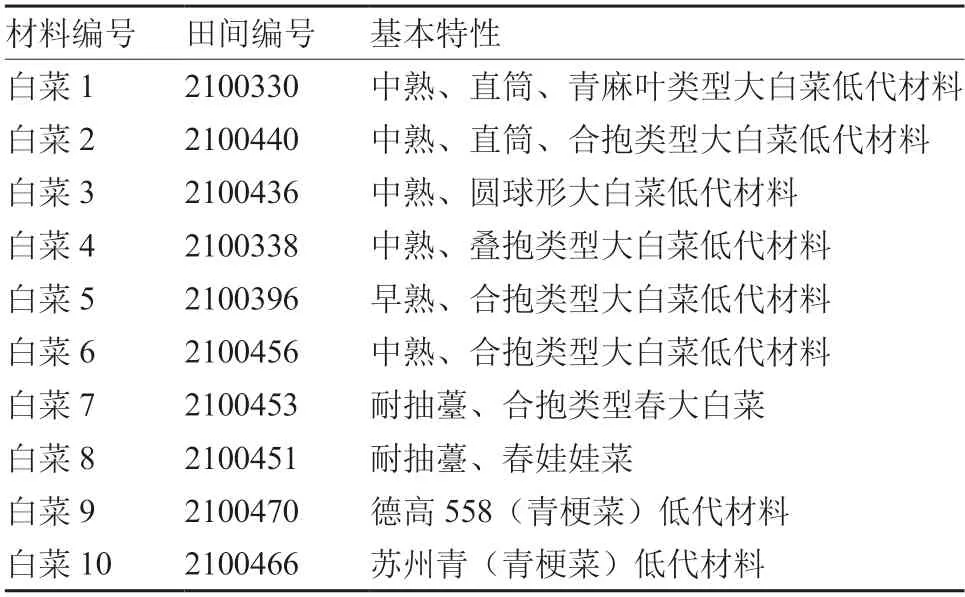
表1 供试10 份白菜材料编号及基本特性
改良B5 液体培养基:常规B5 培养基中添加120 g·L蔗糖、50 g·L甘露醇,pH 值5.8,高温灭菌后4 ℃冰箱保存备用;二甲基亚砜购于Sigma-Aldrich(货号:D2650-100ML),参照传统方法,利用无菌蒸馏水配制成浓度为2%的溶液(马锋旺和李嘉瑞,1989),4 ℃冰箱保存备用。
1.2 试验方法
1.2.1 供体植株栽培管理 10 份白菜材料均于2020 年12 月20 日催芽,播种于直径为10 cm 的营养钵中,温室育苗常规管理。2021 年3 月3 日,幼苗4~5 片叶时定植于本所南圃场大棚内,每份材料定植10 株。经过冬季短期的营养生长和低温春化,植株开始花芽分化并抽薹开花,3 月底至6月初在盛花期收集提取小孢子。
1.2.2 白菜小孢子的收集 采集供体植株2~3 mm长的花蕾(此时小孢子主要处于单核靠边期),先用75%酒精浸泡消毒30 s,再用7%次氯酸钠溶液浸泡消毒15 min,然后无菌蒸馏水冲洗3 遍;加入改良B5 液体培养基,采用细胞破碎仪(TOMY MS-100R)收集提取小孢子。将40 个花蕾收集于5 mL 离心管中,细胞破碎仪3 000 r·min条件下破碎10 s,进行小孢子的机械化提取(李菲 等,2009,2014)。
1.2.3 白菜小孢子的生活力检测 利用醋酸洋红染色法分别检测10 份白菜材料新鲜小孢子的生活力,作为后期的试验对照。取1~2 μL 小孢子悬浮液置于载玻片上,滴1 滴醋酸洋红染液,室温下放置10 min,在蔡司体式显微镜(Axioskop 40)10×目镜下观察,具有生活力的小孢子呈深红色,无生活力的小孢子呈浅红色或无色(李庆飞 等,2020)。随机选择3~4 个视野进行观察,取平均值。
小孢子生活力=视野内有生活力的小孢子数/视野内全部小孢子数× 100%
1.2.4 冷冻保护剂比较试验 分别采用改良B5 液体培养基与传统冷冻保护剂二甲基亚砜作为冷冻保护剂,比较并筛选适宜白菜小孢子低温保存的冷冻保护剂。保存温度设置6 个处理:4、-20、-40、-80℃(冰箱)和-196 ℃(液氮),以室温为对照;每个温度处理下再设置3 个保存时间处理:30、60、90 d。每处理3 次重复,利用醋酸洋红染色法检测小孢子生活力。为确保试验的一致性,4 ℃和室温处理也同样添加冷冻保护剂;试验采用的0.5 mL冻存管密封性好,可长期无菌保存小孢子,冷冻保护剂不会挥发。
1.2.5 白菜小孢子低温保存试验 分别收集10 份白菜材料的新鲜小孢子分装于0.5 mL 灭菌冻存管中,小孢子体积不超过冻存管的2/3。设置6 个温度处理:4、-20、-40、-80 ℃(冰箱)和-196 ℃(液氮),以室温为对照;每个温度处理下再设置6 个保存时间处理:30、60、90、120、150、180 d。每处理3 次重复,利用醋酸洋红染色法检测小孢子生活力。
1.2.6 白菜小孢子复苏试验 根据前期试验结果,选择-80 ℃(冰箱)保存90 d 的小孢子为试材,筛选白菜小孢子复苏适宜温度及时间。小孢子为单细胞,细胞复苏并保持高生活力的关键是“慢冻快融”原则。Harding(2004)研究表明,植物细胞超低温保存后化冻温度超过50 ℃会对细胞结构和细胞器造成不可逆的损伤,从而导致细胞死亡。因此,本试验设置的3 个复苏温度处理分别为:37、40、50 ℃;每个温度处理下再设置3 个复苏时间处理:40、50、60 s。利用恒温水浴锅(上海博讯医疗设备厂)进行加热融化;每处理3 次重复,利用醋酸洋红染色法检测小孢子生活力。
1.2.7 悬浮培养诱导小孢子胚状体 分别将10 份白菜材料的新鲜小孢子和在-80 ℃(冰箱)保存30、60、90、150、180 d 后进行复苏的小孢子悬浮于NLN-13 液体培养基(pH 值6.0,用0.22 μm 针式过滤器过滤灭菌制得,4 ℃冰箱保存)中。利用血球计数板调整小孢子悬浮液浓度为1 × 10个·mL,然后分装于直径为60 mm 的无菌培养皿中,每皿10~12 mL,采用Parafilm 封口膜封口;33 ℃培养箱热激诱导24 h 后,转入25 ℃暗培养孵育,直至获得肉眼可见的胚状体。采用蔡司体式显微镜观察胚状体发生情况,统计每皿出胚数;每处理3次重复,取平均值。
1.2.8 诱导小孢子胚状体的植株再生 将超低温保存、复苏小孢子诱导获得的胚状体转入B5 固体培养基〔6-苄氨基嘌呤(6-BA)1.5 mg·L、α-萘乙酸(NAA)0.05 mg·L、蔗糖30 g·L,pH 值5.8~6.0〕进行组培继代,培养室温度保持24~26℃,光照强度1 000~1 500 lx,16 h 光照/8 h 黑暗培养,直至获得具有根、茎、叶的再生植株。
1.3 数据处理
利用Excel 和SPSS 19.0 软件对试验数据进行单因素ANOVA 方差分析,选择95%置信度作为统计学显著检验的标准。
2 结果与分析
2.1 不同冷冻保护剂对白菜小孢子生活力的影响
如表2 所示,参试10 份白菜材料的新鲜小孢子生活力均较高,且差异不大,其中白菜4 的小孢子生活力最高,达到99.2%;白菜7 的小孢子生活力最低,为94.3%;10 份白菜材料的小孢子平均生活力为97.6%。说明小孢子生活力与白菜材料背景无相关性,且目前白菜小孢子提取技术已成熟稳定,可确保收集的新鲜小孢子具有高生活力。

表2 10 份白菜材料新鲜小孢子的生活力检测结果
从表3 可以看出,相同保存条件下采用改良B5 液体培养基为冷冻保护剂的白菜小孢子生活力明显高于采用传统冷冻保护剂二甲基亚砜为冷冻保护剂的白菜小孢子;以改良B5 液体培养基为冷冻保护剂,保存温度为-196 ℃和-80 ℃,保存时间30 d 的白菜小孢子生活力分别为96.6%和95.2%,与新鲜小孢子的平均生活力97.6%相差不大;随着保存时间的延长,白菜小孢子生活力呈下降趋势,保存时间为90 d 时以二甲基亚砜为冷冻保护剂的白菜小孢子生活力均低于56%,已无法满足后续试验要求。由此,后续试验均以改良B5 液体培养基作为冷冻保护剂。

表3 不同冷冻保护剂对低温保存白菜小孢子生活力的影响
2.2 不同保存温度对白菜小孢子生活力的影响
不同温度保存30 d 的白菜小孢子生活力差异明显,利用醋酸洋红染色法可直观分辨(图1)。其中-80 ℃和-196 ℃保存的小孢子生活力较高,与新鲜小孢子无明显差异,且远高于其他低温保存的小孢子生活力;室温对照和4 ℃保存的小孢子数量明显减少,大量细胞破裂,细胞液外流,失去生活力。
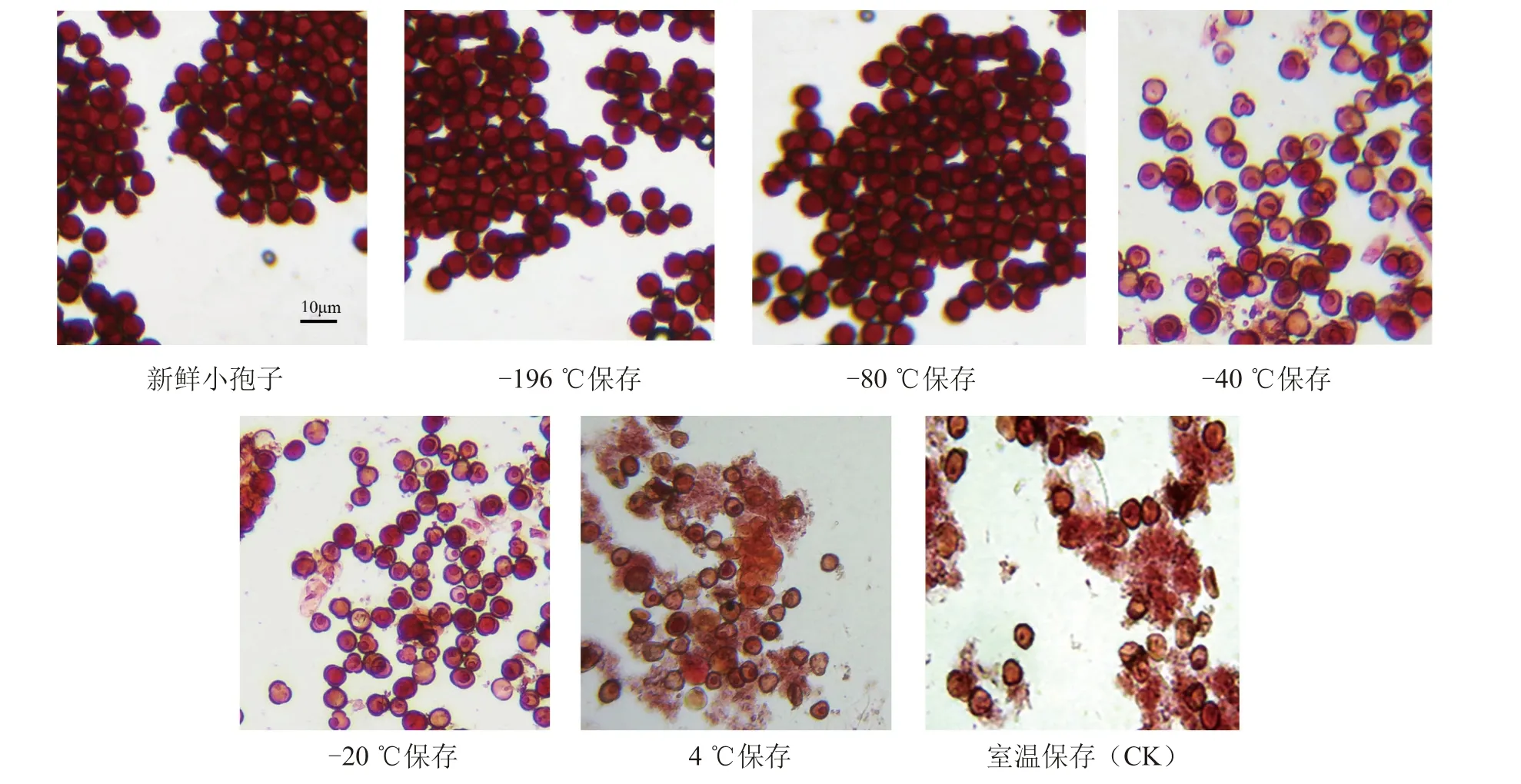
图1 白菜1 小孢子不同温度保存30 d 的显微观察结果(10×目镜)
由表4、图2 可以看出,相同保存条件下10份白菜材料间的小孢子生活力差异不大。-196 ℃和-80 ℃保存的小孢子平均生活力随保存时间的延长下降趋势平缓,保存30 d 的小孢子平均生活力分别为96.6%和95.2%,与新鲜小孢子平均生活力差异不明显,保存至180 d 时小孢子平均生活力仍可保持在85%以上;其他处理条件下,白菜小孢子生活力随着保存温度的升高呈明显下降趋势,且随保存时间的延长小孢子平均生活力也明显下降。10 份白菜材料的小孢子在-40、-20 ℃保存90 d 的平均生活力为70%左右;4 ℃保存60 d 的小孢子平均生活力已降至57.4%;室温对照保存30 d 的小孢子平均生活力仅维持在50%左右,保存至60 d的小孢子平均生活力仅为1.8%,已基本丧失生活力。综上,白菜小孢子无法在4 ℃和室温条件下长期保存;对于短期(30~90 d)且对生活力要求不高(80%以下)的试验而言,低温保存小孢子可选择的温度范围较广,-196~-20 ℃均可;对于长期保存,且对小孢子生活力要求高(85%以上)的试验,则需要在-196~-80 ℃温度下保存。鉴于-80℃(冰箱)和-196 ℃(液氮)保存下白菜小孢子的生活力差异不显著,实际应用中可选择-80 ℃冰箱保存,既可避免液氮保存时需要人员定期监控和定时填充液氮等问题,且操作也更简便。
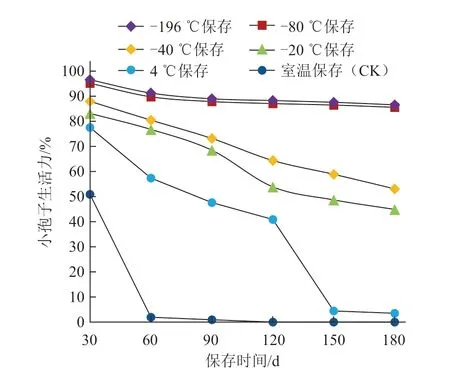
图2 不同保存温度和时间对白菜小孢子生活力的影响
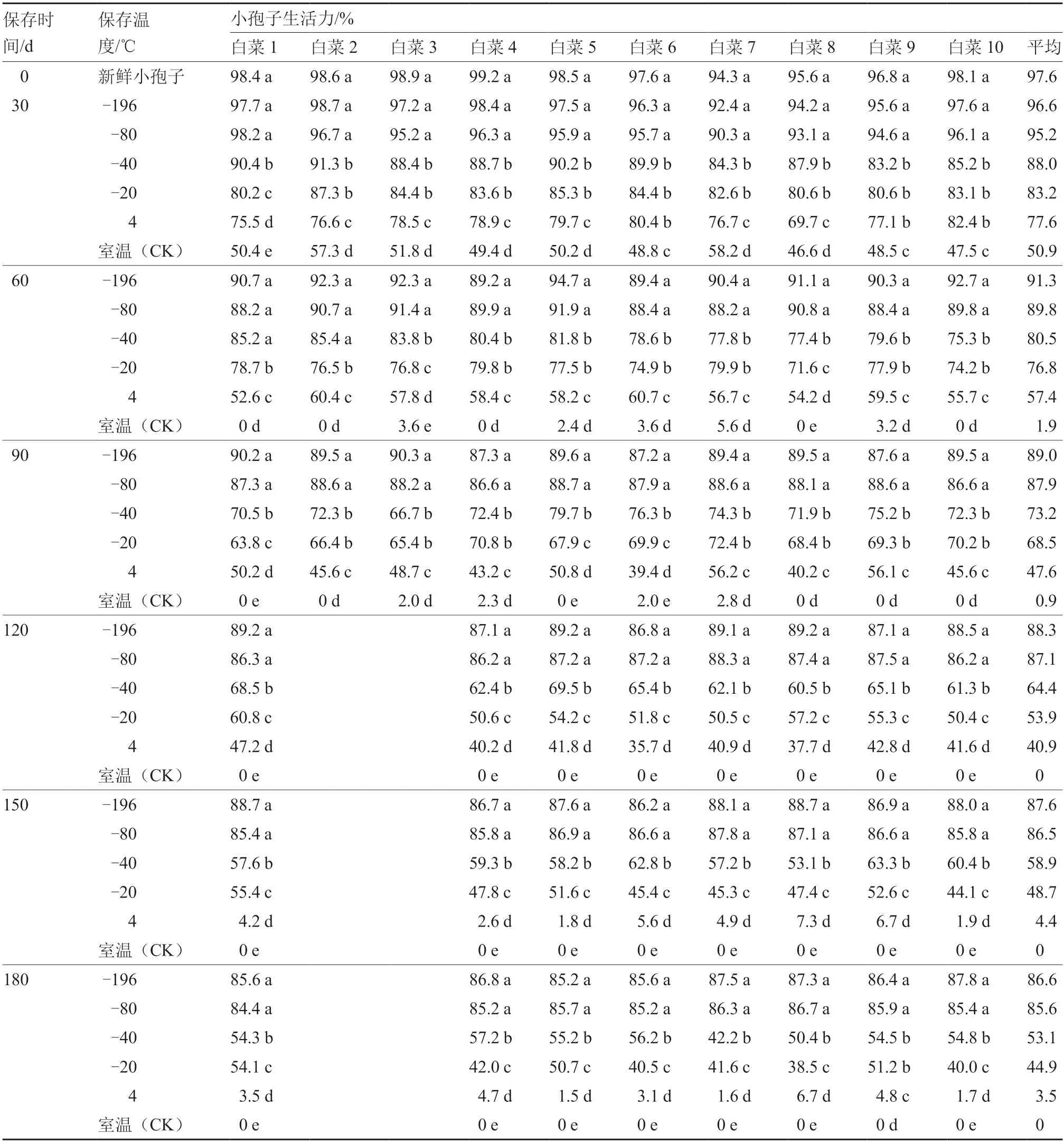
表4 不同保存温度对白菜小孢子生活力的影响
2.3 不同复苏条件对白菜小孢子生活力的影响
-80 ℃保存90 d 的白菜小孢子经不同条件复苏处理后的生活力检测结果表明(表5),白菜小孢子生活力随复苏温度的升高和复苏时间的延长呈逐渐下降趋势,其中37 ℃恒温水浴40 s,10 份白菜材料的小孢子生活力均在85%以上,平均生活力为87.9%,可以满足后续小孢子诱导培养胚状体的试验要求,即0.5 mL 冻存管分装保存的白菜小孢子复苏的最佳条件为37 ℃恒温水浴40 s。

表5 -80℃保存90 d 的白菜小孢子不同复苏处理后生活力检测结果
2.4 冻存复苏后小孢子的胚状体培养
经超低温保存、复苏后的白菜小孢子是否能诱导胚状体发生是建立小孢子冻存复苏体系的关键。本试验观察发现,随着超低温保存时间的延长,悬浮培养的复苏小孢子在观察视野中可捕捉到的热激膨大的小孢子数量和分裂的细胞团数量呈逐渐减少的趋势。
从表6 可以看出,白菜2 和白菜3 为易出胚材料,其提取的新鲜小孢子及-80 ℃保存30、60、90 d 复苏后的小孢子均可诱导获得胚状体;白菜1和白菜4 的新鲜小孢子和冻存复苏后的小孢子均不具备胚胎发生能力,可能是因为这2 份材料为难诱导胚胎发生的材料;其余6 份材料的小孢子不同处理后进行热激诱导均有小孢子体积膨大现象,后续培养观察也发现有分裂的细胞团(图3)。由此认为,超低温保存的白菜小孢子复苏后可以承受高温热激胁迫,并可以继续进行游离小孢子培养;小孢子是否可诱导获得胚状体主要取决于材料本身基因型。

图3 白菜5 小孢子-80℃保存180 d 复苏后的热激膨大小孢子及分裂细胞团

表6 超低温保存、复苏后白菜小孢子诱导成胚情况
统计白菜2 和白菜3 的出胚数量。结果表明(表7,图4、5),小孢子随着超低温保存时间的延长,诱导产生的胚状体数量不断减少,与新鲜小孢子出胚量有显著差异。分析原因,可能是经过长时间超低温保存的小孢子虽然仍保持较高生活力,但比新鲜小孢子的生活力仍有所降低(表4),且小孢子历经超低温保存、复苏处理及高温热激诱导等多次温度的逆境胁迫后,虽仍具有启动胚胎发生的能力,但能进一步进行细胞分裂的小孢子数量也随之降低。

表7 白菜2、白菜3 超低温保存、复苏后小孢子的出胚数量

图4 白菜2 超低温保存、复苏后小孢子的出胚情况

图5 白菜3 超低温保存、复苏后小孢子的出胚情况
2.5 超低温保存小孢子诱导胚状体的继代培养
将超低温保存、复苏后的白菜小孢子诱导获得的胚状体接种于B5 固体培养基组培继代,与新鲜小孢子诱导获得的胚状体相比,经历30、60、90 d超低温保存后的小孢子诱导获得的胚状体在普通组培继代培养中没有表现生长发育的差异,3 个月后均成功获得了具根、茎、叶的组培再生植株(图6)。由此认为,白菜小孢子经超低温保存、复苏后诱导获得的胚状体同样可实现正常组培苗的获得。

图6 超低温保存、复苏后白菜小孢子诱导胚状体继代培养获得组培苗
3 讨论与结论
随着游离小孢子培养技术的不断发展和应用,超低温冻存技术可能是解决目前白菜小孢子供体植株受生长季节、生长期影响,无法长期持续获取高生活力小孢子的有效途径之一。
本试验采用改良B5 液体培养基作为白菜小孢子超低温保存的冷冻保护剂,能有效克服二甲基亚砜等传统冷冻保护剂对细胞冻存的潜在毒害(陈晓艺 等,2021),并且小孢子经超低温冻存复苏后仍可维持较高生活力和胚胎发生能力。选择改良B5液体培养基是因为在白菜小孢子培养体系中B5 培养基必不可少,除了可以维持游离态细胞的养分环境,还具较高的糖浓度。有报道认为,在冷冻保护剂中添加蔗糖能够改变冻存组织的外液渗透压,有助于细胞在冷冻时脱水,在解冻时可防止水分的快速进入,降低冰晶对细胞的损伤(潘红梅 等,2015);另外,冷冻保护剂中添加几种糖类混合物对细胞保护效果更好(Gómez-Fernández et al.,2012)。这可能是本试验利用改良B5 液体培养基作为冷冻保护剂使白菜小孢子生活力更高、达到良好保存效果的原因。
本试验结果表明,白菜小孢子经长时间低温保存后,虽然仍可维持较高的生活力,但与新鲜小孢子相比其生活力随低温保存时间的延长是逐渐下降的,这与后期观察复苏小孢子热激后诱导膨大的小孢子数量、分裂的细胞团数量以及获得的胚状体数量随低温保存时间的延长而减少是一致的。白菜游离小孢子培养属于大群体基数的细胞培养,在后续进行小孢子超低温冻存体系优化中可通过提高复苏后白菜游离小孢子悬浮液浓度,从而有效提高超低温冻存复苏小孢子诱导培养的胚状体数量。
考虑到冻存体积影响化冻时长,小孢子冻存体积越大化冻时间则越长,进而影响小孢子生活力。本试验选择0.5 mL 冻存管分装保存白菜小孢子,每管冻存小孢子稀释后可分装3~4 个培养皿,可满足后续小孢子胚状体诱导试验所需。在实际应用中,小孢子冻存体积可根据不同试验目的进行合理调整。使用体积更小的冻存管,白菜小孢子冻存复苏的时间缩短,在一定程度上可减少高温化冻对小孢子的伤害,小孢子复苏后可维持更高生活力。
小孢子是花粉的前体,前人在花粉冻存研究中发现,超低温并不都有利于植物花粉的保存。如海棠花粉的最适保存温度为4 ℃,温度过低会导致细胞脱水,不利于海棠花粉贮藏(朱金儒 等,2016)。本试验结果表明,随着保存温度的升高,白菜小孢子生活力逐渐下降,但在-80 ℃和-196℃保存条件下小孢子生活力下降趋势减缓。这与刘学良等(2018)分析低温导致细胞呼吸作用减弱,可溶性糖、有机酸等物质消耗减少的观点一致。由此认为,白菜小孢子的保存不能参照花粉保存的温度,4、−20、−40 ℃低温保存均无法使白菜小孢子长期保存后仍具有高生活力。
本试验所用的10 份材料中8 份为结球白菜,2 份为青梗菜,提取的新鲜小孢子生活力均在95%左右;在相同试验条件下不同白菜材料小孢子之间的生活力差异并不显著,本冻存技术可以广泛应用于白菜类作物。
本试验首次对白菜小孢子超低温冻存复苏开展研究,筛选获得了适宜白菜小孢子的超低温冻存条件,建立了白菜小孢子超低温冻存及复苏后胚状体诱导体系,试验结果可为十字花科芸薹属作物小孢子的长期有效保存以及相关细胞培养研究提供技术参考。

