食管癌组织LOC100130476 基因的表达与预后的相关性分析
耿锦楠,张雅青,张 煦,陆 滨
(1.兰州大学第一医院,甘肃 兰州 730000;2.西北民族大学医学部,甘肃 兰州 730030;3.兰州大学基础医学院,甘肃 兰州 730000;4.兰州市第二人民医院,甘肃 兰州 730000)
食管癌(Esophageal Carcinoma,EC)是在世界范围最常见、多发的消化系统恶性肿瘤之一,有调查显示,其致死率仅次于胃癌[1-2]。该病发病有明显地区差异,约80%的食管癌发生于发展中国家[3]。我国是EC 高发国家,尤其多见于河南、山西、河北等省份,其中食管鳞状细胞癌(Esophageal Squamous Cell Cancer,ESCC)占EC 的90%以上[4]。该病预后较差,病情进展至中晚期后患者的5 年生存率为10%~15%[5]。因此有必要寻找新的适用于ESCC 早期诊断及治疗的分子靶点,以提高生存率,改善预后。LOC100130476 基因是一类位于人染色体6q23.3 的长链非编码RNA(Long non-coding RNA,LncRNA),师雅斌等[6]对其在ESCC 中的表达及甲基化状态进行研究,结果显示,LOC100130476 在ESCC 中呈异常低表达,可能与该病的发生发展密切相关。但目前有关LncRNA LOC100130476 在ESCC中具体作用及其与预后的关系,国内外尚无相关报道。本研究采用RT-PCR 法检测ESCC 患者癌组织及对应癌旁组织标本LOC100130476 的表达水平,进一步探讨LOC100130476 在ESCC 组织中的表达情况、与临床病理特征及预后的相关性,旨在为ESCC 的诊断和治疗提供依据。
1 对象与方法
1.1 对象
1.1.1 一般资料 选取2014 年10 月—2016 年12 月兰州大学第一医院收治的食管鳞状细胞癌(ESCC)手术患者70 例,均取原发灶及癌旁组织(距原发灶边缘≥5 cm)标本,标本留取后于30 min 内置于液氮中并转运至冰箱保存,经HE 染色确定为食管鳞状细胞癌组织,癌旁组织未见癌细胞浸润。手术切除采集组织标本后一部分于新鲜状态下置于液氮冷藏,后入-80 ℃冰箱保存,供提取组织总RNA 及DNA,行RT-PCR 检测;另一部分组织标本以10%福尔马林固定并制作蜡块保存,行HE 染色后观察组织形态。70 例患者中男49 例,女21 例,年龄44~80岁,平均(61.59±10.32)岁。参考2017 年国际抗癌联盟(UICC)和美国癌症联合会(AJCC)发布的食管癌分期标准(第7 版)[7]进行分期,依据世界卫生组织(WHO)病理分级标准[8]确定分化程度(1 级:高度分化;2 级:中度分化;3 级:低度分化)。以病历回顾或电话随访等形式获取所有患者临床和预后资料。本研究经兰州大学第一医院医学伦理委员会审核批准,且患者对实验知情并签署同意书。
1.1.2 纳入与排除标准 纳入标准:(1)70 例患者经病理学证实为ESCC,行根治或姑息性切除术;(2)均为原发性食管鳞癌,术前未接受放化疗治疗;(3)临床资料完整。排除标准:(1)食管腺癌(EAC)患者;(2)心、肝、肾等重要脏器功能不全者;(3)合并自身免疫疾病或精神疾病者;(4)并发其他恶性肿瘤者。
1.2 方法
1.2.1 主要仪器、试剂 实验仪器:PCR 扩增仪(美国ABI 公司GeneAMP PCR)、微型离心机(赛洛捷克掌上离心机)、快速混匀器(江苏新康医疗器械有限公司,型号:XK96-A 型)、低温冷冻离心机(上海精密仪器有限公司,型号:DL-6000B 型)、冷冻存贮冰箱(青岛海尔,型号:HYC-940 型)、超低温冰箱(青岛海尔,型号:DW-86L386 型)等。实验试剂:试剂(美国Invitrogen Life Technologies 公司)、反转录试剂盒(美国Invitrogen 公司)、SYBR Real-Time PCR 试剂盒(美国Thermo 公司)、PCR 引物(上海生工技术有限公司)、蛋白酶K(美国Ambion 公司)、胎牛血清(美国BI 公司)等。

表1 RT-PCR 引物序列及扩增条件
1.2.3 随访 出院后以上门和电话等形式随访,随访截止日期为2019 年12 月20 日。以手术开始至局部复发、远处转移或末次随访时间定义为无病生存期(Disease Free Survival,DFS),失访或死亡为删失值,以手术开始至任何原因死亡或末次随访时间定义为总生存期(Overall Survival,OS),分析其术后生存情况。
1.3 观察指标
(1)组织标本HE 染色后观察组织形态;(2)长链非编码RNA LOC100130476 基因在ESCC 及癌旁组织中的表达水平;(3)长链非编码RNA LOC100130476 基因表达与ESCC 患者临床病理特征的关系分析;(4)长链非编码RNA LOC100130476 基因表达与ESCC 患者生存情况的关系分析;(5)ESCC 不良预后危险因素分析。
1.4 统计学方法
2 结果
2.1 组织标本HE 染色结果
HE 染色结果显示,所采集肿瘤标本均为ESCC 组织,其对应癌旁组织无癌细胞浸润(图1~2)。
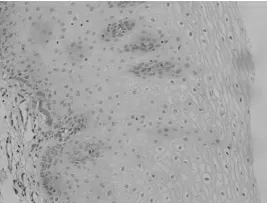
图1 正常食管鳞状上皮组织(HE 200×)

图2 ESCC 组织(HE 200×)
2.2 LOC100130476 在ESCC 及癌旁组织中的表达水平
RT-PCR 检测结果显示,ESCC 组织中LOC100130476 相对表达量下调,其表达量(0.79±1.62)显著低于对应癌旁正常组织(2.89±2.77),差异有统计学意义(t=-5.475,P=0.000),见图3。

图3 LOC100130476 在ESCC 组织中表达明显下调
2.3 LOC100130476 表达与ESCC 患者临床病理特征的关系
ESCC 组织中LncRNA LOC100130476 表达与肿瘤分化程度、T 分期和淋巴结转移有关(P<0.05),见表2。

表2 LOC100130476 表达与临床病理特征的关系
2.4 LOC100130476 表达与ESCC 患者生存情况的关系
术后随访3 年,70 例患者生存29 例,占41.43%,死亡41例,占58.57%。LOC100130476 低表达组生存率低于高表达组(P<0.05),患者DFS 和OS 均短于高表达组(P<0.05),见表3。

表3 LOC100130476 表达与ESCC 患者生存情况的关系
2.5 危险因素分析
COX 多因素回归分析显示,LOC100130476 表达水平是影响ESCC 不良预后的独立危险因素(P<0.05),见表4。

表4 影响ESCC 患者不良预后的危险因素
3 讨论
3.1 LncRNA 通过调控相关基因表达参与肿瘤的发生发展乃至浸润转移
LncRNA 是指长度在200~100 000 nt 之间,具有调控基因表达作用非编码RNA 分子,其不编码蛋白质,多以RNA 形式通过调控相关基因表达参与肿瘤的发生发展乃至浸润转移。目前人类已发现的LncRNA 多达11 万种[9],其在多种常见恶性肿瘤组织及细胞中呈异常表达(上调或下调),在ESCC 中异常表达的LncRNA 包括HOX 转录反义RNA、肌动蛋白纤维相关蛋白1-反义RNA1、前列腺癌上调长链非编码RNA1、肝细胞核因子1 同源异形盒反义RNA1、边缘系统相关膜蛋白反义RNA3、FOXC1 基因启动子上游的转录体、尿路上皮癌胚抗原1、ENST000005479631.1 等。其中HOX 转录反义RNA 被证实在绝大多数ESCC 中呈异常表达,是癌细胞侵袭及转移能力得以增强的重要驱动因素,同时也是影响患者预后的独立危险因素[10]。
3.2 LncRNA LOC100130476 基因在多种肿瘤组织中发挥抑癌基因作用
LncRNA LOC100130476 是LncRNA 的重要成员,其位于染色体6q23.3,现有研究证实该基因有3 个CpG 岛,长度分别为224、768、151 bp。师雅斌等[6]对LncRNA LOC100130476 在ESCC 中的表达情况进行了研究,结果显示,LOC100130476 在ESCC 组织中的表达量明显低于正常组织,提示其可能在ESCC中发挥抑癌基因的作用。此后相继有研究发现,LncRNA LOC100130476 在胃贲门腺癌组织和肾细胞癌原发肿瘤组织中的表达低于对应癌旁正常组织[11-12],这进一步提示LncRNA LOC100130476 可能在多种肿瘤组织中发挥抑癌基因作用,但其在ESCC 组织中的表达及导致其表达异常的机制尚不明确。本研究发现,ESCC 组织中LOC100130476 的表达显著低于癌旁组织,提示其在ESCC 患者癌组织中表达下调,可能发挥抑癌基因作用,与既往研究结论一致[6]。更进一步的研究发现,ESCC组织中LncRNA LOC100130476 表达与肿瘤分化程度、T 分期和淋巴结转移有关(P<0.05),即低分化、T3 期和出现淋巴结转移患者的ESCC 组织LncRNA LOC100130476 的表达水平相对更低,而LOC100130476 基因表达下调可能是ESCC 发生的机制之一,推测其作用机制与DNA 甲基化有关[13-15]。通常认为在肿瘤形成过程中包含遗传学机制和表观遗传学机制,这两种机制共同影响肿瘤形成,且相互交叉存在。DNA 甲基化是表观遗传学常见修饰形式,在肿瘤发生发展中可能发挥重要作用。基因启动子区及第一外显子区含CpG 岛丰富的部位易出现甲基化,甲基化发生后可改变染色质结构,影响DNA 构象及稳定性,导致基因表达沉默,致抑癌基因表达下调,促进细胞增殖及分化,诱发肿瘤。
3.3 LncRNA LOC100130476 基因作为抑癌基因参与了ESCC 的发生发展
既往研究证实,结肠癌中抑癌基因表达下调,而恢复其表达可致肿瘤细胞凋亡,抑制肿瘤细胞增殖[16]。一方面,ESCC 中抑癌基因表达下调可能是肿瘤发生的重要机制;另一方面,抑癌基因可能作为判断肿瘤患者预后的重要标记。Fan 等[17]经研究发现骨髓异常综合征患者SOX7 基因启动区CpG 岛的甲基化率(达58.1%)显著高于正常对照组,而该病进展至晚期后SOX7 甲基化率也显著高于早期患者,认为SOX7 的表达及其甲基化状态可能作为此类患者预后预测因子。师雅斌等[6]经研究指出ESCC 中LOC100130476 的甲基化可能是该病的特异性标志物,采用药物改变其第一外显子区甲基化状态有望成为临床治疗该病的一种可行性策略。鉴于此,我们推测ESCC 组织中LOC100130476 可能也与患者预后相关。本研究发现,ESCC 组织中LOC100130476 低表达组生存率、DFS 和OS 均较高表达组差(P<0.05),且其表达水平是影响患者不良预后的独立危险因素(P<0.05),推测LncRNA LOC100130476 低表达可能预测ESCC 预后不良。因此LOC100130476 可能在ESCC 的发生发展中发挥作用,且可作为预测临床预后的分子指标。
3.4 LncRNA LOC100130476 基因可能是影响ESCC 预后的独立危险因素
综上所述,LncRNA LOC100130476 在ESCC 组织中较癌旁组织显著下调,表达下调可能是ESCC 的发病机制之一,提示其可能作为抑癌基因参与了ESCC 的发生发展;LncRNA LOC100130476 在ESCC 组织中的表达水平是影响ESCC 患者预后的独立危险因素。本研究主要存在以下不足:(1)样本量较少,未就ESCC 组织中LncRNA LOC100130476 基因甲基化状态开展研究,这可能是阐述ESCC 组织中LncRNA LOC100130476 表达下调的重要机制;(2)ESCC 组织中LncRNA LOC100130476 表达下调的具体机制仍有待进一步研究。

