滩羊羔羊瘤胃和小肠菌群多样性的比较研究
金 鹿,桑 丹,张崇志,李胜利,张春华,张俊丽,施 安,孙海洲,李聚才
(1.内蒙古自治区农牧业科学院动物营养与饲料研究所/内蒙古自治区草食动物营养科学重点实验室,内蒙古 呼和浩特 010031;2.宁夏农林科学院动物科学研究所,宁夏 银川 750002)
胃肠道功能对于反刍动物的机体健康、 生产潜能的发挥至关重要。 微生物群落是维系胃肠道正常功能的关键因素, 胃肠道的微生态平衡与宿主的健康[1]和营养物质的消化吸收[2]息息相关。对于反刍动物而言, 胃肠道不同部位的微生物发挥的作用不同, 如瘤胃中的优势微生物群落主要由纤维素降解菌组成, 例如丝状杆菌属(Filamentous)、瘤胃球菌属(Ruminococcus)、白色瘤胃球菌(Ruminococcus albus)等,肠道中的优势菌群主要为可利用乳糖的微生物, 例如柔嫩梭菌(Clostridium tender)、拟球梭菌属(Clostridium)、直肠真杆菌(Eubacterium rectale)等,胃肠道不同部位的微生物在反刍动物疾病防控以及肠道健康方面起到关键作用[3-5]。 以前,通常以部分瘤胃或粪便样品反映整个胃肠道微生物的结构和组成[6-9],进而评估宿主的健康和营养状态。 近年来越来越多的研究表明,尽管在同一个体中,动物胃肠道不同部位的微生物群落多样性也存在较大差异[10-12]。 由此可见,利用反刍动物瘤胃和粪便微生物反映整个胃肠道微生物结构与组成具有片面性。 目前,猪[13]、肉鸡[14]、兔[15]等单胃动物和牛[16]、山羊[17]等反刍动物的胃肠道微生物多样性的研究取得了重要发现, 但是对滩羊断奶羔羊胃肠道微生物群落多样性的研究较少。该研究以宁夏滩羊作为研究对象,采用16S rDNA 高通量测序技术对羔羊瘤胃和小肠中的微生物群落进行测定, 探讨不同部位菌群特征及差异, 以期为通过营养干预手段调控胃肠道微生物定植、促进羔羊健康发育提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验试剂
DNA 提取试剂盒(QIAGEN)购自天根生化科技(北京)有限公司;2G Robust Hot Start Ready Mix(KAPA, KK5701) 和 文 库 定 量 试 剂 盒(KAPA,KK4824)购自上海易汇生物科技有限公司;核酸纯化试剂盒(Beckman Coulter,A63882)购自贝克曼库尔特商贸 (中国) 有限公司;DL 2 000 DNA Marker(TaKaRa,3427)购自大连宝生物工程有限公司;DNA 文库制备试剂盒(NEB,E7645S)购自南京赛泓瑞生物科技有限公司;MiSeqReagent Kit v3(600 cycle)(Illumina,15067874)购自上海生物工程技术有限公司。
1.1.2 试验仪器
PCR 仪 (ABI9700,USA)、Nanodrop 微量分光光度计(ND-1000 型,Thermo Scientific),美国生物分 析 仪 (2100,Agilent)、 生 物 大 分 子 分 析 仪(PerkinElmer)、高通量二代测序仪(PE300 平台,Illumina)。
1.1.3 试验动物及样品采集
选取体重18 kg 左右、65 日龄的断奶滩羊公羔12 只,屠宰后采集瘤胃、十二指肠、空肠和回肠内容物各12 管置于5 mL 的无酶无菌冻存管中,-80 ℃冰箱保存。
1.2 试验方法
1.2.1 样本DNA 提取
瘤胃和小肠内容物样本DNA 提取采用DNA提取试剂盒的标准方法, 采用琼脂糖凝胶电泳分析DNA 分子质量,用紫外分光光度计(Nanodrop)检测DNA 浓度和纯度。
1.2.2 16S rDNA 高可变区引物设计及PCR 扩增
以V3 和V4 为目标区域进行引物设计,引物序列见表1。PCR 反应体系见表2。PCR 扩增程序如下:94 ℃模板DNA 预变性5 min;94 ℃模板DNA 变性30 s,50 ℃模板DNA 与引物退火30 s,72 ℃延伸60 s,共30 个循环;72 ℃保持7 min;4 ℃保存。

表1 引物信息

表2 PCR 反应体系
1.2.3 测序
PCR 扩增后, 正反向引物两端分别加上不同的barcode 区分不同的肠道样本。 PCR 产物进行1.0%琼脂糖凝胶电泳检测,用PCR 纯化试剂盒对PCR 扩增产物进行纯化,并按测序要求混合。测序在北京奥维森基因科技有限公司提供的Mixed PE300 平台进行。
1.2.4 测序信息分析流程
对于MiSeq 测序获得的双端数据, 首先利用Trimmomatic、Pear 对Fastq 数据进行质控。 利 用Flash、Pear 根据PE 的overlap 关系对两端序列进行拼接(merge)处理,根据已知数据库用uchime方法比对去除Fasta 序列的嵌合体,对于未知数据库使用自比对(denovo)方法进行去除,同时去除不合要求的短序列。 对最终获得有效数据(clean data)进行OTU 聚类分析和物种分类学分析,数据分析程序见表3。

表3 数据分析程序列表
1.3 数据分析
采用SAS 9.0 软件提供的One-Way ANOVA程序进行单因素方差分析,用Duncan 氏新复极差法(SSR 法)进行多重比较。 试验数据用“平均值±标准差” 的形式表示,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 操作分类单位(OTU)数量
韦恩图(Venn)用于分析环境样品的OTU 数目组成相似性及重叠情况。 利用胃肠道细菌群落共享和独特的OTU 丰度进行分析。 由图1 可知,4个部位共产生2 147 个OTU, 瘤胃产生872 个OTU,十二指肠产生1 197 个OTU,空肠产生655 个OTU, 回肠产生1 277 个OTU,4 个部位共享了364 个OTU,占总OTU 数目的16.95%。十二指肠、回肠、瘤胃、空肠独有的OTU 类别和数目分别为450、445、278、28 个, 分 别 占 总OTU 数 目 的20.96%、20.73%、12.95%和1.30%,说明十二指肠、回肠和瘤胃增加了特有微生物的种类和多样性。
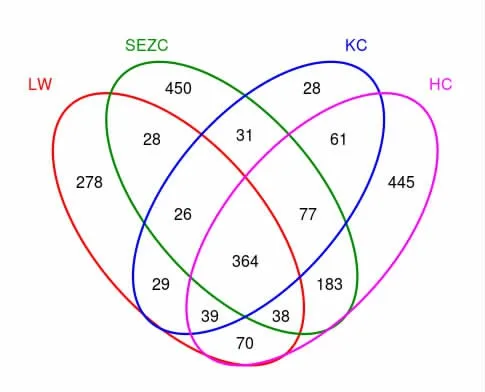
图1 胃肠道菌群Venn 图
2.2 Alpha 多样性分析
2.2.1 稀释曲线和Shannon 曲线
稀释曲线可以反映样品的测序深度,Shannon曲线反映各样品在不同测序数量时的微生物多样性, 即在97%相似度OTU 水平下的微生物多样性。 由图2 可知,随着测序深度的增加,曲线逐渐趋于平坦,说明此时的测序数据量合理。当测序深度较小时,Shannon 曲线迅速增加, 当测序深度达到5 000 reads 时,Shannon 曲线变缓,逐渐接近饱和状态,表明当测序深度达到5 000 reads 时,该数据量已足够进行样品菌群多样性分析(见图3)。

图2 样品的稀释曲线

图3 样品的Shannon 曲线
2.2.2 Alpha 多样性分析
Alpha 多样性分析与群落丰富度(community richness)和群落多样性(community diversity)有关,群落丰富度指数包括Chao1 指数, 群落多样性指数包括Shannon 指数和Simpson 指数。Chao1 指数用来估计OTU 数目,Shannon 指数和Simpson 指数为衡量微生物多样性的指数,Shannon 值越高、滩羊胃肠道微生物群落多样性越高。由表4 可知,瘤胃、十二指肠、空肠、回肠样品的Chao1 指数、Shannon 指数和Simpson 指数差异均不显著 (P>0.05),但十二指肠样品中Chao1 指数高于其他部位, 说明十二指肠中细菌群落总数高于其他肠道部位。瘤胃样品中Shannon 指数和Simpson 指数均高于十二指肠、空肠和回肠,说明瘤胃样品中细菌的多样性最丰富。每组测序覆盖率均高于99%,表明测序数据量是合理的, 并且能够反映滩羊羔羊胃肠道微生物群落情况。
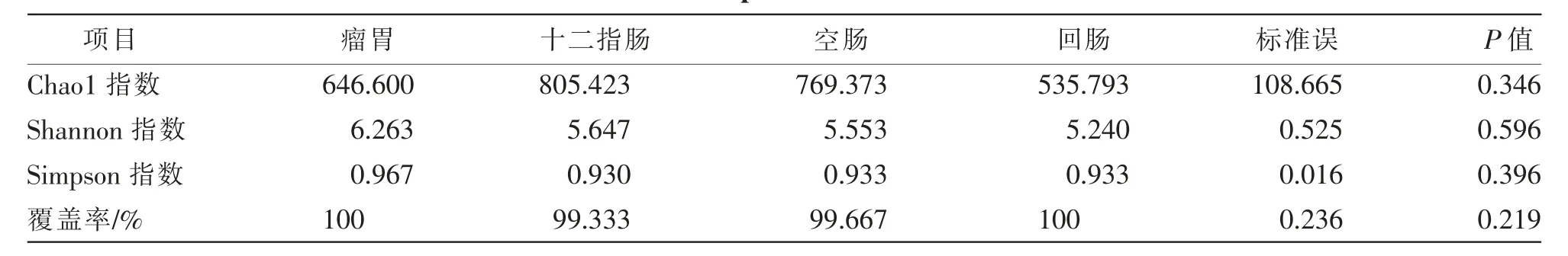
表4 Alpha 多样性指数
2.3 细菌组成和群落结构分析
2.3.1 门水平的结构分析
十二指肠、回肠、瘤胃和空肠菌群在门水平上的组成和相对丰度见表5 和图4, 检测结果包含21 个门,如厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放 线 菌 门(Actinobacteria)、螺 旋 菌 门(Spirochaetae)、变形菌门(Proteobacteria)、糖细菌门(Saccharibacteria)、软壁菌门(Tenericutes)、蓝藻菌门 (Cyanobacteria) 等。 4 个部位中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria) 为优势类群, 占总细菌数目的90%以上。瘤胃液中拟杆菌门(Bacteroidetes)、螺旋菌门(Spirochaetae)、丝状杆菌门(Fibrobacteres)的相对丰度显著(P<0.05)高于十二指肠、空肠和回肠,十二指肠中广古菌门(Euryarchaeota)的相对丰度与瘤胃相比有升高的趋势(0.05<P<0.10),空肠和回肠中厚壁菌门(Firmicutes) 的相对丰度显著(P<0.05)高于十二指肠。
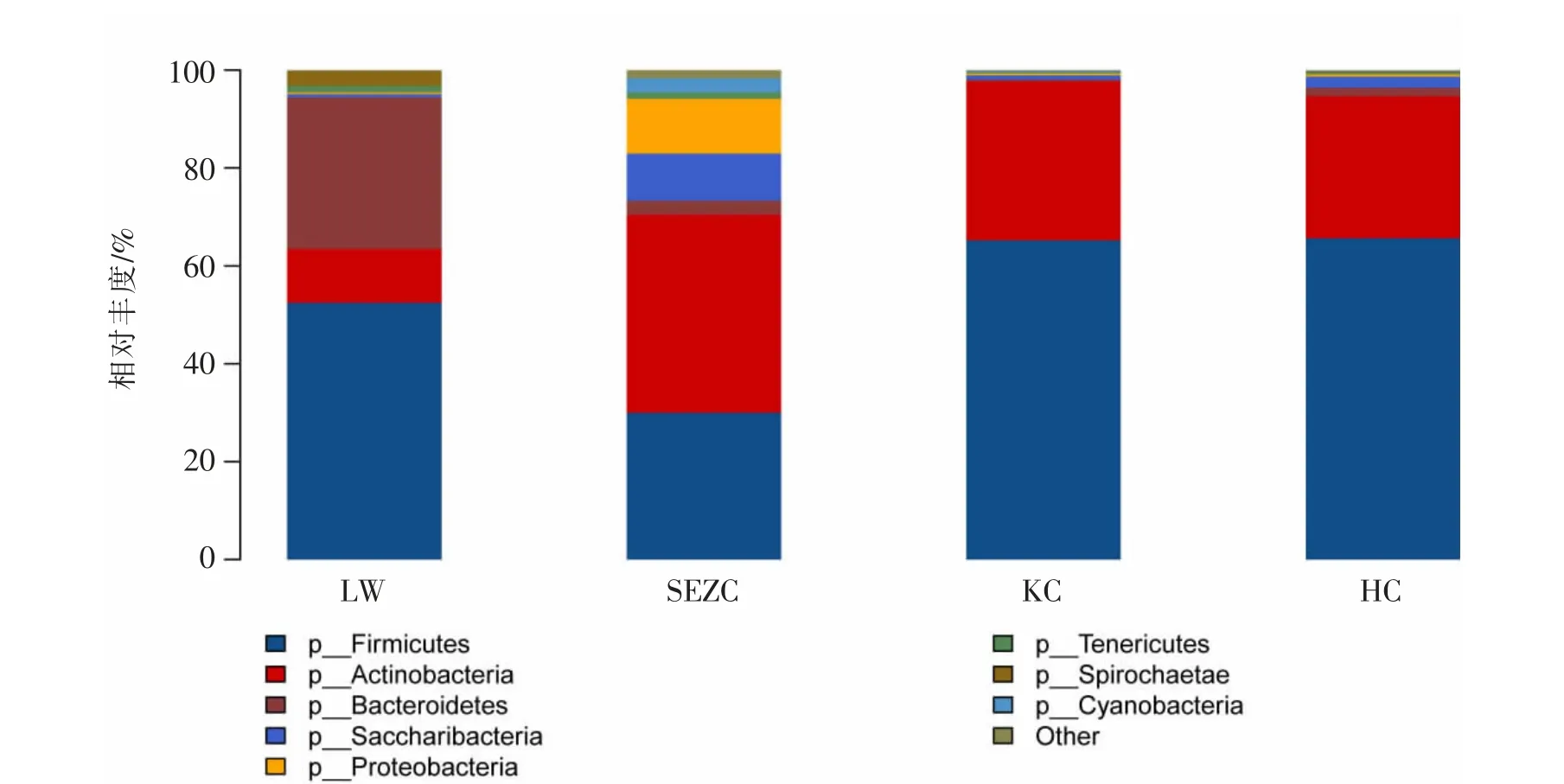
图4 门水平上胃肠道菌群分布图
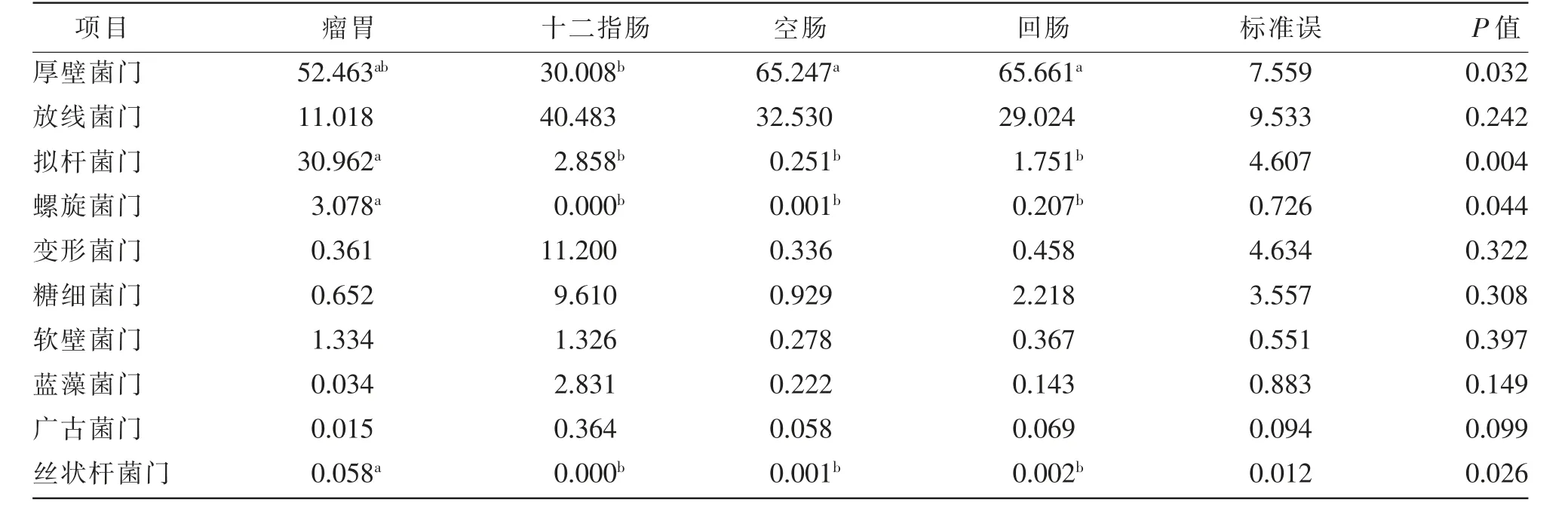
表5 滩羊羔羊胃肠道菌群在门水平的相对丰度(>1%)
2.3.2 属水平的结构分析
瘤胃、十二指肠、空肠和回肠菌群在属水平上的组成和相对丰度见表6 和图5。 从分析结果可知,4 个部位总共包含397 个属。 有19 个属的相对比例占到了总数的1%以上, 包括普雷沃菌属_1(Prevotella_1)、 克 里 斯 滕 森 菌 属 _R -7(Christensenellaceae_R-7_group)、 奥 尔 森 菌 属(Olsenella)、 理 研 菌 属 _RC9(Rikenellaceae_RC9_gut_group)、 毛 螺 菌 属_NK3A20(Lachnospiraceae_NK3A20_group)、密 螺旋 体 属 _2 (Treponema_2)、 糖 酵 菌 属(Saccharofermentans)、 双 歧 杆 菌 属(Bifidobacterium)、 瘤 胃 球 菌 属 _gauvreauii(Ruminococcus_gauvreauii_group)、瘤胃球菌属_UCG-014 (Ruminococcaceae_UCG-014)、 瘤胃球菌属_NK4A214 (Ruminococcaceae_NK4A214_group)、夏 普 菌 属 (Sharpea)、 毛 螺 旋 菌 属(Acetitomaculum)、互营球菌属(Syntrophococcus)、瘤胃球菌属_UCG-005 (Ruminococcaceae_UCG-005)、镰孢菌属(Catenisphaera)、产粪甾醇真细菌属(Eubacterium_co prostanoligenes_group)、Family_ⅩⅢ_AD3011_group 等。 瘤 胃 中 理 研 菌 属_RC9(Rikenellaceae_RC9_gut_group)、 密螺旋体 属_2(Treponema_2)、 瘤 胃 球 菌 属 _NK4A214(Ruminococcaceae_NK4A214_group)、普雷沃菌属_UCG-001(Prevotellaceae_UCG-001)相对丰度显著(P<0.05)高于十二指肠、空肠和回肠。 空肠中Family_ⅩⅢ_AD3011_group 相对丰度显著(P<0.05)高于其他部位。

图5 属水平上胃肠道菌群分布图
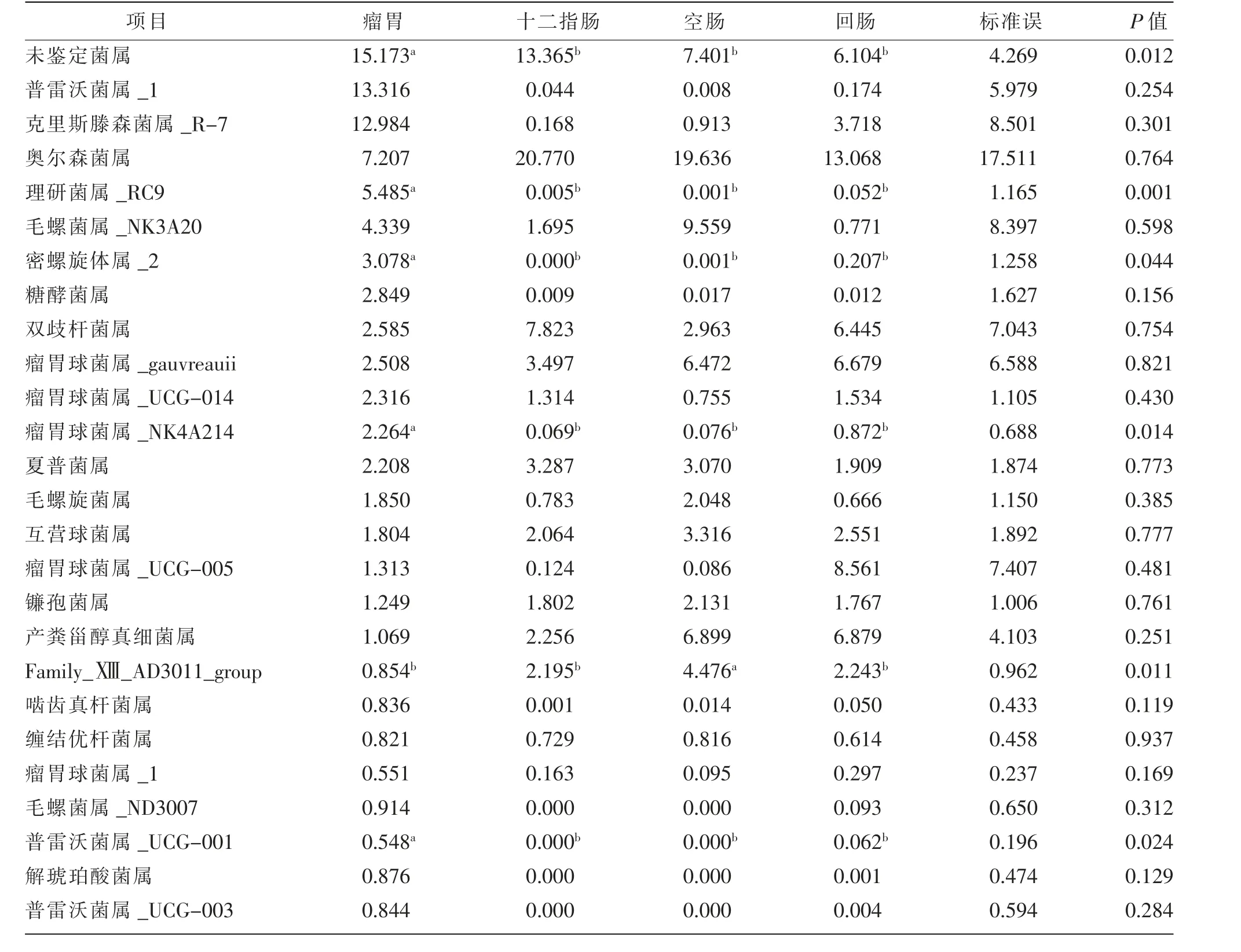
表6 滩羊羔羊胃肠道菌群在属水平的相对丰度(>1%)
3 讨论
反刍动物胃肠道微生态系统是机体最重要的微生态系统, 反刍动物胃肠道内的大量微生物有提供营养、抵御外界病原生物侵害、促进机体生长和生物屏障等作用,它们与机体互相制约,互相依存构成了动态、统一的平衡体。当机体处于健康状态时, 动物胃肠道内的微生物是相对平衡的微生态环境,对于宿主来说是一种有益的状态。健康的胃肠道微生物系统是动物内环境必不可少的组成部分[17]。目前,利用高通量测序技术研究绵羊瘤胃和粪便微生物, 尤其有关滩羊胃肠道微生物多样性的研究报道较少。 该试验采用二代测序技术分析滩羊羔羊胃肠道微生物组成及其丰度, 根据稀释曲线和Coverage 指数分析结果, 各组测序数据的覆盖率均高于99%, 能够真实全面反映胃肠道菌群组成情况。 根据Alpha 多样性分析可知,不同部位的细菌微生物多样性及相对丰度存在差异,瘤胃细菌的多样性最丰富。
动物胃肠道中的优势菌门是拟杆菌门和厚壁菌门[18-19]。 厚壁菌门能将饲料中纤维降解为挥发性脂肪酸,促进饲料消化和动物生长发育,而拟杆菌门能降解非纤维类物质[20-21]。 厚壁菌门和拟杆菌门可以促进机体吸收能量,因此,厚壁菌门与拟杆菌门细菌的比值可以反映机体的肥胖状况[22-23]。肠道中拟杆菌门的相对丰度与宿主的体脂含量呈显著负相关[24-25],拟杆菌门数量越多,机体对脂肪的分解和脂肪酸氧化的能力越高,因此,一定数量的拟杆菌有利于降低宿主的脂肪含量。王继文等[26]研究表明,在门水平上,厚壁菌门和拟杆菌门是山羊瘤胃微生物中的优势菌门, 且拟杆菌门丰度高于厚壁菌门。 Jesus-Laboy 等[27]研究表明,在山羊粪便微生物中, 厚壁菌门的相对丰度高于拟杆菌门。该试验结果表明,滩羊羔羊瘤胃中的微生物相对丰度最高的是厚壁菌门, 其次为拟杆菌门和放线菌门,3 种细菌占到总量的90%以上;滩羊羔羊十二指肠中的优势菌群依次为放线菌门、 厚壁菌门、变形菌门和糖细菌门;空肠和回肠中的优势菌群相似,均为厚壁菌门和放线菌门,且厚壁菌门所占比例高于放线菌门。 该研究结果与前人研究有所不同, 其原因可能是细菌的定植时间与动物日龄相关, 从不同日龄的动物中取到的微生物群落可能会有差异; 试验动物品种的选取、 饲粮的结构、 采样的部位和方式以及测序的区域对于微生物群落测定也会产生一定影响[20,28]。 在属水平上,滩羊羔羊瘤胃液中相对丰度较高的菌属为普雷沃菌属;十二指肠、空肠和回肠中相对丰度较高的菌属为奥尔森菌属,这与以往在其他反刍动物如奶牛[29]、肉牛[30]、绵 羊[31]以 及 山 羊[26]中 的 研 究 结 果 存 在 差异。 研究发现,同一品种的动物,不同肠段微生物组成存在特异性[32-33], 因为不同肠道部位的pH值、食糜蠕动、分泌物和氧化还原电位均不相同。奥尔森菌属是分布于健康牛瘤胃中的一种革兰阳性细菌,最终代谢产物主要是乙酸和乳酸[34]。普雷沃菌属是拟杆菌门的主要细菌, 可以独立降解蛋白质、糖类和碳水化合物等营养物质,由于该菌属微生物种型多、遗传多样性丰富、底物宽泛,所以能在瘤胃中处于优势地位[26]。由试验结果可知,利用反刍动物部分瘤胃和粪便微生物反映整个胃肠道微生物结构与组成具有片面性, 并不能反映真实情况。Frey 等[35]研究表明,在胃肠道进行食糜消化的全过程中,微生物结构在不断发生变化,所以食糜在胃肠道中消化的过程是导致胃肠道不同部位微生物组成存在差异的原因。
瘤胃球菌属是普遍存在于草食动物胃肠道的主要纤维降解菌, 包括黄色瘤胃球菌和白色瘤胃球菌,这2 种菌能够产生纤维水解酶,对粗饲料中纤维素和半纤维素的降解起着重要作用[36],但该研究发现瘤胃球菌属在瘤胃的丰度仅有6%左右,在小肠的丰度为4%~7%。 Girija 等[37]有关牛粪微生物的研究发现, 该菌属在瘤胃的丰度仅为2%,表明其在瘤胃中的占比很小, 说明以往借助传统分离培养技术得到的试验结果也许夸大了瘤胃球菌属在瘤胃中的作用。基于当前细菌数据库,该研究发现在滩羊羔羊瘤胃、肠道(十二指肠、空肠、回肠)内还检测到大量未被分类鉴定的菌属(Unidentified),提示在特定生态环境条件下形成的地方优良特色裘皮品种滩羊羔羊胃肠道可能存在特有的微生物菌群。
4 结论
滩羊羔羊瘤胃中细菌的多样性最丰富。 瘤胃微生物与十二指肠、 空肠和回肠的细菌区系显著不同,可能与其特定的功能差异有关。

