欧前胡素对阿尔茨海默病模型小鼠SIRT1和磷酸化PERK/eIF2α及CHOP蛋白表达的影响
万航娟,罗 丽,何 蔚
(1.赣南医学院2019级硕士研究生;2.赣南医学院药理学教研室;3.江西省脑血管药理重点实验室;4.心脑血管疾病防治教育部重点实验室,江西 赣州 341000)
阿尔茨海默病(Alzheimer's disease,AD)是一种常见的中枢神经退行性疾病,其发病机制复杂。研究发现,β-淀粉样蛋白(amyloid β,Aβ)在脑组织聚集形成淀粉样斑块及Aβ诱导内质网(endoplasmic reticulum,ER)持久应激反应导致神经损伤可能是AD的重要发病机制之一。ER应激相关分子葡萄糖调节蛋白78(Glucose-regulated protein 78,GRP78),也称为免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BiP)或 HSPA5,是热休克蛋白70(Heat Shock Protein 70,HSP70)家族的成员,存在于所有真核生物的ER膜上,是ER的分子伴侣。GRP78具有防止错误折叠的蛋白质或蛋白质亚基转运的作用。当蛋白折叠错误时,机体发生未折叠蛋白反应(The unfolded protein response,UPR),UPR是ER应激触发的一种机体适应性保护机制,旨在修复正常的ER功能。但是,持久或过度的ER应激可使UPR过度激活,UPR成为不良适应并可能促进细胞凋亡。蛋白激酶RNA样ER激酶(protein kinase RNA-like endoplasmic reticulum ki‐nase,PERK)是UPR反应的效应蛋白,当机体触发UPR,GRP78从PERK解离,PERK自身二聚化和C端Thr980位点自我磷酸化,激活的PERK可增强真核翻译起始因子2α(eukaryotic translation initiation factor-2α,eIF2α)蛋白Ser51位点磷酸化激活,磷酸化的eIF2α增加ATF4的翻译并诱导C/EBP同源蛋白(C/EBP homologous protein,CHOP)的表达,CHOP在细胞的氧化应激反应中起重要作用,主要有抑制细胞生长、促进DNA损伤等作用。Aβ大量聚集可导致ER持久应激反应,进而促使PERK和eIF2α磷酸化激活,引起CHOP表达上调,诱发神经损伤,导致AD发生和发展[1-2]。
沉默信息调节因子1(Silent information regula‐tor 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性组蛋白去乙酰化酶,在应激反应和细胞存活等生物学过程中起着重要作用。近期研究证实,SIRT1可通过抑制细胞凋亡和自噬等多种机制防止ER应激诱导的细胞损伤[3]。SIRT1激活对包括AD在内的神经退行性疾病的神经损伤具有保护作用,SIRT1可作为治疗AD的潜在药物靶点[4]。
欧前胡素(Imperatorin,IMP)是伞形科植物蛇床子、白芷、羌活等的有效成分之一,是一种呋喃香豆素。研究显示,欧前胡素具有抗炎、抗氧化和神经保护等作用[5-8],但其药理作用及作用机制尚未完全阐明。我们前期研究发现,欧前胡素在跳台实验和八臂迷宫行为学实验中对AD模型小鼠的学习记忆障碍具有明显的改善作用,另外,欧前胡素可减轻Aβ1-42致AD模型小鼠的神经性炎症和氧化应激损伤[9-11]。但是,欧前胡素防治AD的作用机制还未完全阐明。本研究将观察欧前胡素对SIRT1表达及对磷酸化PERK/eIF2α蛋白表达的影响,进一步探讨欧前胡素防治AD的作用机制,为欧前胡素临床上用于防治AD提供理论依据。
1 材料与方法
1.1 实验动物SPF级BABL/c小鼠,雄性,体重20~25 g,湖南斯莱克景达有限公司提供,生产许可证SCXK(湘)2019-0004。实验过程严格遵守实验动物使用相关伦理规定。
1.2 药品与试剂欧前胡素购自中国食品检定研究所(批号110826-201918,纯度99.5%),Aβ1-42购自sigma公司(货号 A9810-0.1MG),pierceTMBCA Protein Assay Kit购自Thermo公司(货号23227),LDH和MTT试剂盒购自南京建成有限公司,GRP78 ELISA检测试剂盒购自江苏晶美生物科技有限公司,SIRT1 ELISA检测试剂盒购自江苏晶美生物科技有限公司,β-actin(货号 4979)、eIF2α(货号9722)、p-eIF2α(货号 9721)、GRP78(货号 3177)、p-PERK(货号3179)、SIRT1(货号2493)、山羊抗兔IgG(货号7074)均购自Cell Signaling Technology公司,CHOP购自博士德生物工程有限公司,SuperSignalTMWest Pico Plus Luminol/Enhancer购自美国Thermo公司,二甲亚砜购自美国sigma公司(货号D2650)。
1.3 实验仪器Bio-Rad电泳系统(Bio-rad公司),Thermo Variokan Flash全波长读数仪(Thermo Fisher公司),TS-1000型脱色摇床(江苏海门其林贝尔仪器制造有限公司),多用途旋转摇床(江苏海门其林贝尔仪器制造有限公司),隔水式电热恒温培育箱(上海新苗医疗器械制造有限公司),高速冷冻离心机(Thermo Fisher有限公司),恒温浴槽HSS-1B(成都仪器厂),G box化学发光成像系统(美国Syngene公司),振动切片机(英国Campden Instruments公司),分析天平(瑞士Mettler toledo公司)。
1.4 离体脑片损伤模型制备与分组SPF级BABL/c雄性小鼠,体重20~23 g,8周龄,购自湖南斯莱克景达实验有限公司,自由饮食和自然条件下饲养1周,小鼠腹腔注射10%水合氯醛(350 mg·kg-1),小鼠麻醉后快速断头取脑,置于预冷的氧饱和人工脑脊液中冷却3 min后取出,使用振动切片机进行冠状切片制备离体脑片,切片厚度为400 μm。提前在24孔板中加入适量人工脑脊液,切好的脑片迅速转移到24孔板中,将24孔板转移至培养箱中(37 ℃、95% O2和5% O2)复苏30 min,进行离体脑片实验。脑片随机分为五组,分别为正常对照组(control)、溶媒对照组(vehicle)、Aβ1-42组(Aβ1-42)、Aβ1-42+欧前胡素低剂量组(IMP-L)、Aβ1-42+欧前胡素高剂量组(IMP-H)。在脑片复苏后,分别在溶媒对照组、欧前胡素低剂量组和欧前胡素高剂量组加入1%DMSO、10 μM和30 μM欧前胡素,孵育15 min后,分别在Aβ1-42组、欧前胡素低剂量组和欧前胡素高剂量组中加入10 μM Aβ1-42孵育12 h。
1.5 LDH活性检测和MTT实验脑片孵育结束后收集脑片,按照试剂盒说明书操作,用LDH活性检测脑片损伤和MTT法检测脑片活力。
1.6 ELISA检测脑片组织中SIRT1和GRP78的含量按照试剂盒说明书处理脑片组织样本,制备样品,按照说明书的步骤严格操作,蛋白定量使用BCA蛋白定量法检测。
1.7 小鼠AD模型的建立将灭菌用水加入Aβ1-42试剂瓶中,于37℃温育箱孵育4 d。用10%水合氯醛(350 mg·kg-1)给小鼠腹腔注射,小鼠麻醉后进行侧脑室内注射,根据侧脑室注射位点立体定位(AP:−0.5 mm,ML:±1.0 mm,DV:−2.5 mm),用10 μL微量注射器缓慢注射410 pmol(3 μL)Aβ1-42,注射结束后停针3 min再拔针。对照组小鼠注射相同体积的灭菌注射用水。
1.8 实验动物分组与给药雄性小鼠随机分成正常对照组、AD模型组、AD模型+欧前胡素2.5 mg·kg-1组(IMP-L)、AD模型+欧前胡素5.0 mg·kg-1组(IMP-H)。欧前胡素给药组自造模当天开始腹腔注射给药,给药体积为10 mL·kg-1,1次·d-1,连续13 d,正常对照组和AD模型组小鼠在相同时间腹腔注射等量溶媒进行对照。
1.9 小鼠海马组织中蛋白的测定小鼠腹腔注射给药连续13 d后,将动物麻醉断头取脑,分离出海马组织并分装于冷冻管中,液氮中保存,用于各观察指标测定。按照试剂盒说明书处理海马组织样本,制备样品,按照说明书的步骤严格操作,蛋白定量使用BCA蛋白定量法检测。
1.10 Western Blot检测蛋白的表达给药13 d取小鼠的海马组织,提取细胞总蛋白后,用BCA定量法将蛋白定量至100 μg,制备8%聚丙烯酰胺凝胶,每孔上样20 μL,经过SDS-PAGE凝胶电泳分离蛋白,恒压转膜,将蛋白转至PVDF膜后,用5%脱脂奶粉室温封闭 1 h,封闭后加一抗 SIRT1(1∶1 000),PERK(1∶1 000)、p-PERK(1∶500)、eIF2α(1∶1 000)、p-eIF2α(1∶500)、GRP78(1∶500)和 CHOP(1∶500)4℃冰箱孵育过夜,TBST洗膜后,PVDF膜中加入二抗(1∶5 000),室温孵育1 h。膜经过TBST洗涤后,在暗室中加入显影液,化学发光法检测,扫描灰度值用Image J软件对条带进行灰度分析。
1.11 统计方法数据使用SPSS软件进行分析,用GraphPad Prism软件绘图,数据以均数±标准差表示,多组间比较使用单因素方差分析,两组间比较使用LSD检验,P<0.05为差异有统计学意义。
2 结 果
2.1 欧前胡素对Aβ1-42致小鼠离体脑片损伤后LDH活性的影响与溶媒对照组相比,Aβ1-42损伤组小鼠脑片组织中LDH的活性明显升高(P<0.01);与Aβ1-42损伤组比较,用10 μM和30 μM欧前胡素预处理后脑片组织中LDH活性明显降低(10 μM组:P<0.05,30 μM组:P<0.01),差异有统计学意义(图1)。

图1 欧前胡素对Aβ1-42致小鼠离体脑片损伤后LDH活性的影响(n=6,±s)
2.2 欧前胡素对Aβ1-42致小鼠离体脑片损伤后脑片活力的影响与溶媒对照组相比,Aβ1-42损伤组小鼠脑片损伤后脑片活力降低(P<0.05),与Aβ1-42损伤组比较,10 μM欧前胡素预处理组脑片活力有升高的趋势,但无统计学意义,30 μM欧前胡素预处理组脑片活力升高(P<0.01),差异有统计学意义(图2)。

图2 欧前胡素对Aβ1-42致小鼠离体脑片损伤后脑片活性的影响(n=4,±s)
2.3 欧前胡素对Aβ1-42致小鼠离体脑片损伤后SIRT1和GRP78含量的影响ELISA结果显示,与溶媒对照组相比,Aβ1-42损伤组小鼠脑片SIRT1水平降低(P<0.01)(图3),GRP78水平升高(P<0.05)(图4);与Aβ1-42损伤组比较,10 μM欧前胡素预处理组脑片组织中SIRT1水平有升高的趋势,但无统计学意义,30 μM欧前胡素预处理组脑片组织中SIRT1水平升高(P<0.05),差异有统计学意义(图3),10 μM和30 μM欧前胡素预处理组脑片组织中GRP78水平降低(10 μM组P<0.05,10 μM组P<0.01),差异有统计学意义(图4)。

图3 欧前胡素对Aβ1-42致小鼠离体脑片损伤后SIRT1含量的影响(n=6,±s)

图4 欧前胡素对Aβ1-42致小鼠离体脑片损伤后GRP78含量的影响(n=6,±s)
2.4 欧前胡素对小鼠海马组织中SIRT1蛋白表达的影响与假手术组比较,AD模型组小鼠的海马组织中SIRT1的蛋白表达比假手术组低(P<0.05);与AD模型组比较,欧前胡素低剂量给药组中SIRT1的蛋白表达有上升的趋势,但差异无统计学意义,欧前胡素高剂量给药组中SIRT1的蛋白表达水平比AD模型组高(P<0.05),差异有统计学意义(图5)。

图5 欧前胡素对AD小鼠海马组织中SIRT1蛋白表达的影响(n=4,±s)
2.5 欧前胡素对小鼠海马组织中GRP78蛋白表达的影响与假手术组比较,AD模型组小鼠的海马组织中GRP78的蛋白表达比假手术组高(P<0.05);与AD模型组比较,欧前胡素用药组中GRP78的蛋白表达比AD模型组低(2.5 mg·kg-1组:P<0.05,5.0 mg·kg-1组:P<0.01)(图6),提示欧前胡素可抑制GRP78的蛋白表达,对内质网应激反应有一定的抑制作用。

图6 欧前胡素对AD小鼠海马组织中GRP78蛋白表达的影响(n=4,±s)
2.6 欧前胡素对PERK、p-PERK、eIF2α和p-eIF2α蛋白表达的影响与假手术组相比,AD模型组小鼠的海马组织中p-PERK/PERK和p-eIF2α/eIF2α的比值均比假手术组高(对于p-PERK/PERK,P<0.05;对于p-eIF2α/eIF2α,P<0.01)。与AD模型组比较,2.5 mg·kg-1欧前胡素用药组中p-PERK/PERK和p-eIF2α/eIF2α的比值变化均不明显,差异均无统计学意义;5.0 mg·kg-1欧前胡素用药组中p-PERK/PERK和p-eIF2α/eIF2α的比值均比AD模型组低(P均<0.01)(图7,图8)。提示欧前胡素可抑制AD小鼠的海马组织中PERK和eIF2α的磷酸化激活。
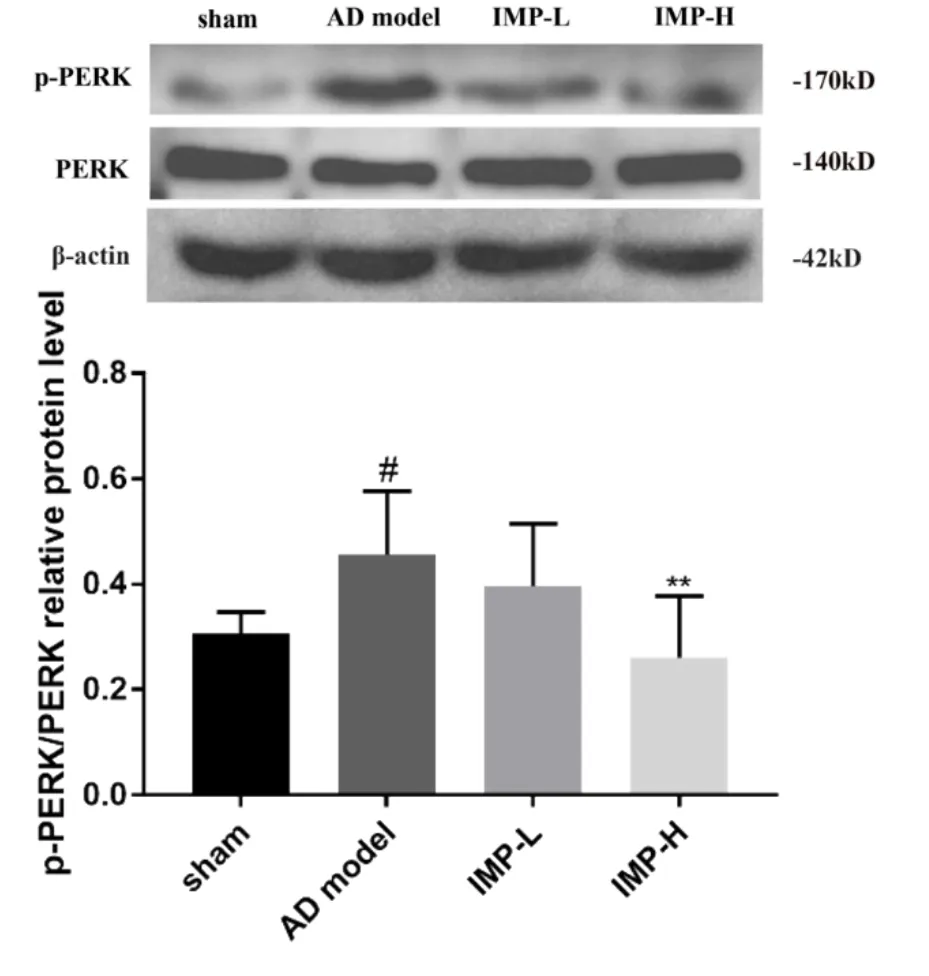
图7 欧前胡素对AD小鼠海马组织中p-PERK/PERK的影响(n=4,±s)

图8 欧前胡素对AD小鼠海马组织中p-eIF2α/eIF2α的影响(n=4,±s)
2.7 欧前胡素对CHOP蛋白表达的影响与假手术组比较,AD模型组小鼠的海马组织中CHOP的蛋白表达比假手术组高(P<0.01);与AD模型组比较,2.5 mg·kg-1欧前胡素给药组CHOP的蛋白表达变化不明显,差异无统计学意义,5.0 mg·kg-1欧前胡素给药组CHOP的蛋白表达水平比AD模型组低(P<0.01),差异有统计学意义(图9)。

图9 欧前胡素对AD小鼠海马组织中CHOP的影响(n=4,-x±s)
3 讨论
侧脑室内注射Aβ1-42诱导AD模型是一种常用的“Aβ级联反应假说”相关AD动物模型,被国内外学者用于研究AD的发病机制以及用于筛选和评价药物的抗AD作用。我们前期采用跳台法观察到欧前胡素能改善Aβ1-42致小鼠AD后学习记忆障碍,用八臂迷宫实验观察了欧前胡素对AD模型小鼠的空间学习记忆障碍的影响,提示欧前胡素对AD的学习记忆障碍具有保护作用。同时,本课题组还证实欧前胡素可减轻AD模型小鼠氧化应激反应和神经性炎症反应[9-11]。本实验我们参照本课题组前期实验,选用2.5 mg·kg-1和5.0 mg·kg-1腹腔注射给药,连续给药 13 d[9-11],进一步观察了欧前胡素对 Aβ1-42致AD模型小鼠ER应激反应及相关蛋白的影响。
ER应激反应是一种适应性保护机制,可防止应激后ER稳态的破坏。研究证实,ER应激与AD的病理机制密切相关,轻微ER应激反应在AD发病中具有保护作用,过强的ER应激反应可导致细胞死亡,从而促进AD的发生发展[12-13]。GRP78是一种重要的ER分子伴侣,参与调控ER应激反应,GRP78是ER应激的重要标志蛋白。Aβ聚集可诱导ER应激反应及上调GRP78的表达[14]。本研究显示,欧前胡素可抑制Aβ1-42致离体脑片损伤,减少LDH释放,增加脑片活力,减少GRP78的产生。另外,给小鼠脑室内注射Aβ1-42后海马组织中GRP78的蛋白水平上调,欧前胡素用药组小鼠海马组织中GRP78蛋白水平较低,提示欧前胡素可抑制Aβ1-42诱导AD模型小鼠GRP78水平的上调,对Aβ1-42诱导小鼠海马组织ER应激反应有一定程度的抑制作用。
研究显示,在AD患者和AD实验动物模型的大脑中PERK和eIF2α磷酸化激活水平均明显上升,PERK和eIF2α信号通路激活是AD的重要发病机制之一[15]。PERK的基因缺失可抑制eIF2α Ser51位点的磷酸化激活,减轻神经损伤,改善APP/PS1 AD小鼠的空间记忆障碍。研究还发现,另一种eIF2α激酶GCN2的缺失也可抑制eIF2α的磷酸化激活,抑制神经损伤,从而改善APP/PS1小鼠空间记忆障碍[16]。本研究显示,AD模型小鼠海马组织中p-PERK/PERK和p-eIF2α/eIF2α的比值均增加,欧前胡素用药组海马组织中p-PERK/PERK和p-eIF2α/eIF2α的比值均比AD模型组低,提示欧前胡素可抑制PERK/eIF2α的磷酸化激活,缓解Aβ1-42诱导ER应激导致的神经损伤,从而发挥对AD的神经保护作用。
PERK/eIF2α磷酸化激活可增加ATF4的表达,进而诱导下游CHOP表达上调。CHOP具有抑制细胞生长和促进DNA损伤的作用。CHOP过表达可通过线粒体途径诱导细胞凋亡,敲除CHOP基因或下调CHOP的表达可减轻内质网应激反应诱导的细胞凋亡[17]。本研究显示,AD模型小鼠海马组织中CHOP的蛋白表达明显升高,欧前胡素可下调海马组织中CHOP的蛋白表达,提示欧前胡素可能通过抑制CHOP的蛋白表达,缓解Aβ1-42诱导ER应激导致的神经损伤。
SIRT1可通过增强细胞的抗应激能力促进细胞生存,对ER应激诱导的细胞损伤具有保护作用[18]。研究证实,SIRT1通过去乙酰化作用在赖氨酸位点使eIF2α脱乙酰基,从而抑制PERK/eIF2α通路的过度活化[19]。ZHANG Y等[20]发现SIRT1通过降低Aβ的前体蛋白APP、提高BACE-1活性,对神经细胞有保护作用。SIRT1天然激活剂可上调SIRT1的表达,减轻AD模型小鼠中枢神经系统退行性变化和改善认知功能障碍。SIRT1的过表达可抑制Aβ1-42诱导的小胶质细胞BV2细胞NF-κB途径激活,并减轻Aβ对原代培养大脑皮层细胞的毒性[21],促进SIRT1的表达,对AD模型实验动物具有神经保护作用[22]。本研究显示,AD模型小鼠海马组织中SIRT1的蛋白表达量明显下降,欧前胡素可上调SIRT1的蛋白表达含量,提示欧前胡素可能通过上调SIRT1,减轻ER应激诱导的神经损伤。
总之,欧前胡素可上调Aβ致AD模型小鼠海马组织中SIRT1表达,抑制PERK/eIF2α的磷酸化激活,降低CHOP表达,减轻Aβ诱导ER应激反应所致的神经损伤,这可能是欧前胡素防治AD的作用机制之一。本课题组将进一步研究欧前胡素抗AD的机制,为欧前胡素临床用于治疗AD提供理论依据。

