不同剂量瑞舒伐他汀结合依折麦布治疗急性心肌梗死的效果及安全性分析
宁康康,赵江峰,杨冬谊
(1.河南省宜阳县中医院心血管科,河南 宜阳 471600;2.河南科技大学第一附属医院心内科,河南 洛阳 471003;3.河南中医药大学第一附属医院介入科,河南 郑州 450099)
急性心肌梗死(AMI)作为一类冠脉急性持续性缺血引发的心肌坏死,患者通常可感受到来自胸骨后持续剧烈的疼痛,同时可出现循环功能异常、心衰、发热等症状[1-2]。目前临床多依据心电图检查、心功能及血清酶相关指标检测等方式进行诊断[3]。AMI发病与多种因素相关,研究[4]显示,约九成患者心肌缺血症状发生前存在冠状动脉粥样硬化引发的管腔狭窄,相关区域侧支循环并未有效建立,从而使心肌供血情况恶化。亦有研究[5-6]指出,AMI发病受血脂水平影响较大,高血压、高胆固醇血症均为其发病的危险因素。近年来,他汀类药物作为临床重要调脂药物,在心血管疾病治疗、预防中的应用占比较大,其作为羟甲基戊二酸辅酶A(HMG-CoA)的还原酶抑制剂,可于机体细胞内对羟甲基戊酸代谢进行阻断,减少胆固醇合成,瑞舒伐他汀作为其中具有多向性效应的药物,可促进AMI患者的心室重构,有助于左心室结构及功能的保护,而依折麦布作为一类胆固醇吸收抑制剂,被证实与他汀类药物可协同发挥调脂疗效[7]。欧美指南对于AMI的治疗推荐阿托伐他汀80 mg或瑞舒伐他汀20~40 mg大剂量治疗,如果低密度脂蛋白胆固醇(LDL-C)高于4.14 mmol/L,预估高强度他汀难以降脂达标1.8 mmol/L以下,也可以依折麦布与高强度他汀同时启用[8]。目前我国临床暂无针对联合用药前提下的药物剂量限定相关研究,本次研究将进一步探究不同剂量瑞舒伐他汀结合依折麦布治疗AMI的疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年10月—2020年06月于我院就诊的63 例AMI患者作为研究对象,按照随机数字表法分为对照组、常规剂量联合组、大剂量联合组各21 例。纳入标准:①符合《急性心肌梗死诊断和治疗指南》中相关诊断标准[9],且于发病12 h内完成PCI介入治疗,入院后生化血脂LDL-C>3.2 mmol/L,预估常规治疗可能无法血脂达标;②于本次研究前2 周内未服用调脂药;③年龄30~80 岁,对本次研究知情同意。排除标准:①合并全身感染、心肌炎、心肌病者;②存在肝肾功能异常者;③具有他汀类药物严重不良反应史者;④合并恶性肿瘤者。剔除标准:所有患者出院前以及出院4 周需各复查肝功能、肌酶一次,指标升高2倍以上者剔除研究。本次研究经医院伦理委员会审批通过。三组一般资料:大剂量联合组男14 例,女7 例;年龄为38~72岁,平均(57.63±7.25)岁;心肌梗死部位:前壁12 例,前间壁6 例,下壁3 例。常规剂量联合组男12 例,女9 例;年龄为40~71 岁,平均(57.87±7.67)岁;心肌梗死部位:前壁13 例,前间壁5 例,下壁3 例。对照组男13 例,女8 例;年龄为39~73岁,平均(57.41±7.60)岁;心肌梗死部位:前壁12 例,前间壁5 例,下壁4 例。三组患者一般资料差异无统计学意义(P>0.05),可比性充分。
1.2 治疗方法 三组均接受介入治疗、抗血小板用药等常规治疗方式,对照组睡前应用瑞舒伐他汀(阿斯利康药业有限公司,进口药品注册号H20110565,片剂)治疗,每次用药10 mg,1 次/d;常规剂量联合组在对照组基础上联用依折麦布(杭州默沙东制药有限公司,进口药品注册号H20130837,片剂)治疗,每次用药10 mg,1 次/d,大剂量联合组则将常规剂量联合组瑞舒伐他汀用量调整为20 mg/次。三组治疗均持续12 周。
1.3 指标检测方法 分别于治疗前、治疗7 d后采用免疫荧光法测定三组B型利钠肽原(ProBNP)水平,采用酶联免疫吸附试验法(ELISA)测定三组C-反应蛋白(CRP)水平,采用全自动血沉仪测定三组血沉(ESR)水平。分别于治疗前、治疗1 个月后采用生化分析仪测定三组甘油三酯(TG)、总胆固醇(TC)、LDL-C、高密度脂蛋白胆固醇(HDL-C)水平。分别于治疗前、治疗12 周后采用多普勒超声诊断仪测定三组左室舒张期末内径(LVEDD)、左心室射血分数(LVEF)、左室收缩期末内径(LVESD)。
1.4 观察指标 比较治疗前及治疗7 d后三组血清学指标(ProBNP、CRP)、ESR变化,比较治疗前及治疗1 个月后三组血脂水平(TG、TC、LDL-C、HDL-C),比较治疗前及治疗12 周后三组心功能(LVEDD、LVEF、LVESD)变化,比较三组治疗后12 周内心血管不良事件发生情况及药物不良反应发生情况,其中肌痛指横纹肌溶解,患者血清肌酸激酶浓度达到1 200 U/L以上,肝功能损害则指患者血清丙氨酸氨基转移酶浓度达到80 U/L以上。
1.5 统计学方法 应用SPSS 21.0分析数据,计量资料以(±s)表示,三组间比较采用单因素方差分析,组内同期比较采用配对t检验,计数资料以例数、百分率(%)表示,组间比较采用χ2检验。P<0.05被认为差异具有统计学意义。
2 结果
2.1 血清学指标、ESR比较 治疗7 d后,三组ProBNP、CRP、ESR均较治疗前显著降低(P<0.05),其中大剂量联合组明显低于对照组、常规剂量联合组(P<0.05)。(表1)
表1 三组ProBNP、CRP、ESR比较( ±s)

表1 三组ProBNP、CRP、ESR比较( ±s)
注:与同时间对照组相比,*P<0.05;与同时间常规剂量联合组相比,#P<0.05;与同组治疗前相比,★P<0.05。
组别 时间 例数 ProBNP(pg/mL) CRP(ng/L) ESR(mm/h)大剂量联合组 治疗前 21 683.78±135.36 15.86±1.29 19.14±2.31治疗7 d后 21 296.36±89.14*#★ 5.02±0.65*#★ 11.86±1.03*#★常规剂量联合组 治疗前 21 676.39±142.25 15.64±1.41 19.02±2.19治疗7 d后 21 355.38±92.13*★ 5.96±0.59*★ 13.05±1.06*★对照组 治疗前 21 689.73±93.42 15.52±1.44 19.53±2.34治疗7 d后 21 445.46±98.16★ 7.05±0.62★ 16.52±1.32★
2.2 血脂水平比较 治疗1 个月后,三组TG、TC、LDL-C均较治疗前显著降低(P<0.05),其中大剂量联合组明显低于对照组、常规剂量联合组(P<0.05);三组HDL-C均较治疗前无显著变化,且组间差异无统计学意义(P>0.05)。(表2)
表2 三组TG、TC、LDL-C、HDL-C比较(mmol/L,±s)
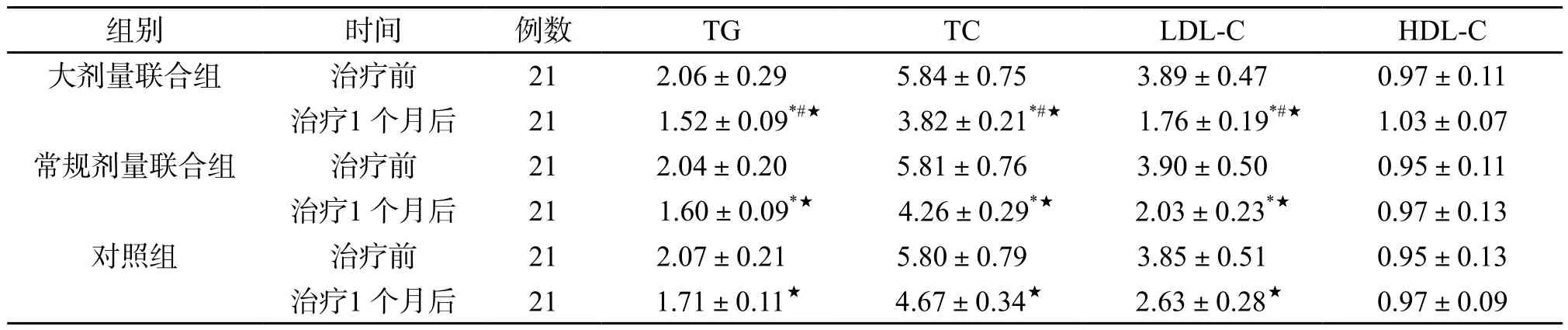
表2 三组TG、TC、LDL-C、HDL-C比较(mmol/L,±s)
注:与同时间对照组相比,*P<0.05;与同时间常规剂量联合组相比,#P<0.05;与同组治疗前相比,★P<0.05。
组别 时间 例数 TG TC LDL-C HDL-C大剂量联合组 治疗前 21 2.06±0.29 5.84±0.75 3.89±0.47 0.97±0.11治疗1 个月后 21 1.52±0.09*#★ 3.82±0.21*#★ 1.76±0.19*#★ 1.03±0.07常规剂量联合组 治疗前 21 2.04±0.20 5.81±0.76 3.90±0.50 0.95±0.11治疗1 个月后 21 1.60±0.09*★ 4.26±0.29*★ 2.03±0.23*★ 0.97±0.13对照组 治疗前 21 2.07±0.21 5.80±0.79 3.85±0.51 0.95±0.13治疗1 个月后 21 1.71±0.11★ 4.67±0.34★ 2.63±0.28★ 0.97±0.09
2.3 心功能比较 治疗12 周后,三组LVEDD、LVESD均较治疗前扩大(P<0.05),组间差异无统计学意义(P>0.05),三组LVEF均较治疗前降低(P<0.05),大剂量联合组LVEF明显高于对照组、常规剂量联合组(P<0.05)。(表3)
表3 三组LVEDD、LVEF、LVESD比较(±s)
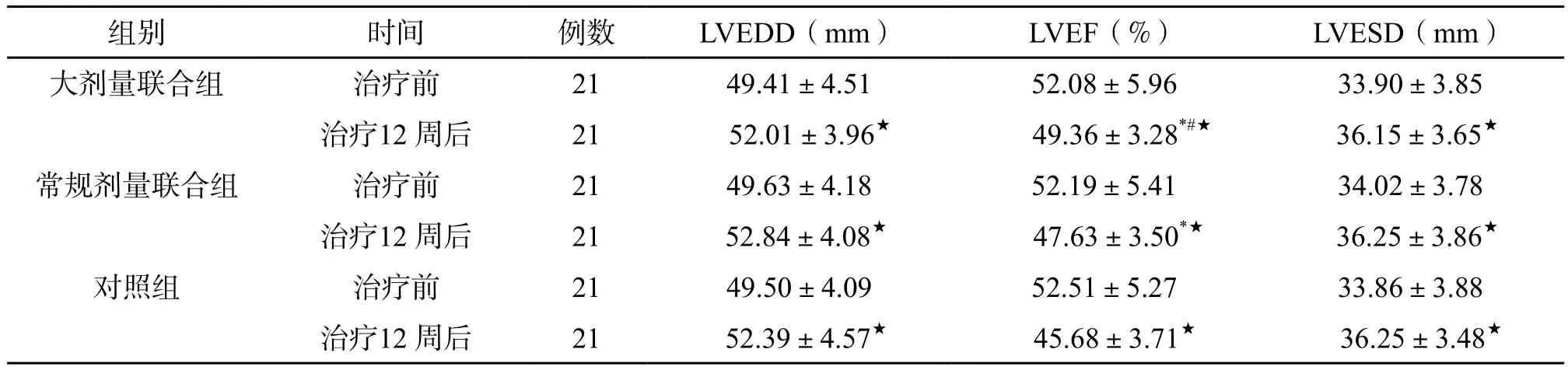
表3 三组LVEDD、LVEF、LVESD比较(±s)
注:与同时间对照组相比,*P<0.05;与同时间常规剂量联合组相比,#P<0.05;与同组治疗前相比,★P<0.05。
组别 时间 例数 LVEDD(mm) LVEF(%) LVESD(mm)大剂量联合组 治疗前 21 49.41±4.51 52.08±5.96 33.90±3.85治疗12 周后 21 52.01±3.96★ 49.36±3.28*#★ 36.15±3.65★常规剂量联合组 治疗前 21 49.63±4.18 52.19±5.41 34.02±3.78治疗12 周后 21 52.84±4.08★ 47.63±3.50*★ 36.25±3.86★对照组 治疗前 21 49.50±4.09 52.51±5.27 33.86±3.88治疗12 周后 21 52.39±4.57★ 45.68±3.71★ 36.25±3.48★
2.4 心血管不良事件发生情况比较 治疗后12 周内,三组心血管不良事件总发生率差异无统计学意义(P>0.05)。(表4)

表4 三组心血管不良事件发生率比较[例(%)]
2.5 药物不良反应发生情况比较 治疗后12 周内,三组药物不良反应发生率差异无统计学意义(P>0.05)。(表5)
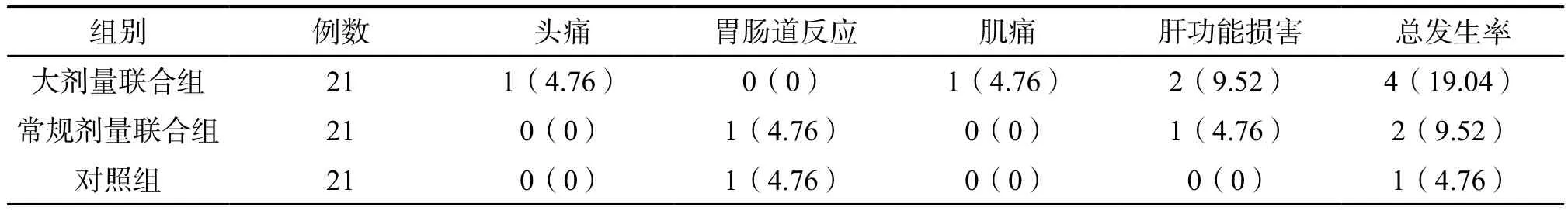
表5 三组药物不良反应发生率比较[例(%)]
3 讨论
大部分AMI患者发病后需以介入治疗再通冠状动脉、挽救濒死心肌、控制梗死范围,并积极处理相关并发症,以减少患者短期病死风险。血脂水平作为影响此类患者介入治疗预后情况的重要因素,已有相关研究[10]证实,LDL-C水平与心血管不良事件发生风险呈正相关,同时其水平升高可对心功能造成一定负面影响,故对AMI患者予以适当剂量的调脂药极为关键。
AMI患者大多具备动脉粥样硬化引发的冠状动脉狭窄情况,在激动、过劳、饮酒过量等诱因的作用下引发斑块破裂,从而造成血小板在破裂部位异常凝集,最终促使血栓形成、冠状动脉堵塞,心肌因供血不足而发生急性坏死。AMI患者中普遍存在心肌重构环节,期间可伴随心肌细胞代偿性肥大、局部炎症反应加剧,均可加剧心肌损伤,并影响心功能状态[11]。本次研究中,经12 周治疗后,三组LVEDD、LVESD均有所扩大,组间差异无统计学意义(P>0.05),但大剂量联合组LVEF高于前两组,提示应用20 mg瑞舒伐他汀联合依折麦布治疗AMI相较于常规剂量在心功能保护方面更具优势,分析其原因在于瑞舒伐他汀具有他汀类药物共有的药效基因,可竞争性抑制HMG-CoA发挥其调脂作用,使血清胆固醇水平下降,减少因血脂异常引发的心肌损伤,促进心功能恢复;另一方面,瑞舒伐他汀可发挥一定的抗炎、抗氧化、抗血栓、稳定斑块作用,多种药效配合可使AMI患者心肌损伤情况减轻,心功能得到有效保护。而瑞舒伐他汀中除二羟基庚酸外,其余分子结构不同于其他他汀类药物,所具备的极性甲磺酰氨基可使其亲脂性表现较低,从而具有较低的被动扩散能力,对于非肝细胞难以进入,而其水溶性性质更有利于规避由细胞色素P450进行广泛代谢的不足,在与依折麦布联合应用中相互作用风险明显降低,配合依折麦布在调脂、抗炎方面的增效作用,共同改善患者的心功能状态。
目前在冠心病治疗中常用的药物为他汀类药物,此类药物可通过竞争性抑制HMG-CoA发挥血脂调节、炎症抑制的作用,此外亦可减轻血管损伤。该类药物中临床常见的为瑞舒伐他汀、阿托伐他汀,前者在血脂调节、内皮功能改善方面的作用被证实优于后者[12-13],且因其具备的极性甲磺酰氨基分子结构表现出药物代谢方面的优势,在临床应用中更受推崇。但瑞舒伐他汀在应用剂量选择中存在一定争议,认为其在小剂量应用中难以取得良好的降脂效果,而加大剂量则有可能在提高疗效的基础上增加不良反应的发生风险。依折麦布作为非他汀类胆固醇吸收抑制剂,其可通过结合他汀类药物改善临床调脂疗效,目前其联合应用的效果已在部分冠心病患者、糖尿病患者中得到证实[14-15]。本次研究中,经1 个月治疗后,三组TG、TC、LDL-C、ProBNP、CRP、ESR水平均有所降低,其中大剂量联合组数据变化幅度最为显著,常规剂量联合组次之,对照组变化幅度最小,且大剂量联合组HDL-C水平轻微升高,提示应用20 mg瑞舒伐他汀联合依折麦布治疗AMI相较于常规剂量在血脂调节、抗炎、稳定斑块方面效果更为显著,分析其原因在于针对AMI患者调高瑞舒伐他汀用药剂量,其对内源性胆固醇合成限速酶的抑制作用更强,调脂疗效表现更佳,而依折麦布可通过抑制机体对胆固醇的吸收,起到降低血清TC的作用,此外其可对LDL-C受体合成产生抑制作用,从而调控LDL-C表达,更有利于促进动脉斑块消除,减少相关心血管不良事件的发生率,同时两种用药协调治疗并未产生药物动力学方面的相互作用,加之大剂量联合组考虑到联合用药,仅将剂量增加10 mg,且本次各组纳入样本量有限,使三组在药物不良反应方面未表现出明显差异,但值得注意的是大剂量用药仍存在一定肝损伤风险,临床需进一步加强肝功能监测,及时调节药量。
综上所述,对AMI患者应用20 mg瑞舒伐他汀联合依折麦布治疗效果显著,有利于其调节血脂水平,同时可减轻PCI术后急性期的心肌炎症、损伤,改善心功能,但本次研究样本要求LDL-C基线水平较高,样本量偏少,无法代表所有心梗患者,故仍需继续扩大样本量、延长随访周期以及观察远期心血管事件以获得更完整的结果。

