回收甲状腺细针穿刺液基细胞进行BRAFV600E检测的应用价值
曹 丹,吕京澴,陈汝蕾
(南京医科大学附属苏州医院,苏州市立医院病理科,江苏 苏州 215002)
随着甲状腺结节发病率的提高,除了超声检查外,多项研究表明,细针穿刺细胞学(fineneedle aspiration cytology, FNAC)联合BRAFV600E检测可以提高术前甲状腺良恶性结节的诊断率[1-2],并且BRAFV600E突变状态对甲状腺乳头状癌(papillary thyroid carcinoma, PTC)的治疗及预后的评估具有重要的指导意义[3],它的特异性高达95.5%~100.0%[4-5],但是敏感性较低,仅有40%~56%[6-7],且存在一定比例的假阴性率,主要是由于细针穿刺的局限性,用于检测的肿瘤细胞含量不足引起。根据FNA指南,由于不同的检查需要,通常每个结节会穿刺2~3 次,细胞学样本置于细胞保存液中,基因检测样本保存于细胞裂解液中。而实际操作中,每一次穿刺得到的细胞量并不是平均的,分别用于细胞学和基因检测的样本量也会不同,有时会出现液基涂片肿瘤细胞丰富,但用于基因检测的细胞量不足,或者细胞总量虽然够,但肿瘤细胞比例少,含大量的非肿瘤细胞,如正常滤泡上皮细胞和淋巴细胞等,因此出现细胞学诊断明确为PTC,而BRAFV600E结果模棱两可的现象。本文对工作中遇到的这类液基涂片细胞进行回收,再次扩增阻滞突变系统PCR(amplification refractory mutation system PCR, ARMS-PCR),分析BRAFV600E突变情况,并将术后病例的组织学类型归纳总结。
1 材料与方法
1.1 标本来源 收集我科2021年1月—8月的样本库中经两名医生按照甲状腺Bethesda标准诊断为PTC的液基涂片18 例,每张片子上至少有6簇及以上的细胞团,同时18 例标本的BRAFV600E的扩增曲线高于基线,但没有呈完整的S型,按照诊断标准阳性诊断依据不足。
1.2 主要试剂仪器 二甲苯、无水乙醇购于国药集团, DNA提取试剂盒、人类BRAFV600E突变检测试剂盒购于厦门艾德医药科技有限公司,水浴锅购于上海精宏实验设备有限公司,离心机和紫外分光光度计购于赛默飞世尔科技有限公司,PCR仪购自罗氏公司。
1.3 液基涂片细胞再回收 将所选液基片子通过数字扫描技术形成数字切片并储存,把其置于烤片机上5 min,直至树胶变软融化,揭掉盖玻片迅速置于二甲苯中10 min,再将其转移至无水乙醇中10 min后取出,将组织吹干,在1.5 mL离心管中加入180 μL细胞裂解液,用移液器吸取30 μL滴加到涂片的细胞区域,在湿润状态下用一次性手术刀片将组织刮下,并用少量裂解液将剩下的细胞冲洗于离心管中,随后按照核酸提取试剂说明书进行DNA提取。
1.4 检测DNA的浓度与纯度 紫外分光光度计测量260 nm(A260)和280 nm(A280)的吸光度值,得到DNA浓度和纯度,当A260/A280为(1.8±0.1)时,说明提取的总DNA纯度合格,随后对样本进行定量,浓度大于5 ng/μL者,稀释至1 ng/μL,浓度低于5 ng/μL者,原液上机。
1.5 ARMS法检测BRAFV600E的突变情况 按照说明书配制反应混合液,设立阴性对照(negative control,NC)和阳性对照(positive control, PC),使用ARMS法对所提取DNA的BRAFV600E突变状态进行检测,反应结束后将阈值线调节至扩增曲线升起的拐点处,得到突变FAM信号和内控VIC信号的循环阈值(cycle threshold, Ct)。首先分析NC和PC结果是否符合实验要求,再对待测样品内控进行评估,确定实验结果成功可信,最后研究样本的FAM信号,若突变检测管的扩增曲线呈S型且Ct值<30,则为突变阳性,BRAFV600E为突变型。若样品的FAM曲线不呈S型或Ct值≥30,则为阴性,称为BRAFV600E野生型。
1.6 HE染色 对术后标本进行常规HE染色,显微镜下观察组织学类型。
1.7 统计学分析 应用SPSS 22.0统计软件对数据进行处理,数据以均数±标准差(±s)表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 D N A的浓度和纯度 对照组的浓度为(10.737±8.158)ng/μL,实验组的DNA浓度为(7.471±4.058)ng/μL,两者差异没有统计学意义(P>0.05)。此外,两者纯度分别为(1.815±0.076)和(1.848±0.064),均为合格,差异没有统计学意义(P>0.05)。
2.2 BRAFV600E突变状态 图1为对照组,选取了1 例典型样本的扩增曲线图,图2为实验组,包含全部18 例样本的扩增曲线。两组NC均为阴性曲线,说明实验过程没有受到污染,PC的曲线正常升起,表明试剂有效。再对两组的待测样本的内控信号(VIC信号)进行分析,结果见表1,对照组Ct值为(14.267±1.040),实验组Ct值为(13.807±0.819),两者差异没有统计学意义(P>0.05),均在实验要求的13~21之间,说明两组加入的总DNA量符合实验要求,实验成功。最后对两组的突变反应管进行分析,对照组样本扩增曲线高于基线,但升起时间较晚,不呈完整的S型,不符合阳性诊断标准,但也不能轻易判读为阴性。实验组结果显示:18 例样本均有平滑的上升S型曲线,与基线的交叉点在30 个循环以下,Ct值为(18.194±1.980),具体见表1(FAM信号),我们将其判读为阳性,即为BRAFV600E突变型。
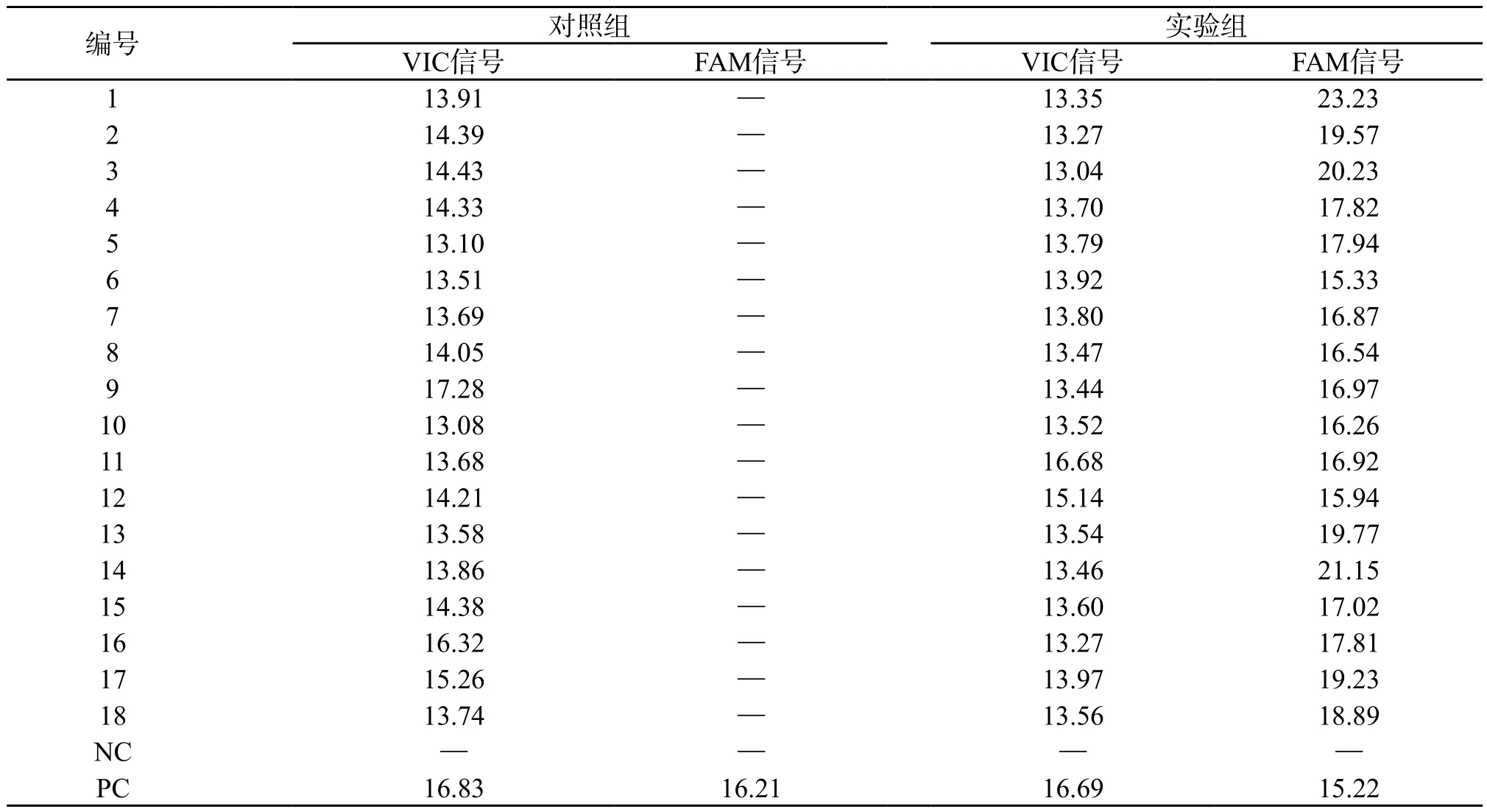
表1 各组反应管在FAM和VIC信号下的Ct值
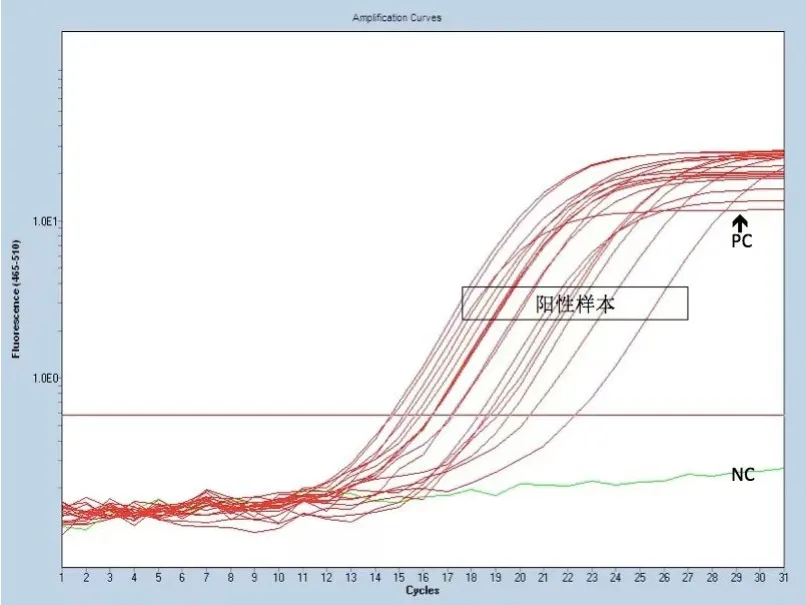
图1 对照组FAM信号下的BRAFV600E扩增曲线
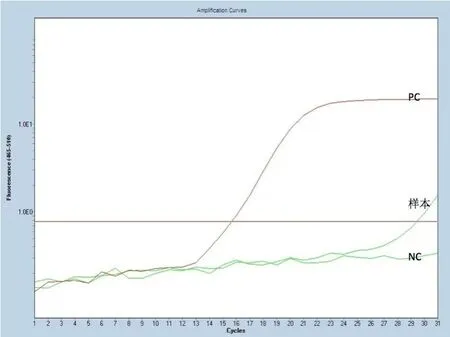
图2 实验组FAM信号下的BRAFV600E扩增曲线
2.3 组织学结果 以术后组织病理诊断结果作为金标准,18 例均确诊为PTC,见图3、图4。

图3 肿瘤呈乳头状结构,可见纤维血管轴心及砂粒体(HE×100)
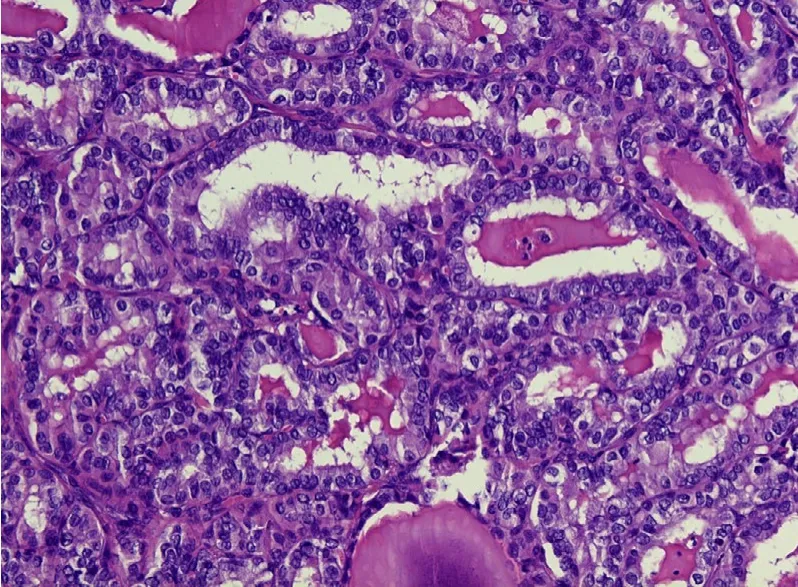
图4 细胞核呈毛玻璃样,部分细胞可见核沟(HE×100)
3 讨论
甲状腺肿瘤近年来的发病率显著提高,其中PTC是甲状腺癌最常见的病理类型,占85%~95%[8],但其预后较好,所以早诊断早治疗也显得尤为重要。FNAC是术前鉴别甲状腺结节良恶性的重要方法,具有创伤小、准确性高等优点,但其中仍有10%~40%的结节无法明确性质[9],2015年美国甲状腺协会(ATA)指南推荐使用分子标志物来进一步诊断[10],其中BRAFV600E是PTC的特异性分子标记物。BRAFV600E突变激活RAS-RAF-MEKERK信号通路引起细胞的恶性增殖,最终导致肿瘤的发生[11]。已有多项研究[12-13]表明BRAFV600E基因突变与肿瘤大小、被膜外侵犯及颈部淋巴结转移密切相关,提示其突变是PTC复发的独立危险因素。本文用ARMS法检测BRAFV600E的突变状态,DNA分别提取自细胞裂解液(对照组)和已经制片的液基涂片(实验组),结果显示实验组浓度低于对照组,可能由于实验组的细胞来自于再提取,从液基细胞制片过程到再提取操作,都会损失部分细胞,而对照组是直接从细胞裂解液中提取,几乎没有损失,但两组差异没有统计学意义(P>0.05),并且两组内控均合格,说明实验组虽然浓度低,但加入PCR反应体系的DNA总量是够的。PCR结果显示实验组中18 例均为BRAFV600E阳性,我们认为与对照组相比,实验组的阳性率显著提高的原因是由于提取的是总DNA,虽然对照组浓度更高,但可能其中正常细胞较多,肿瘤细胞比例少,低于ARMS法能检测出的最低1%突变的标准,造成BRAFV600E结果的不明确,而实验组再提取直观地选取了有丰富肿瘤细胞数量的标本,相当于事先对肿瘤细胞量进行了评估,所以阳性率大大提高,最后组织学结果也证实了我们的术前诊断。
虽然从液基涂片中再提取DNA进行BRAFV600E检测的应用价值得到了证实,但是此项操作还有一些方面需要我们进一步讨论。
液基涂片上的肿瘤细胞数量是决定实验成败的关键,因为操作过程不可避免地会损失部分细胞,所以需要选取有丰富滤泡细胞团的涂片,如果原本涂片上肿瘤细胞也很少,本文所述方法的应用就会受到限制。
涂片回收过程中多次使用到乙醇,乙醇作为固定剂能够快速穿透细胞,凝固核蛋白,并且不改变DNA的一级结构,可用于分子生物学技术[14],为我们回收DNA提供了理论基础。在脱蜡过程中,用乙醇置换二甲苯,这时候乙醇要挥发干净,因为它的残留不仅会影响蛋白酶K的活性,降低DNA提取效率,还会使维持DNA双螺旋稳定性的氢键断裂,破坏碱基间的堆积力,引起DNA变性,产生一定量的单链DNA,使得A260处的吸光度增加,这也许是实验组的A260/A280比对照组稍大的原因。但是乙醇挥发时间长,又容易使得DNA暴露在空气中过久,引起为数不多的DNA降解,所以这个组织吹干时间的长短是我们需要把握好的。
据报道[15],染色剂与DNA结合,会抑制Taq酶的活性,表现为样本内控Ct值升高,也有报道[16]认为DNA提取用的硅胶模吸附柱有滤过纯化作用,可以最大限度地除去染色剂分子,本文结果显示巴氏染色后的实验组内控均在要求的范围内,但我们未与未染色组进行比较,后续会进步一研究证实。
我们一般从浓度、纯度和完整性三个方面对DNA质量进行评估,细胞经过液基制片以及再提取过程,是否会引起DNA的片段化,本文基于研究侧重点,主要关注BRAFV600E突变状态的变化,后续也会对DNA的完整性进一步探讨。
本实验需要先得到细胞学结果,再进行BRAFV600E的检测,延长了发报告的时间,同时这也限制了此方法的常规应用。
从液基涂片中重新提取D N A再次进行BRAFV600E检测在实际应用有一定的局限性,那是否还有其他来源的标本可以替代呢?根据文献报道[17],BRAFV600E检测标本还可以来自于液基保存液中的剩余标本,它有一定的优势,比如细胞学与分子病理报告使用同一份标本,结果更加客观,对病人来说可以少穿刺一针,降低穿刺过程的痛苦和风险。但是在细胞量少时,由于大部分样本已用于液基制片,剩余样本中的组织量会很少,并且当涂片制作不满意,需要再次制片时,会面临无标本可用的情况,因此我们不将其作为常规基因检测标本使用。在遇到本文所述的情况需要重新检测时,仍然不考虑用其作为标本来源,其一是因为相比较于直接从涂片上获取细胞,我们无法对保存液中的肿瘤细胞数量进行直观的评估,其二样本中细胞由于未经过巴氏染色,均为透明状,在进行离心的操作中,肉眼看不到细胞沉淀,会误吸导致损失大量细胞。标本还可以来源于细胞蜡块[18],一般留存液基所需的标本量后,其余收集做成细胞蜡块,这样除了基因检测以外,还可以连续切片进行免疫组化,大大拓展了术前诊断的内容。这项技术在胸腹水、痰等标本中已经广泛应用,但是前提仍然是需要大量的细胞,而目前我们甲状腺的细针穿刺标本经过离心后,几乎得不到细胞沉淀物,还不能满足此项目的常规使用,需要穿刺医生积累经验,精准穿刺。还有报道[19]使用穿刺洗脱液进行基因检测,穿刺洗脱液用于甲状腺球蛋白含量的测定已经得到了广泛应用,但是在基因检测方面,由于其得到的肿瘤细胞量非常少,所以其实际应用价值仍待研究。
综上所述,当我们常规进行BRAFV600E检测时,遇到肿瘤细胞含量特别少,导致检测结果出现模棱两可的情况,而这份病例对应的液基涂片又细胞含量丰富,那么从中再提取DNA重新进行一次基因检测不失为提高术前诊断结果准确率的好方法。由于本文所述的情况较为特殊,我们还没有收集到更多的病例,后续会扩大样本量,优化实验条件,继续探讨。

