吡喃花色苷结构及其性质研究进展
曾颖钰,郭大三,李旭升,蔡冬宝,孙建霞,白卫滨,*
(1.暨南大学理工学院,广东 广州 510632;2.广东工业大学轻工化工学院,广东 广州 510090)
花色苷是广泛分布在多种植物中的一大类天然色素的总称,属于黄酮类物质,具有C-C-C的碳骨架结构。花色苷是植物能呈现红色、紫色、蓝色甚至橙色等鲜艳颜色的重要原因之一。随着人们认识的不断深入,花色苷不仅可以成为合成着色剂的天然替代品,还因拥有丰富的生物活性,在新型功能食品、新型化妆品与制药工业中被广泛应用。然而花色苷本身很不稳定,极易发生降解,其稳定性受到自身结构、pH值、温度、光照、氧气、酶、溶剂、金属离子、蛋白质及类黄酮等诸多因素的影响。因此,为了进一步实现花色苷在复杂条件下的稳定应用,研究者们提出了两种主要的改进策略。一方面,研究者尝试将花色苷包埋在更加稳定的体系内,通过乳化或凝胶化进行封装,如以油包水(W/O)的形式形成微胶囊来实现花色苷在体系内的稳定存在;另一方面,研究者尝试以母体花色苷的结构作为出发点,通过结构修饰、生物工程技术等方法开发稳定性更好、生物活性更优的花色苷衍生物。而相比于结构修饰,包埋技术的实现更加困难,壁材负载能力不足、包装技术复杂和包封步骤繁琐等缺陷都是包埋技术不可避免的局限性。相比之下,花色苷的结构修饰已取得了很多成功的范例,其中吡喃花色苷是花色苷结构修饰研究中最深入的一类物质。
自1997年首次在陈酿红酒中检测出吡喃花色苷后,吡喃花色苷得到了越来越多的关注。吡喃花色苷一般是指在花色苷的结构基础上在C4 位与C5 位间额外形成一个吡喃环的新型花色苷衍生物。与原型花色苷相比,吡喃花色苷不仅具备更稳定的结构,在对体系颜色的组成中也有令人意外的贡献。吡喃花色苷的发现对于克服花色苷稳定性差、生物利用度低等应用中的不足之处有重要意义。本文就目前已报道的吡喃花色苷的结构特征与稳定性进行了综述,旨在为未来吡喃花色苷的综合应用提供参考。
1 花色苷及其衍生物的研究现状
1.1 花色苷
1.1.1 花色苷的主要来源
花色苷作为一种水溶性色素主要存在于维管束植物的花、果实、茎、叶等器官的细胞液中。根据统计,包括27个科、73个属在内的数万种植物都含有花色苷,例如蓝莓、红葡萄、草莓、覆盆子、树莓、血橙、三华李等有色水果以及大部分颜色鲜艳的花卉和有色谷物等。不同植物中的花色苷存在一定的种类和含量差异,从结构上看,花色苷是将花青素母环和糖苷配基以糖苷键交联而形成的化合物,具有典型的C-C-C的碳骨架结构。花色苷之间的差异主要来源于A环和B环上取代基种类、数目及其位置的不同与C环糖苷配基的不同,仅从植物中分离得到的天然花色苷已超过700种,其中主要有6大类最常见的花色苷,基本结构和特征分别如图1和表1所示。人体每日会摄入大量的花色苷,食物中的花色苷主要来源于水果、蔬菜或果酒。西方国家中花色苷的人均日摄入量最高可达到64.9 mg/d;美国人均花色苷日摄入量约12.5 mg;荷兰人均花色苷日摄入量则可达近20 mg;就普遍而言,男性的花色苷平均日摄入量较女性高。
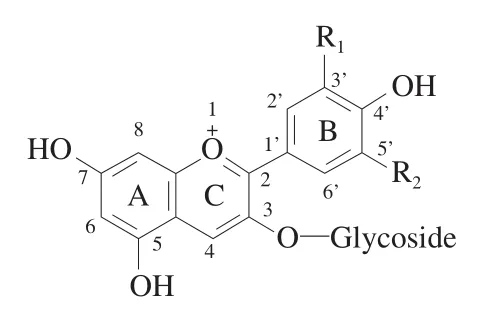
图1 花色苷的基本结构[7-8]Fig. 1 General structure of anthocyanins[7-8]
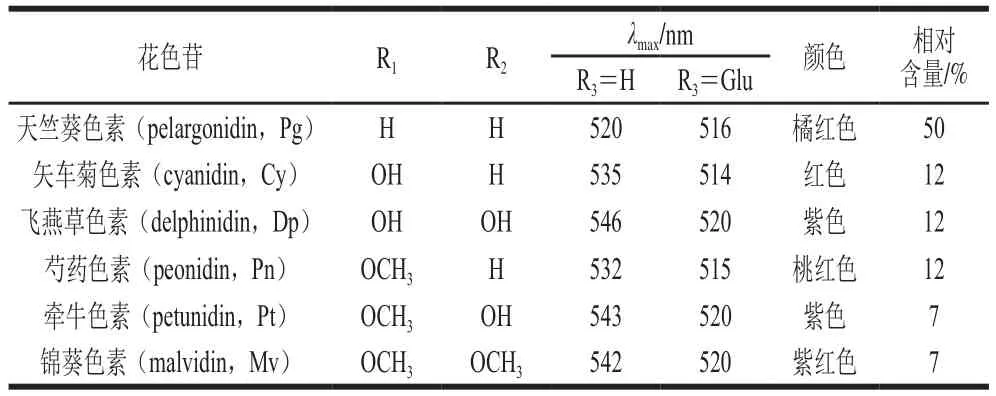
表1 常见花色苷取代基、成色特征与相对含量[9-10]Table 1 Substituents, chromatic characteristics and relative contents of common anthocyanins[9-10]
在上述6种花色苷中,不含甲基的3种花色苷(Pg、Cy和Dp)的糖苷衍生物是自然界中最多被发现的花色苷,其中又以矢车菊色素-3-葡萄糖苷(cyanidin-3-glucoside,Cy-3-glu)最为常见。
1.1.2 花色苷的生物活性与其他应用
花色苷作为黄酮类物质,具备一系列独特的对人体健康有益的生理活性,在功能食品及膳食补充剂等营养保健领域有广泛的前景。根据目前的研究,花色苷对人体的健康功效主要包括抗氧化、抗炎症、预防心血管疾病并减少血栓形成、控制肥胖、预防早期2型糖尿病、修复非酒精性脂肪肝损伤,改善重金属离子带来的生殖损伤以及紫外线造成的皮肤损伤等。此外,制药和化妆品行业也正在将花色苷开发为功能因子或着色剂等。目前消费者对合成色素潜在不良影响的忧虑逐渐增加,花色苷正是一些合成色素的天然替代品,并在多个国家被批准作为食品着色剂来使用。如欧盟法规认可包括葡萄皮、黑加仑、浆果等多种提取来源的花色苷。然而,花色苷在体内的生物利用度却相对不足。这可能是由于花色苷脂溶性不足导致其不易通过细胞的磷脂双分子层,也可能是由于花色苷在抵达靶向位点前在消化道内就已被肠道微生物降解,从而无法达到靶向作用位点被机体充分利用。
1.1.3 花色苷的理化特性
花色苷对pH值极其敏感,在不同的pH值下,花色苷的颜色特征会发生很大差异。如表2所示,当水溶液pH值在2以下时,花色苷主要以烊盐离子的形式存在并表现红色,当pH值在弱酸性范围时,花色苷以无色的甲醇假碱或半缩醛形式存在,水溶液逐渐接近中性时,花色苷去质子化为醌式碱,还可能开环成查耳酮的形式。查耳酮不稳定,会进一步裂解成酚醛或酚酸。pH值继续升高时,花色苷逐渐变为紫色的中性醌式碱及蓝色的离子化醌式碱。Sui Xiaonan等发现随着pH值的增加,花色苷在水溶液中的降解速率也会变得越来越大,此外,当pH值上升至5~6,6种常见花色苷(Pg、Cy、Dp、Pn、Pt与Mv)的稳定性较酸性条件急剧下降,中性条件下展现出最差的稳定性。
除此以外,温度的升高也会加快花色苷的降解,一般来讲热处理下花色苷降解符合一级反应动力学,加热时间的延长与加热温度的提高都会显著影响花色苷的色泽、含量与抗氧化活性。Sui Xiaonan等还发现pH值与温度对花色苷的降解具有协同效应。此外,花色苷的稳定性还会受到氧气、酶、光照等其他环境因素的影响。
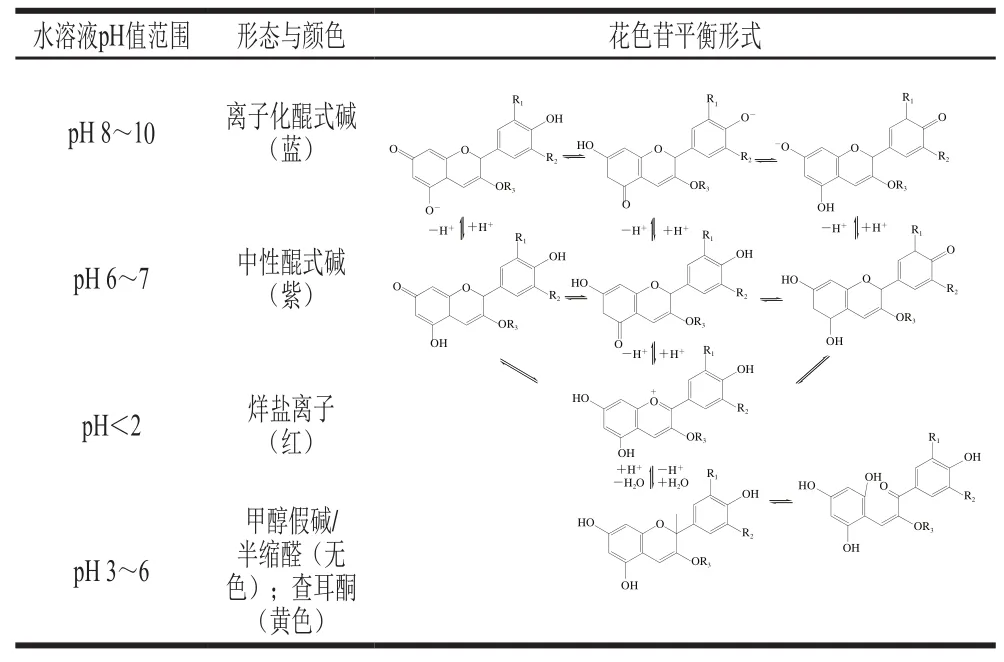
表2 花色苷在不同pH值下水溶液中的存在形式与平衡[20]Table 2 Existing forms and equilibrium of anthocyanins in aqueous solution under varying pH[20]
尽管花色苷有很大的开发潜力,但其结构的不稳定性与很低的脂溶性为其利用带来了诸多挑战。在实际的食品加工与贮存中,花色苷从植物中分离后稳定性差、颜色不稳固、加工分解等问题为其利用带来了很多阻碍。如何提高花色苷在食品加工过程中的稳定性是学界的一大难题。而对花色苷进行结构修饰或形成吡喃花色苷可以在一定程度对其稳定性进行改善。
1.2 花色苷结构修饰
1.2.1 花色苷酰基化
花色苷易于修饰,环取代基的种类(如糖苷、酰化基团等)和数目差异是影响其结构特征的主要因素。大量研究指出花色苷C3位点的糖苷具有较强的反应活性,小分子有机酸在此处可与花色苷的糖苷分子进一步形成酰化结构,如羟基肉桂酸类化合物、乙酸、草酸、丙二酸和琥珀酸等都能参与花色苷的酰化。在红酒的发酵或陈酿过程中,花色苷还会进一步演变,通过环化反应、加成反应或聚合反应等步骤形成更加复杂、颜色不同的其他花色苷。
理论上花色苷糖苷键所连接的糖基在特定条件下都能发生酰化反应。一般来说,花色苷酰化是指花色苷糖基上的羟基被各类有机酸部分或全部酰基化的现象。花色苷酰化后分子质量增大,同时羟基连接了极性更低的有机酸使总体结构碳链长度增加,导致整体的极性和水溶性随之下降,脂溶性得到提升。酰基本身的性质也会对花色苷产生额外影响,例如芳香族酰基基团会对花色苷产生额外空间位阻和π-π共轭带来的分子内辅色效应,从而降低溶液中可能对花色苷造成损失的离子的空间位阻,使花色苷的稳定性得到提升。
与未酰化的花色苷相比,大部分酰化花色苷不仅稳定性更高,生物活性也会更强。Luo Chunli等从紫甘薯中筛选出的4种单体酰化花色苷可有效保护HepG2和DU145细胞免受HO诱导的氧化应激,且分离出的酰化花色苷比紫甘薯中其他花色苷化合物能更有效地保护细胞。同时,酰化花色苷可能有更高的生物利用度,Oliveria等利用了MKN-28胃细胞和Caco-2肠细胞模拟了紫薯中的酰化花色苷在胃肠道内的消化过程,发现酰化花色苷在胃肠消化中的降解水平更低,且酰化花色苷在体内的吸收特性与普通花色苷类似。
1.2.2 花色苷酯基化
花色苷酯基化与酰基化有类似的机理,但反应底物主要为丁二酸酐或脂肪酸等疏水性化合物。酯基化与酰基化相比,在加强其脂溶性的同时还提升花色苷的pH值稳定性。Guimaraes等采取酶促合成法分别将Cy-3-glu与C、C、C、C、C这5种碳链长度的脂肪酸在南极假丝酵母脂肪酶B(lipase B,CalB)催化下进行了合成,酯化产物的pH值稳定性与脂溶性都得到较大提升。但由于疏水基团数量的增加,花色苷的酯化产物的羟基往往不能有效地发挥出原有的自由基清除效果;Cruz等用锦葵色素-3-葡萄糖苷(malvidin-3-glucoside,Mv-3-glu)与硬脂酰氯在无水乙腈中进行反应,成功合成了Mv-3-glu的硬脂酸衍生物,经性质研究发现新合成的化合物尽管脂溶性增加,但对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力和总还原力均不如前体花色苷。
尽管花色苷形成酰基化或酯化化合物能增强其稳定性、脂溶性,但此类方法依然存在较多的局限性。花色苷酰化的转化率较低,而且除酶法合成外的人工合成方法普遍选择性差,难以得到预期的理想产物。因此花色苷酰化目前还不是花色苷改性的最佳策略。
1.2.3 花色苷形成吡喃花色苷衍生物
吡喃类物质是指含有一个氧杂原子的六元杂环化合物,而吡喃花色苷,即在花色苷母环的基础上,在花色苷C4和C5位上的羟基之间额外形成一吡喃D环化合物,其基本结构如图2所示。
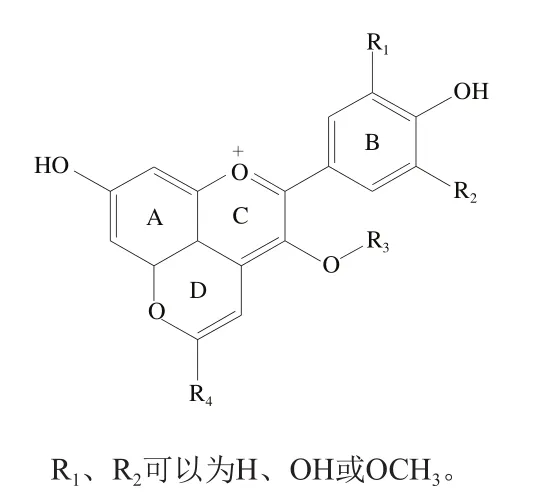
图2 吡喃花色苷基本结构Fig. 2 General structure of pyranoanthocyanins
吡喃花色苷最先发现于对红葡萄酒的研究中。虽然人们很早就发现了红酒中的花色苷,但对红酒陈化过程中颜色变化的原因却鲜有研究。直到1996年,研究人员首次提出红酒在从新制到陈酿过程中的色泽变化可能是陈酿过程中合成了新的色素造成的,并成功将红酒微滤后的膜上物质通过高效液相色谱(high performance liquid chromatography,HPLC)分离得到了两种全新的橙黄色花色苷衍生物。后续经进一步的探索,得出此类物质是由Mv-3-glu与乙烯基苯酚化合而成的。除了葡萄酒外,在血橙、黑加仑、洋葱与黑胡萝卜汁中也检测到了吡喃花色苷的存在。吡喃花色苷家族的发现大大拓展了花色苷的应用潜能,下面将具体叙述吡喃花色苷的基本性质。
2 吡喃花色苷的结构、色泽特征与活性
吡喃花色苷在新制红酒中含量很少,但在陈酿红酒中却能大量检出。事实上,吡喃花色苷是红酒中游离态的前体花色苷与红酒中其他小分子缓慢化合而成的。在红酒的发酵过程中,酵母的次级代谢产物如丙酮酸、乙酰乙酸、乙醛等物质都能与花色苷环化生成新环。除此以外,花色苷也能通过与咖啡酸、芥子酸、阿魏酸等酚酸反应形成对应的吡喃花色苷。同时,随着陈酿时间的延长,已经生成新环的吡喃花色苷还能继续结合有机小分子生成更复杂的吡喃花色苷(如吡喃花色苷二聚体及乙烯基黄烷醇吡喃花色苷)。根据花色苷结合时期的不同,又可以将吡喃花色苷分为第一代吡喃花色苷(发酵前期以花色苷为前体物质生成)与第二代吡喃花色苷(发酵后期以Vitisin A型吡喃花色苷为前体物质生成)。几种常见的吡喃花色苷名称、反应底物与颜色如表3所示。
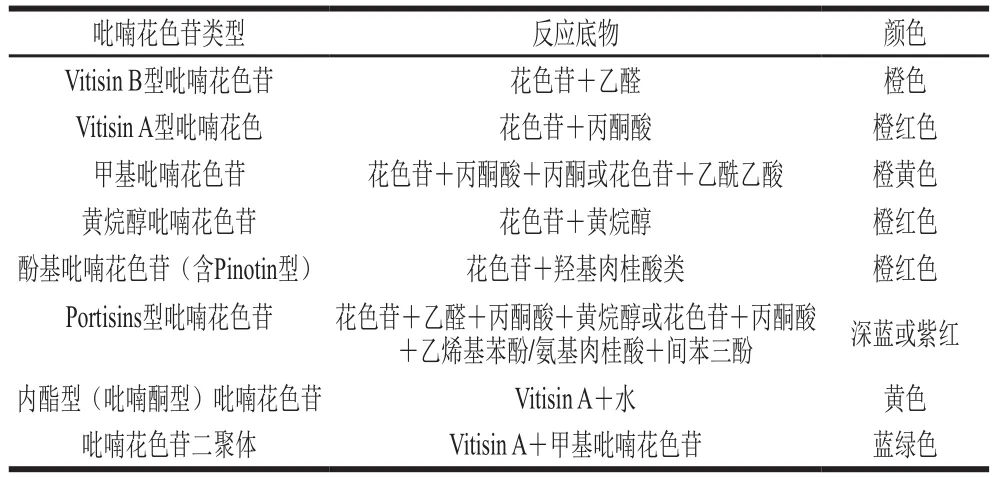
表3 常见吡喃花色苷类型、反应底物与颜色[33]Table 3 Classification, reaction substrates and chromatic properties of common pyranoanthocyanins[33]
在感官特征方面,吡喃花色苷与花色苷有着较大差异。在色泽方面,吡喃花色苷的成色性质对陈化葡萄酒的颜色有重要影响,在弱酸性的pH值范围内,由于新生成了吡喃D环,吡喃花色苷能免受亲核攻击,从而表现出更稳定的色泽,也有学者认为吡喃花色苷这种优秀的颜色稳定性是因为分子内辅色效应。除此之外,就口感方面而言,吡喃花色苷的形成也会影响红酒的口感,这缘于吡喃花色苷在合成过程中会逐渐消耗红酒中的单宁从而软化红酒并减少红酒的苦味和涩味。
2.1 第一代吡喃花色苷
2.1.1 Vitisin型与甲基型吡喃花色苷
Vitisin型吡喃花色苷是人们最早发现、研究最为广泛的一类吡喃花色苷。Bakker等最先发现Vitisin A在陈酿红酒与长期贮藏的葡萄皮中均有存在,并验证了Vitisin A的结构以Mv-3-glu为核心,并附有一个带酮基和羟基乙烯基的吡喃环。后续研究人员也通过模拟葡萄酒陈酿鉴定出其他几种Vitisin型吡喃花色苷并得到结论,Vitisin型吡喃花色苷以花色苷作为反应原型,再通过以乙醛为基本单元的醛类化合物发生环加成反应后形成。其中Vitisin B结构最为简单,是花色苷与乙醛的反应产物,结构上相比原型仅多了一个吡喃D环。Vitisin A花色苷与丙酮酸的反应产物在Vitisin B的基础上在C10位增加了一个羧基。甲基吡喃花色苷则是花色苷原型与乙酰乙酸的反应产物。以Vitisin A的形成为例,在一定的酸性条件下,酮基发生烯醇化,随后具有电负性的甲基与花色苷的C4位(具正电性)加成缩合,再经脱水和氧化形成另外的一个吡喃环。三者的反应机理如图3所示。
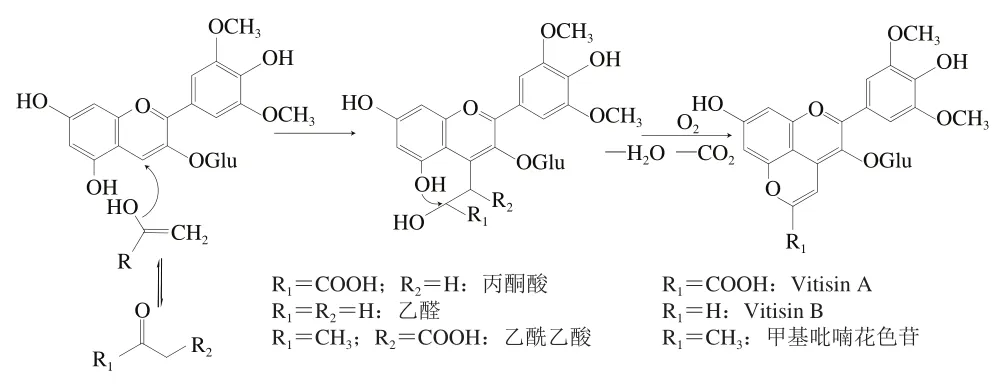
图3 Vitisin型吡喃花色苷与甲基吡喃花色苷的形成过程[36]Fig. 3 Formation process of vitisin-type pyranoanthocyanins and methyl-pyranoanthocyanin[36]
值得注意的是,两种Vitisin型花色苷在与水的反应上存在性质差异,Vitisin B不会发生水和反应,而Vitisin A则会与水分子结合转为其他形态。另外,经质谱分析发现极酸条件下无法检测到Vitisin B的典型离子峰(/517),除了糖苷配基的信号(/355)外还在/259处观察到一种双电荷离子,证实了Vitisin B是双电荷化合物,因此可以发生3级解离。Oliveria等通过紫外-可见光光谱与核磁共振光谱测定了Vitisin B的离子平衡常数,得到p<0.68、p=4.40、p=7.45。而Vitisin A在水溶液中的结构与水合反应有关。Asenstorfer等通过测定Vitisin A的p与p发现,其在葡萄酒中存在形态多样,以水合、非水合以及部分电离等形态混合共存,最主要的形态为醌式碱,并且在不同的pH值下C2与C5位存在水合竞争。
根据质谱信息,由Mv-3-glu合成的甲基吡喃花色苷的离子峰为/531,碎片离子峰为/369。虽然在结构上甲基吡喃花色苷与Vitisin型吡喃花色苷相比只是在C10位多一个甲基,但在颜色表现上更加不同。甲基吡喃花色苷和Vitisin型吡喃花色苷一样,最大吸收波长相比原型花色苷均发生了蓝移,Vitisin A和Vitisin B在葡萄酒pH值下最大吸收波长分别为498 nm和490 nm,甲基吡喃花色苷的蓝移较之而言更加明显,最大吸收波长降低至478 nm,并展现出更强的黄色。此外,Oliveria等在研究甲基吡喃花色苷在水溶液中的存在形式时发现了4种可能形态,其中完全未质子化的甲基吡喃花色苷在碱性条件下会逐渐转变为新结构(图4)。该新化合物形成后不可恢复为原结构,最大吸收波长在355 nm,于碱性环境中呈现黄色。
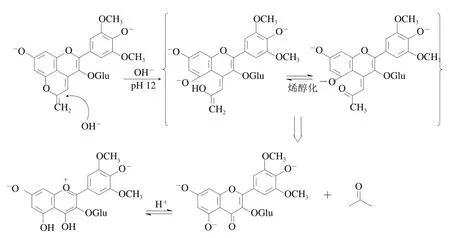
图4 甲基吡喃花色苷在碱性条件下结构变化假设[40]Fig. 4 Hypothetic formation mechanism of syringetin-3-glucoside from methylpyranomalvidin-3-O-glucoside in alkaline conditions[40]
2.1.2 乙烯基黄烷醇型吡喃花色苷
黄烷醇类物质同样是葡萄酒中常见的酚类化合物,在葡萄酒陈化的过程中花色苷也会与某些黄烷醇类物质反应生成吡喃花色苷。最早在1997年,Francia-Aricha等通过模型实验发现在乙醛介导下Mv-3-glu会与黄烷-3-醇((+)-儿茶素、(-)-表儿茶素、原花青素B)发生反应生成新的色素,后来研究人员统一将花色苷在乙烯桥联下与黄烷醇类物质的反应产物定义为乙烯基黄烷醇吡喃花色苷。乙烯基黄烷醇吡喃花色苷的形成过程与葡萄酒中的乙醛密切相关,现有的研究指出可能的合成机制为在花色苷C4位与C5位羟基和8-乙烯基黄烷醇的乙烯基之间发生了环化加成反应。但8-乙烯基黄烷醇并不直接存在于葡萄酒内,这可能是由葡萄酒内游离黄烷醇与乙醛反应生成的加合物经脱水反应或葡萄酒内乙基黄烷醇经裂解反应生成的。乙烯基黄烷醇型吡喃花色苷形成过程如图5所示。
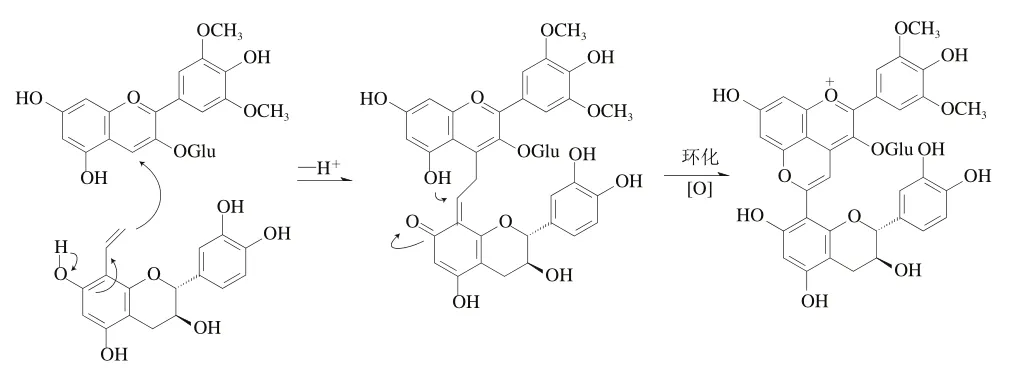
图5 乙烯基黄烷醇吡喃花色苷形成过程(以8-乙烯基儿茶素为例)[42]Fig. 5 Formation process of vinylflavanol-pyranoanthocyanins(exemplified by 8-vinylcatechim)[42]
与Vitisin型吡喃花色苷类似,乙烯基黄烷醇吡喃花色苷在光谱性质上与原型花色苷相比最大吸收波长也发生了蓝移,会呈现出偏橙红色的状态。同样,黄烷醇吡喃花色苷较花色苷具有更强的颜色稳定性。He Jingren等以儿茶素吡喃花色苷、表儿茶素吡喃花色苷及儿茶素二聚体吡喃花色苷为例探索了黄烷醇吡喃花色苷的结构性质,不同于花色苷在中低pH值条件下的颜色表现规律,黄烷醇吡喃花色苷在中等酸性至强酸性的条件下都具有很高的颜色强度,并在pH 3.6条件下达到最大值。此外,有学者通过计算机模型和分子力学确定对于黄烷醇吡喃花色苷而言能量最低的构象,结果表明这时结构呈现出封闭的“笼型”,这有利于吡喃花色苷中的吡喃鎓生色团与儿茶素的吡喃环之间重叠并发生相互作用。上述研究说明黄烷醇吡喃花色苷良好的颜色稳定性基于其结构中具有不同的共面部分,其能产生较强的分子内辅色效应,从而具备抑制水合物生成的能力。
2.1.3 酚基吡喃花色苷
在吡喃花色苷的研究中,Cameira-Dos-Santos等在对葡萄酒进行交叉微滤实验时检测到一种新型的橙黄色色素,且可见吸收光谱也发生了蓝移。经初步推测该橙黄色色素是Mv-3-glu和3-对香豆酰葡萄糖苷分别与葡萄酒中的非黄烷醇成分缩合而产生的,也是最早发现的花色苷衍生物质之一。后续的研究陆续发现了4-乙烯基邻苯二酚、4-乙烯基愈创木酚和4-乙烯基丁香酚与Mv-3-glu的结合产物。同样的,红酒中的羟基肉桂酸类物质也能与Mv-3-glu反应生成对应的酚基吡喃花色苷。Schwarz等推测了酚酸与花色苷可能的反应机制,在以咖啡酸为底物的模型实验中发现,Mv-3-glu可以直接与咖啡酸反应生成新的色素,并将咖啡酸与Mv-3-glu反应生成的吡喃花色苷命名为Pinotin A。经验证,其他羟基肉桂酸类物质可以直接与花色苷原料反应生成酚基吡喃花色苷。酚基吡喃花色苷反应机理见图6。
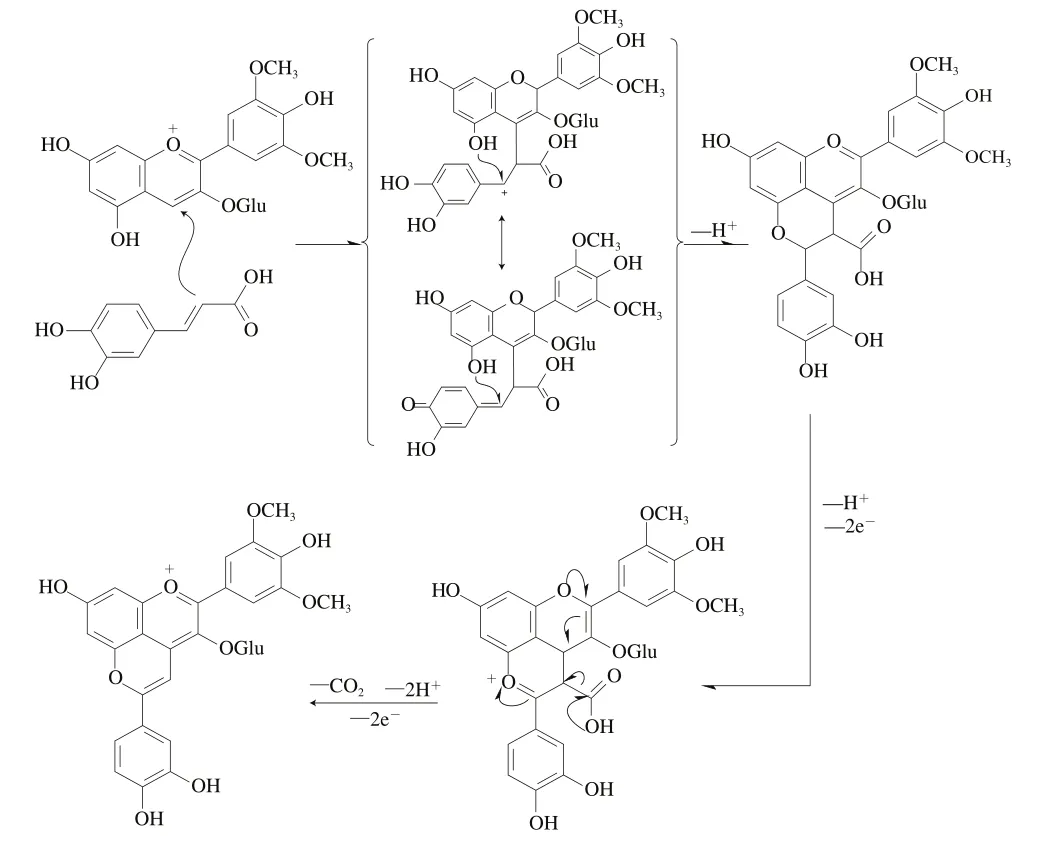
图6 酚基吡喃花色苷形成过程(以咖啡酸与Mv-3-glu合成Piontin A为例)[45]Fig. 6 Formation process of hydroxyphenol-pyranoanthocyanins(exemplified by synthesis of piontin A with caffeic acid and Mv-3-glu)[45]
花色苷结构中的C4位与咖啡酸C2位初始化学键的形成与苯并吡喃单元的强亲电性和咖啡酸-C的亲核性密切相关。考虑到中间体电子不足,由于中间体碳正离子的稳定性,可以认为肉桂酸部分芳香环上的供电基团加速了反应。接着中间体的碳鎓离子可以与羟基结合而形成新的吡喃环。最后经过氧化脱羧可以形成最终产物Pinotin A。根据这种形成假设可以推测,只有苯环上带有供电基的羟基肉桂酸(如香豆酸、阿魏酸、咖啡酸及芥子酸等)才能与花色苷形成酚基吡喃花色苷。值得注意的是,Pinotin A在葡萄酒内的含量变化与其他成分不同,在贮存最开始的1~2 年内Pinotin A的含量很少,之后随着存放时间的延长,大部分第一代吡喃花色苷的含量会逐渐降低,但Pinotin A却表现出相反的趋势,存放4~6 年以上后其含量会大幅增加,这在目前还尚无较合理的解释。
2.2 第二代吡喃花色苷
2.2.1 Portisin型吡喃花色苷
第一代吡喃花色苷是红酒内花色苷母体与红酒陈化时生成的酵母代谢产物、乙烯基黄烷醇或葡萄皮中本身存在的小分子酚酸化合物等物质反应而成的。随着红酒内吡喃花色苷转化的进行,一些结构简单的吡喃花色苷会成为具有更加复杂结构的吡喃花色苷的前体物质。人们将这类由小分子化合物和第一代吡喃花色苷进一步反应所得的衍生物定义为第二代吡喃花色苷。继Vitisin A型吡喃花色苷被世人发现后,Mateus等首次在红酒中检测出了两种蓝色色素,其最大吸收波长相比Mv-3-glu发生了红移,达到575 nm,同时质谱数据显示两种色素分别在/1 119处和/1 265处产生[M]离子,与此同时,前者产生的3个碎片离子峰分别对应儿茶素单元、糖苷残基和两者的结合物;后者产生的一个碎片离子峰对应香豆酰葡萄糖苷残基。以上结果都说明这类新型色素是Vitisin A与乙烯基黄烷醇的合成产物。这种合成的过程可由以下假设推断:一方面反应物Vitisin A先在红酒中较多生成,另一方面乙烯基黄烷醇可能源于乙醛诱导下低聚乙基黄烷醇的聚合,或黄烷醇乙醇化合物的脱水,也可能源于乙基黄烷醇花色苷的裂解。新生成的乙烯基会与Vitisin A的C10位发生反应,最后经过氧化去除甲酸可以得到Vitisin A-乙烯-黄烷醇化合物(Portisin A)(图7)。从Portisin A的结构可以发现,π电子的拓展共轭会赋予Portisin A更高的稳定性,这也能在一定程度上解释其呈现出蓝色的原因。
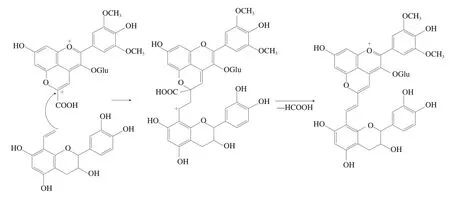
图7 Portisin A型吡喃花色苷形成过程[47]Fig. 7 Formation process of vinylflavanol-pyranoanthocyanins (portisin A)[47]
除了Portisin A外,研究人员在陈酿的Port酒中还发现了另一类以Vitisin A为基础的第二代吡喃花色苷——吡喃花色苷-乙烯基-羟基肉桂酸类物质(Portisin B)。Oliveria等在分馏后的Port酒内通过HPLC检测到了几种以羟基肉桂酸为基础的与Vitisin A结合而成的化合物。相比于Vitisin A,其最大吸收波长发生了红移,达到了约540 nm。可能的形成机制如图8所示,即羟基肉桂酸的碳碳双键可以对Vitisin A具有亲电性质的C10部位发生亲核攻击,再脱去甲酸,氧化后便得到Portisin B。
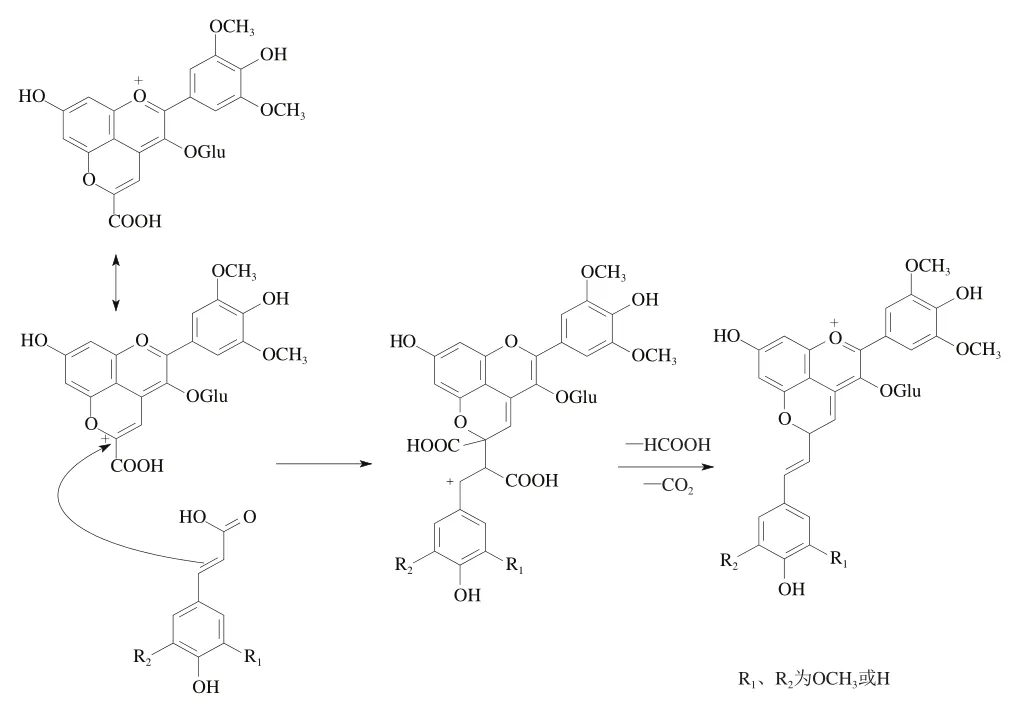
图8 Portisin B型吡喃花色苷形成过程[51]Fig. 8 Formation process of vinylpyranoanthocyanins (portisin B)[51]
虽然两种Portisin型吡喃花色苷相较于原型花色苷均发生了红移,但研究表明Portisin B具有独特的颜色性质,在-10 ℃至室温的变化下其颜色会发生蓝色至红色的转变。这可能是电子振动所引发可逆的物理化学效应造成的。假定正常状态下振动频率不变,虽然随着温度的降低,振动能量的平均值也会下降,但相变会产生更复杂的状态。低温下更有序的结晶排列可能会加强水与可溶性羟基的相互作用,从而导致与Θ和Γ扭转状态相关的振动频率增加。因此温度下降带来的振动能量下降可以由振动频率的增加来克服,从而在基态能量上表现出增加的趋势。这种能量变化趋势是与颜色变化趋势相符合的。而目前尚无研究证实Portisin A是否具有类似的性质。
近年来最新的研究表明,Vitisin A与羟基肉桂酸的氨基衍生物(二甲基-氨基肉桂酸)也能合成结构类似于Portisin B的吡喃花色苷。其最大吸收波长约在638 nm,这种结构因为具有更广泛的π电子离域所以表现出强烈的蓝色。另外,据Oliveria等报道,羟基肉桂酸与甲基吡喃花色苷也能合成类似Portisin B型的吡喃花色苷,但酚基基团与甲基吡喃花色苷并不通过乙烯基连接,而是通过丁二烯基结合在一起。因此此类合成物又被称为丁二烯基桥联的吡喃花色苷。其合成机制可能涉及电荷转移复合物的形成,但具体机理尚不明确。
2.2.2 Oxovitisin型吡喃花色苷
Vitisin A型吡喃花色苷除了能与乙烯基黄烷醇及乙烯基羟基肉桂酸反应外,其自身也能发生氧化反应生成新的酮型吡喃花色苷(Oxovitisin)。He Jingren等在陈酿的Port酒中分离得到一种橙黄色的色素,其最大吸收波长仅为373 nm,另外其质谱数据表明该色素的糖苷配基质量比Vitisin B型吡喃花色苷大15 amu。表明新型色素在结构上与Vitisin B类似,但在原吡喃环上由一个氧原子取代了原先的氢原子。后续经过模型实验得到验证,此类色素是Vitisin A的环氧化产物,其反应机理如图9所示。
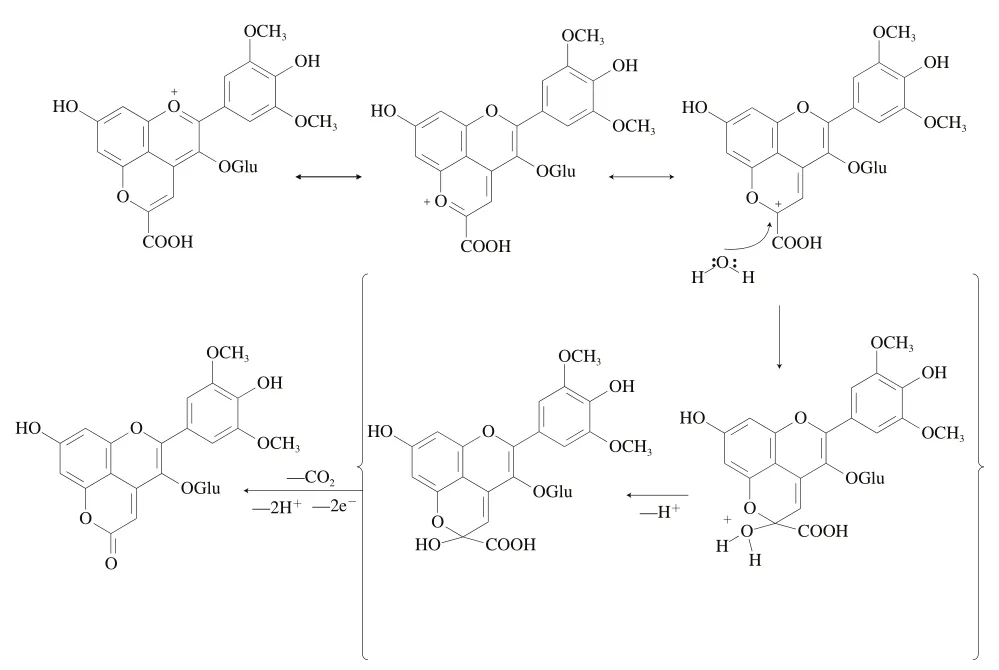
图9 酮型吡喃花色苷形成过程[52]Fig. 9 Formation process of pyranone-anthocyanins (oxovitisins)[52]
考虑到Vitisin A的亲电特性,溶液中的水分子会对Vitisin A具备亲电性质的C10位点产生亲核进攻,从而使得半缩醛生成。该中间体在温和条件下脱羧,并将半缩醛的羟基进一步氧化成吡喃-2-酮,最后形成终产物Oxovitisins。另外,位置带有羟基阴离子取代基的吡喃阳离子不是两性离子芳族化合物,而是中性不饱和内酯或-吡喃酮,这与C10位羰基氧化的机制是一致的。
2.2.3 吡喃花色苷二聚体
近年来,研究人员还在陈酿的Port酒酒渣中检测到了一种新型的蓝绿色花色苷衍生物。根据取代糖基的不同,该色素的最大吸收波长约在730~680 nm之间。研究人员通过模型实验证明新型花色苷衍生物是甲基吡喃花色苷与Vitisin A化合而成的,可能的反应机理如图10所示。
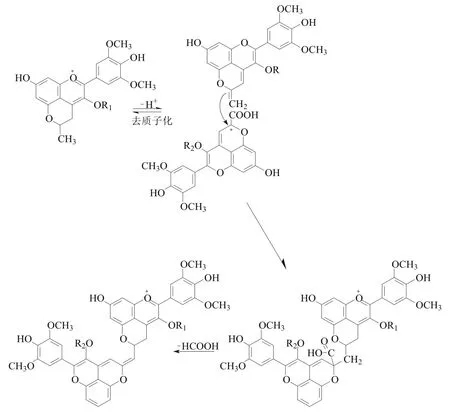
图10 吡喃花色苷二聚体形成过程[53]Fig. 10 Formation process of pyranoanthocyanin dimers[53]
在葡萄酒的自然pH值下,甲基吡喃花色苷的甲基可能会发生去质子化从而在C10位形成亚甲基,接着亚甲基的双键结构可能会对Vitisin A亲电的C10位点发生亲核进攻,从而生成由亚甲基连接的双吡喃花色苷中间体。经过后续的氧化脱去一分子甲酸就得到了呈现蓝绿色的吡喃花色苷二聚体。也有学者认为吡喃花色苷二聚体的合成途径是两种前体物质通过芳香环的π电子云相互作用形成了电荷转移复合物,之后再经过自由基反应或离子反应进一步缩合,脱去甲酸后形成终产物。由于吡喃花色苷二聚体主要在酒渣中发现,可知其在葡萄酒中溶解度低于其他类别的花色苷及其衍生物,这可能是分子质量的增加引起原分子的极性下降所致。
2.3 吡喃花色苷的生物活性
相比普通花色苷,吡喃花色苷在生物活性上也更具优势。Oliveria等比较了Mv-3-glu与几种吡喃花色苷衍生物的生物活性,结果发现Oxovitisin相较与原型花色苷具有更好的抑制乳腺癌细胞MCF-7的能力和细胞内转运效率。但Vitisin A型吡喃花色苷的抗癌活性与细胞内转运效率实际表现却不如Mv-3-glu。因此,不同类型的吡喃花色苷在生物活性方面也存在差异。Zhu Zhenzhou等发现甲基吡喃花色苷不仅在毒理学评价上与花色苷类似,能安全使用,同时还具有卓越的应对HO诱导的MRC-5细胞损伤的保护作用,可将HO诱导细胞损伤后的细胞活力由56%增加至75%。罗海霞通过对合成的甲基吡喃花色苷、Vitisin A、Pinotin A、Mv-3-glu-4-乙烯基苯酚、Mv-3-glu-4-乙烯基愈创木酚和Mv-3-glu-4-乙烯基丁香醇共6种吡喃花色苷的抗氧化能力实验,证实吡喃花色苷相较于Mv-3-glu,具备更为突出的2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸阳离子自由基清除能力。就DPPH自由基清除能力而言,除甲基吡喃花色苷与Mv-3-glu并未具有显著性差异外,其他5种吡喃花色苷的清除能力都显著优胜于Mv-3-glu。Peng You等对鹿角漆树的粗提物进行了抗炎活性的研究,结果表明粗提物中的多酚类物质,尤其是吡喃花色苷,可以通过抑制Caco-2细胞中由肿瘤坏死因子(tumor necrosis factor,TNF)-α诱导产生的白细胞介素-8从而降低炎症活性。此外,本课题组最近研究发现,Vitisin A对细胞胆固醇具有代谢调控的作用,能够显著抑制胆固醇的合成,清除血液中的低密度脂蛋白胆固醇,从而对维持体内胆固醇稳态具有生物学意义。虽然吡喃花色苷的研究还处在起步阶段,且在吸收代谢方面还尚处空白,但已有的研究成果表明吡喃花色苷在花色苷改性上有较大潜力,在食品添加剂乃至医药方面都有潜在的应用前景。
3 展 望
尽管较之于原型花色苷,吡喃花色苷在稳定性、生物活性和对酿酒风味的影响等方面都具有一定的优势,但到目前为止,对吡喃花色苷的认识仍旧有待深入。
3.1 吡喃花色苷的制备
吡喃花色苷形成周期比较长,这无论对于开展任何相关方面的研究来说,都是亟需解决的一个难题。以葡萄酒为例,若希望葡萄酒中的吡喃花色苷能形成较为理想又稳定的颜色,少则几个月,多则可达几年。陈欣然通过对不同年份产的美乐葡萄酒进行花色苷类含量测定,发现2014年与2017年的酒中总吡喃型花色苷质量浓度分别为13.71 mg/L与21.69 mg/L,总花色苷质量浓度分别为196.06 mg/L和389.22 mg/L。根据数据对比可直观反映出吡喃花色苷生成速率很慢,并远远低于花色苷原料的衰减速度,生产效率低、周期过长、耗费的时间成本大,这对于生产和研究而言难以被接受。
研究人员也尝试了不同手段,希望加速吡喃花色苷的生成。Straathof等利用咖啡酸参与酚基吡喃花色苷的合成,同时辅以高温处理,结果证实热处理对于加速吡喃花色苷生成的确有效。其中,经75 ℃处理24 h后,吡喃花色苷的转化率可达90%,但与此同时花色苷也在迅速降解。Bozic等发现葡萄酒发酵所使用的的酵母菌因带有羟基肉桂酸脱羧酶,有利于形成高浓度的乙烯酚基吡喃花色苷。本课题组近期也尝试采用超声波进行加速研究,并经初步实验验证超声波的确有促进吡喃花色苷生成的效果,其处理过程中所产生的空化效应能起到关键的促进作用:超声波作用后,液体介质被激活或形成空化泡,瞬间形成高温高压环境,并且伴随着能量强大的冲击波产生,水分子由此裂解为自由基,促使溶液体系中分子键的裂解和生成,最终加快吡喃花色苷的生成速度。尽管部分辅助手段已经初步被证明有利于吡喃花色苷的制备,但均伴随有原型花色苷降解的问题。因此,如何协调吡喃花色苷生成带来的稳定性优势与原型花色苷快速降解带来的负面影响,或得到一个在促进吡喃花色苷形成同时,能最大程度地维持其他花色苷物质含量的方法,仍需研究者做出更多的探索。
3.2 吡喃花色苷的生物活性和吸收代谢
目前研究以吡喃花色苷为代表的相关花色苷衍生物的具体生物活性及其代谢机理的相关文献还较为匮乏。已有研究证明Oxovitisin A具有抗乳腺癌的能力,其吡喃环和环上取代基都有利于其转运吸收,使其在胃壁细胞模型中的吸收效率高于原型花色苷Mv-3-glu和Vitisin A。虽然如此,由于结构上多出吡喃环的特殊性,吡喃花色苷难免与原型花色苷的生物活性产生一定差异,在机体内的吸收难易程度、转运的机制以及和其他活性成分之间的相互作用可能也会不同,所以其他多种吡喃花色苷未知的生物活性功能及其发挥作用所基于的体内转运吸收能力仍有待探索。
3.3 吡喃花色苷的新型应用开发
吡喃花色苷作为一类天然的植物色素,具有其他人工合成色素所无法比拟的环保、安全和益于健康的优势,更适合应用于食品、化妆品和保健品等相关领域,但其潜在开发价值不仅限于此。Oliveira等利用Vitisin A和4-(二甲氨基)肉桂酸人工合成了一种半天然的蓝色色素,它属于Portisin型吡喃花色苷的衍生物,具有良好的开发前景。市面上的染料敏化太阳能电池多数通过昂贵且有毒的钌复合物实现能量的高转化效率,Pinto等将仿生合成的吡喃花色苷作为高效替代光敏剂。吡喃花色苷上的吡喃环C和D之间的共轭键强化了电子离域效应,降低了C2位受亲核攻击的几率,所以任何pH值范围下,都在可见光区域有相应吸收,是一种具有广阔前景的染料敏化剂。
4 结 语
本文总结了花色苷的研究现状以及包括酰基改性花色苷、酯基改性花色苷以及吡喃花色苷在内的3种主要花色苷衍生物的基本特性。3种衍生物在稳定性方面均优于原型花色苷,总体来看吡喃花色苷更具开发潜力。酰基改性与酯基改性更侧重于花色苷脂溶性的提升,但合成效率低;吡喃花色苷在生物利用度与生物活性方面更有优势,同时还保持了花色苷原本的水溶性。
根据形成时期与反应底物的不同,吡喃花色苷被分为以原型花色苷为反应基础的第一代吡喃花色苷(图11中红色物质)以及以第一代吡喃花色苷为反应基础的第二代吡喃花色苷(图11中绿色物质)。第一代吡喃花色苷主要包括Vitisin型、黄烷醇型和酚基型,第二代吡喃花色苷主要包括Portisin型、Oxovitisin型和吡喃花色苷二聚体型。亲核加成后氧化脱羧及环加成反应是形成各类吡喃花色苷的主要方式,这可能与C10位的亲电特性有关。另外,与原型花色苷相比,吡喃花色苷的最大吸收波长将发生不同程度的蓝移或红移,在颜色表现上也存在很大差异。这些丰富的结构组成为吡喃花色苷的开发应用带来了多种可能。
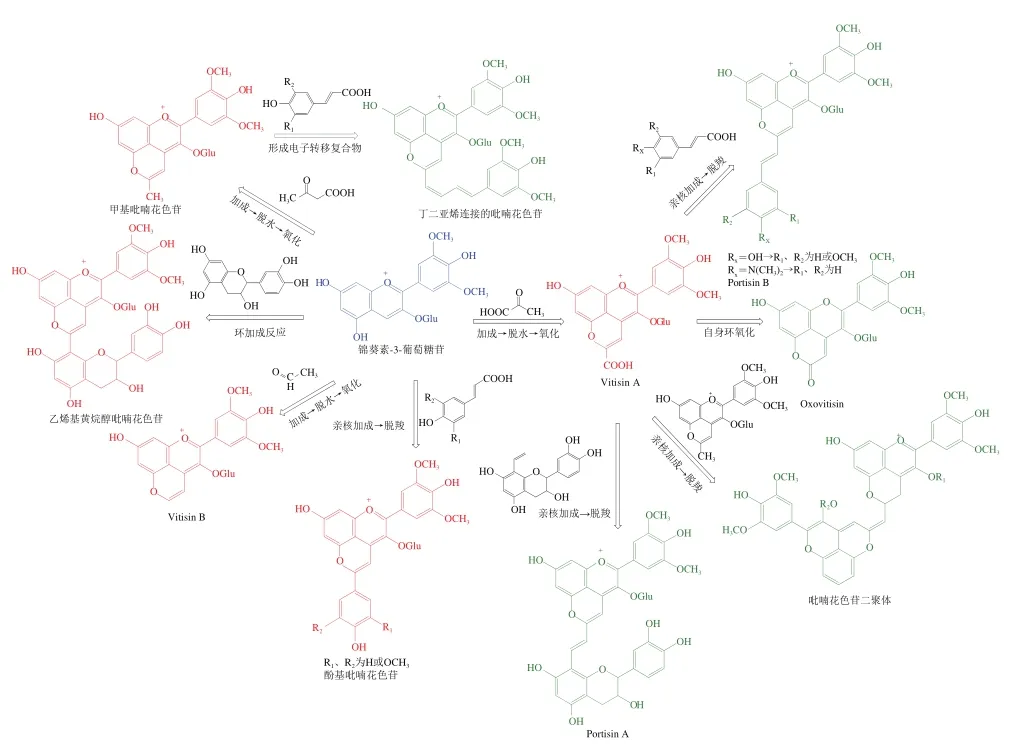
图11 常见吡喃花色苷的结构与形成过程Fig. 11 Formation processes and structures of normal pyranoanthocyanins
现阶段对吡喃花色苷的认识仍不够全面和深入。还存在如吡喃花色苷的高效制备、体内生物活性和吸收代谢机理及其他新型环保应用开发等相关问题目前尚未形成完整的科学研究体系。解决相关问题、挖掘更多功能及应用可能性是未来吡喃花色苷研究发展的方向。

