离体大鼠肝脏灌流法制备氯吡格雷活性巯基代谢物Δ
刘 艺,陶 婷,刘 云,李艳丽,胡盼盼,姜艳娇,孙增先(徐州医科大学附属连云港医院/连云港市第一人民医院药学部,江苏连云港 222002)
氯吡格雷活性巯基代谢物(clopidogrel active thiol metabolite,CATM,化学结构式见图1)是氯吡格雷发挥抗血小板疗效的最终活性物质[1]。CATM 化学结构复杂,C3—C16 双键和C4 位手性结构使其具有4 种构型,分别为H1(7S,3E,4S)、H2(7S,3E,4R)、H3(7S,3Z,4S)、H4(7S,3Z,4R),其中H1 和H2 为反式CATM、H3 和H4为顺式CATM[1]。已有研究表明,人体内CATM 的构型为顺式构型[2]。目前市面上仅有反式CATM异构体H1、H2的标准品,使CATM的体内研究受限。

图1 CATM化学结构式
对CATM进行合成的现有技术中,常用的方法有化学合成法和生物酶肝微粒体催化法,其中化学合成法需要对C3—C16 双键构型和C4 位手性构型进行选择,步骤复杂[3];生物酶肝微粒体催化法具有较高的生物选择性和转化效率,但肝微粒体成本高,酶催化反应条件严苛,同时因底物量受限难以得到足够的目标代谢产物[2]。已有研究显示,离体大鼠肝脏灌流法被广泛用于大鼠肝脏的生理、病理生理、肝损伤及药物代谢研究,兼具体外实验和整体动物实验的优点[4-6]。本实验拟采用(S)-2-氧氯吡格雷为底物,采用离体大鼠肝脏灌流法通过代谢途径制备CATM,旨在为顺式CATM的合成提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括肝脏器官灌流仪(徐州医科大学附属连云港医院临床药理实验室设计)、AKTA pure 型蛋白纯化仪(美国General Electric 公司)、DUC-23050-J00型真空冷冻干燥仪(英国GeneVac miVac公司)、Bruker avance ⅢHD 500 型核磁共振(nuclear magnetic resonance,NMR)仪(德国Bruker 公司)、Waters Acquity UPLC ⅠClass型超高效液相色谱仪(美国Waters公司)、AB Qtrap 4500 型质谱仪(美国AB Sciex 公司)、T1型氮气发生器(瑞士Gravimetrics公司)等。
1.2 主要药品与试剂
(S)-2-氧氯吡格雷(批号20200105,纯度99.0%)由徐州医科大学附属连云港医院临床药理实验室自制[7];氯化钠(批号20220417,纯度99.0%)、氯化钾(批号20160118,纯度99.5%)、七水合硫酸镁(批号20190625,纯度99.0%)、磷酸二氢钾(批号20190612,纯度99.5%)、氯化钙(批号20181012,纯度96.0%)、碳酸氢钠(批号20160219,纯度99.5%)、一水合葡萄糖(批号K1925024,纯度98.0%)均购自国药集团化学试剂有限公司;乙酸铵(批号E057G140,纯度98.0%)购自德国CNW 公司;盐酸(批号160112012H)购自南京化学试剂股份有限公司;肝素钠注射液(批号52108110,规格每2 mL 12 500 单位)购自江苏万邦生化医药集团有限责任公司;吸入用七氟烷(批号18120331,规格120 mL)购自上海恒瑞医药有限公司;硫酸氢氯吡格雷片(批号AA976,规格75 mg)购自赛诺菲(杭州)制药有限公司;氘代二甲基亚砜(批号296147,同位素纯度99.9%)购自美国Sigma 公司;乙腈、甲醇(均为色谱纯)均购自德国Merck公司,其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 动物
SPF 级雄性Sprague Dawley(SD)大鼠2 只,体质量200~250 g,由南通大学实验动物中心提供,实验动物生产许可证号为SCXK(苏)2019-0001,使用许可证号为SYXK(苏)2018-0026。大鼠在自然昼夜照明、相对湿度40%~70%、温度12~26 ℃的环境下饲养,自由饮水、进食(普通维持饲料)。
1.4 受试者
招募1名长期服用氯吡格雷的男性稳定期冠脉综合征受试者(75 mg 维持剂量),受试者试验前被告知试验方案与目的,并签署知情同意书。试验方案经徐州医科大学附属连云港医院伦理委员会批准,批件号为LW-20220309001-01。
2 方法
2.1 溶液的配制
2.1.1 Krebs-Henseleit 碳酸氢盐缓冲液 按Krebs-Henseleit 碳酸氢盐缓冲液(K-H 液)的经典配方(118 mmol/L 氯化钠,4.7 mmol/L 氯化钾,1.2 mmol/L 七水合硫酸镁,1.2 mmol/L 磷酸二氢钾,2.5 mmol/L 氯化钙,25 mmol/L碳酸氢钠[8]),再以终浓度为10 mmol/L的葡萄糖作为能量来源进行配制,具体操作如下:取氯化钠6.89 g、氯化钾0.35 g、七水合硫酸镁0.30 g、磷酸二氢钾0.16 g、碳酸氢钠2.10 g、一水合葡萄糖1.98 g、氯化钙0.27 g,用双蒸水溶解,并定容至1 000 mL,再用盐酸调pH 至7.35~7.45,经0.22 μm滤膜滤过,现配现用。
2.1.2 (S)-2-氧氯吡格雷灌流液 将(S)-2-氧氯吡格雷0.008 g 充分溶解于3 mL 乙腈中,再加入至297 mL K-H液中,混匀即得。
2.2 灌流方法
根据Wang 等[9]和Ferrigno 等[10]报道的方法加以改进,具体操作如下:SD大鼠术前禁食12 h,不禁水,用七氟烷维持吸入麻醉,沿腹直线打开腹腔,将内脏轻轻横置,暴露门静脉、下腔静脉(腹腔段),迅速于门静脉注入100 单位肝素抗凝并插管固定,用提前预热至37 ℃的K-H 液以10 mL/min 的流速冲洗肝脏残血;剪开下腔静脉(腹腔段),沿腹腔中线往上剪开胸腔,分出下腔静脉(胸腔段)并插管作为灌流液的流出管,同时结扎下腔静脉(腹腔段),形成灌流通路;迅速将完整的肝脏分离出来,转移至37 ℃的灌流室中,待肝脏残血冲洗干净后,换80 μmol/L 的(S)-2-氧氯吡格雷灌流液。灌流方式为非循环灌流。
2.3 CATM 和(S)-2-氧氯吡格雷定性定量分析的色谱与质谱条件
采用超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass,UPLC-MS/MS)法进行测定。色谱条件如下:以Waters Acquity UPLC BEH C18(2.1 mm×150 mm,1.7 μm)为色谱柱,以10 mmol/L乙酸铵溶液为流动相A、乙腈为流动相B进行梯度洗脱(洗脱程序见表1);流速为0.25 mL/min;柱温为40 ℃;进样室温度为4 ℃;进样量为2 μL。质谱条件如下:采用电喷雾离子源;采用多反应监测模式扫描母离子,增强子离子模式扫描碎片离子,正离子方式检出;气帘气(N2)压力为10 psi;碰撞气模式为High;离子化电压为5 500 V;温度为200 ℃;喷雾气(N2)压力为30 psi;辅助加热气(N2)压力为30 psi;CATM、(S)-2-氧氯吡格雷的定性离子对分别为m/z356.1→356.1、m/z338.1→338.1;去簇电压分别为70、175 V;扫描时间均为100 ms;碰撞能量均为5 eV。

表1 CATM和(S)-2-氧氯吡格雷定性定量分析的梯度洗脱程序
2.4 CATM分离纯化的色谱条件
以ChromCore 120 C18制备柱(10 mm×50 mm,5 μm)为色谱柱,以水为流动相A、乙腈为流动相B进行梯度洗脱(洗脱程序见表2);流速为1 mL/min;进样量为100 mL。

表2 CATM分离纯化的梯度洗脱程序
2.5 CATM的制备
取80 μmol/L 的(S)-2-氧氯吡格雷灌流液300 mL,按“2.2”项下方法以约3.3 mL/min 的流速进行90 min 的非循环灌流,制备CATM。收集灌流液,经0.22 μm水系滤膜滤过,按“2.4”项下方法进行分离纯化,每间隔1 min富集纯化后的洗脱物;再按“2.3”项下方法进样,验证洗脱物组分,确定目标组分的时间收集范围;富集目标组分,冷冻干燥后,称定质量,以最终获得CATM的物质的量与灌流液中(S)-2-氧氯吡格雷的物质的量之比计算转化率。
2.6 CATM的鉴定
2.6.1 质谱鉴定 取“2.5”项下制备的目标产物,用50%甲醇溶解稀释成500 ng/mL,在正离子模式下,针泵进样,流速为7 μL/min;在母离子全扫描模式下的扫描范围为350~360 Da,扫描速度为10 Da/s,扫描时间为5 min,分别确定目标产物母离子质荷比,并得最佳去簇电压值;在子离子扫描模式下的初始碰撞能为10 eV,以5~10 eV为步长调节,扫描速度为200 Da/s,扫描时间为5 min,获得子离子信息。
2.6.2 NMR谱鉴定 以氘代二甲基亚砜[核磁共振氢谱(1H-NMR)为2.50 ppm]为溶剂分别测定目标产物的1H-NMR谱和重水交换谱。将各氢信号分类编号汇总并依据NMR命名法(化学位移、氢分布、峰分裂数)对分子的单个质子氢信号进行共振分配,通过重水交换谱验证活泼氢信号。
2.7 CATM中4种立体异构体相对纯度的测定
取500 ng/mL 目标产物,按“2.3”项下方法进样分析,按归一化法计算其相对纯度。
2.8 顺式CATM保留时间的确定
受试者口服氯吡格雷后1 h,采集前臂静脉血2 mL,置于肝素抗凝管中,即刻以4 000×g离心10 min,取上层血浆50 μL,加入乙腈250 μL,涡旋振荡5 min,再以12 000×g离心5 min,取上清液吹干后,以“2.3”项下初始比例的流动相复溶,取10 μL,按“2.3”项下方法进样分析。
3 结果
3.1 CATM的制备情况
80 μmol/L的(S)-2-氧氯吡格雷经过2次离体大鼠肝脏灌流生物转化,得灌流液580 mL,经分离纯化得目标产物2 mg,即48 μmol 的(S)-2-氧氯吡格雷生物转化得5.62 μmol 的目标产物,转化率为11.71%。分离纯化后的洗脱液中目标组分的色谱图(图2A)显示,有4个峰分别在21.5、22.6、26.7、27.9 min 时被洗脱,其相应质谱图较为相似(图2B),显示主要碎片离子为m/z155.2、182.8、212.1、296.1,与研究报道类似[11-12],可确认这4 个峰为CATM的4个立体异构体。

图2 分离纯化后目标组分的色谱图和质谱图
3.2 目标产物的质谱鉴定结果
目标产物质谱优化后的最佳去簇电压为60 V,碰撞能量为29 eV,观察到母离子为m/z356.1、358.1,分别为35Cl和37Cl的同位素峰,峰高比约为3∶1(图3A);主要碎片离子为m/z154.8、183.0、212.0、322.0(图3B),确认目标产物为CATM[11-12]。目标产物的裂解示意图见图4。
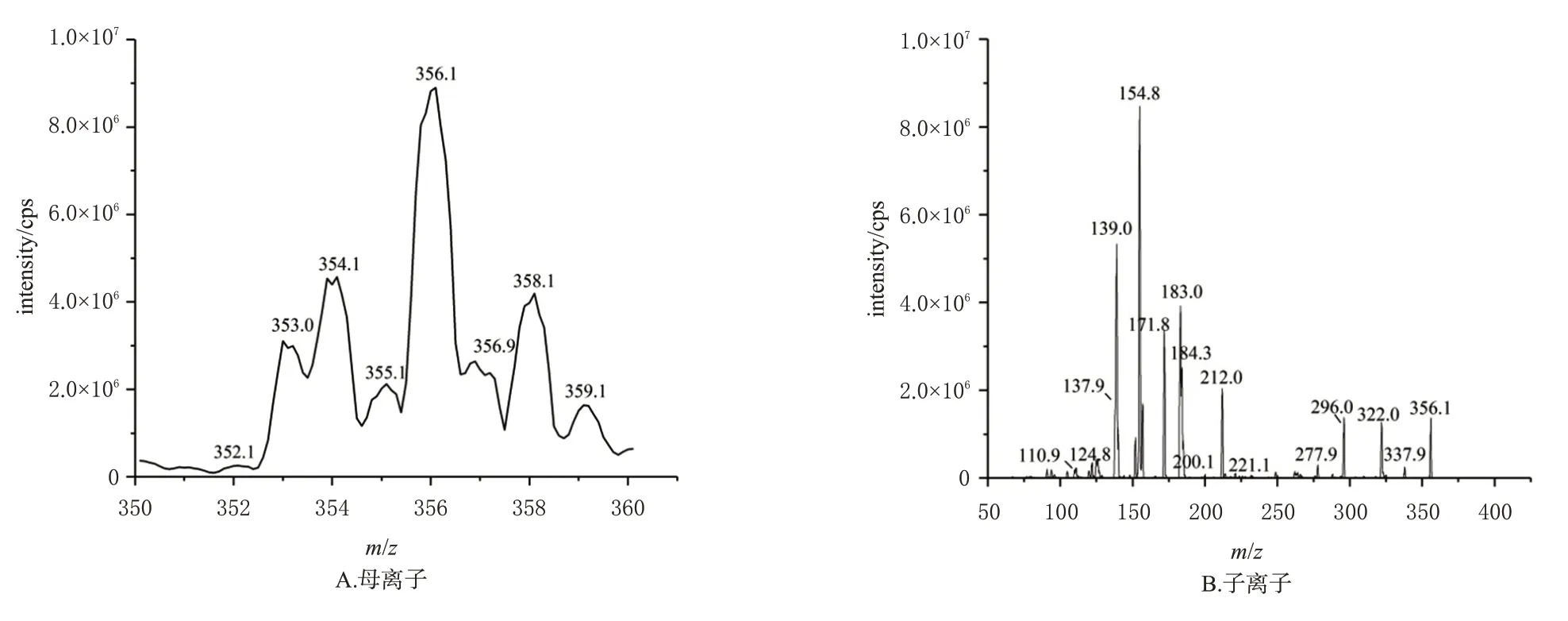
图3 目标产物的母离子和子离子质谱图

图4 目标产物的裂解示意图
3.3 目标产物的NMR谱鉴定结果
目标产物的1H-NMR谱和重水交换谱见图5。结果显示,7.35~7.57(4H,m)为邻位取代苯环上氢信号;5.90(1H,s)为烯氢信号;12.24(1H,brs)、3.05(1H,s)为活泼氢信号,重水交换后消失;3.63(3H,s)为甲氧基氢信号;4.71(1H,m)为连氮原子上次甲基氢信号;2.90~2.56(2H,m)、2.09~1.68(2H,m)、3.81~3.86(1H,m)、3.81~3.86(2H,m)为连氮原子上亚甲基及连硫原子上次甲基氢信号;8.32(0.2H,s)、5.20(1H,s)、1.91(0.4H,s)、7.35~7.57(1H,m)为其他杂质上氢信号,确认目标产物为CATM[2]。目标产物的1H-NMR 结果见表3(由于纯化的化合物量不足,未获得CATM的13C-NMR谱图)。

表3 目标产物CATM的1H-NMR结果(δ/ppm)
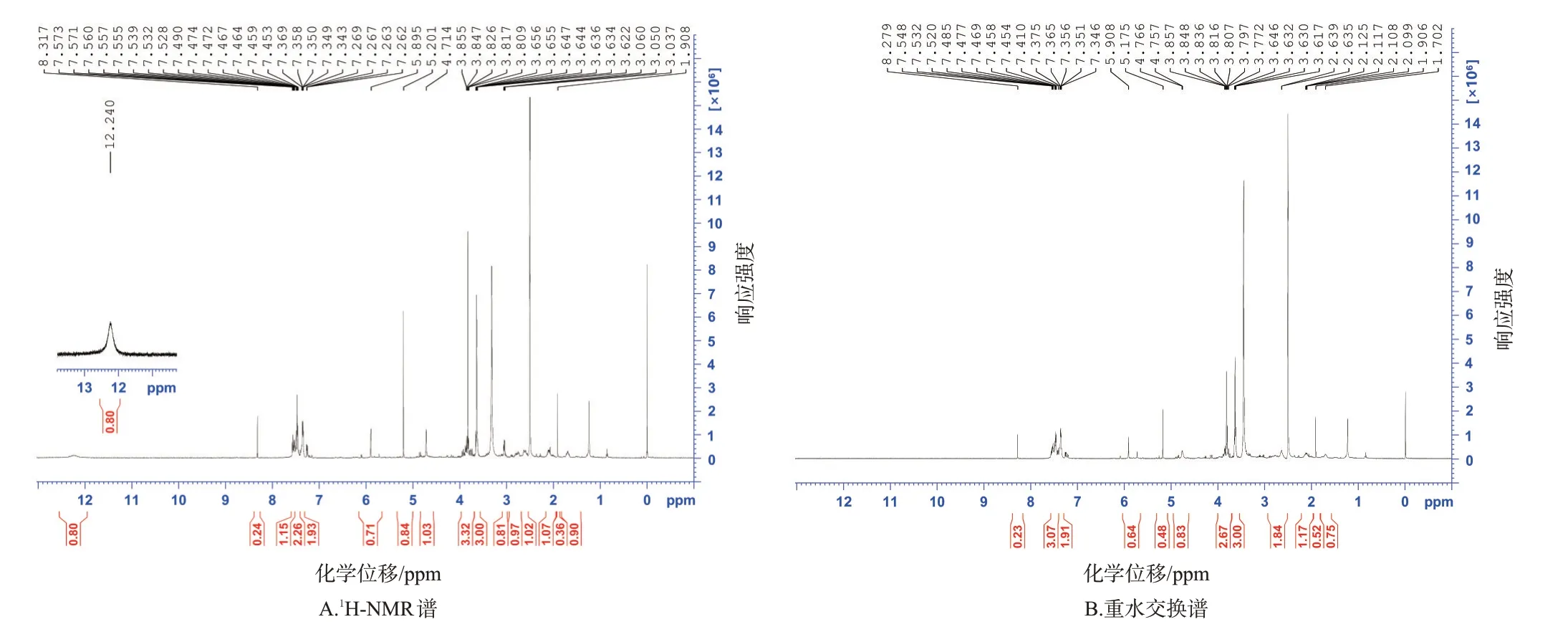
图5 目标产物的1H-NMR谱和重水交换谱
3.4 CATM中4个立体异构体的相对纯度
CATM 的峰1~峰5 的保留时间分别为10.7、21.3、22.3、26.5、27.3 min,峰面积占比(相对纯度)分别为7.14%、7.13%、7.23%、63.52%、14.97%,其中峰2~峰5为CATM的4个立体异构体。CATM的UPLC-MS/MS色谱图见图6。

图6 CATM的UPLC-MS/MS色谱图
3.5 CATM活性构型保留时间的确认及目标产物的纯度分析
受试者体内CATM的色谱图(图7)显示其只有1个主要色谱峰,保留时间为26.3 min,其为人体内的顺式CATM[2]。结合“3.4”项下结果可知,目标产物CATM 中保留时间为26.3 min左右(即26.5 min)的色谱峰峰面积占比较高(约63.52%),即目标产物CATM 中含有较高的顺式CATM。

图7 受试者体内CATM的UPLC-MS/MS色谱图
4 讨论
4.1 质谱条件
因为CATM各立体异构体的标准品尚无法商购,不能获得其母离子和子离子信息,所以在UPLC-MS/MS法中将母离子和子离子均设为母离子的质荷比,碰撞能量设为5 eV。该方法可以使母离子尽量在四极杆的子离子通道内以原型存在,随后通过离子阱对该母离子进行裂解,得到相应的质谱图,以便进行CATM 各构型的鉴定。
4.2 CATM制备纯化方法
CATM结构中的巯基基团化学性质活泼,使其制备纯化较为困难。在进行C18制备柱纯化之前,根据观察,所得到的CATM 灌流液难以保存,经0.22 μm 滤膜滤过后得到的澄清液体,在-80 ℃仅能保存7 d左右,故灌流结束后应尽快对其中的目标产物进行分离纯化,并且制备过程中的每个操作都应尽量在4 ℃和避光环境下进行,以防止其失活。在分离纯化过程中,将灌流得到的含CATM 的灌流液在AKTA pure 型蛋白纯化仪上以流动相的方式上样100 mL,分6 次通过C18制备柱分离纯化,首先以97%的水相除去灌流液体系中的无机盐,随后通过55%的水相等度洗脱CATM,最后以100%的有机相等度洗脱色谱柱中残留的(S)-2-氧氯吡格雷,洗脱收集时间范围为57~64 min。
CATM 的转化率为11.71%,转化率受以下因素影响:(1)灌流液在肝组织和灌流管路中存在损失;(2)(S)-2-氧氯吡格雷未充分转化;(3)CATM可能以其他结合形式存在;(4)CATM 在制备纯化过程中因结构不稳定造成损失。本研究中,图6 与图2A 相比,色谱峰的峰形较差,其原因与色谱柱柱效降低有关。本研究通过对比人体内CATM 活性构型的保留时间并结合文献[2]分析,确定目标产物CATM中保留时间为26.5 min的色谱峰为活性构型顺式CATM,再结合“3.4”项下结果可知,目标产物CATM中活性构型顺式CATM的占比最高。
综上所述,本研究以(S)-2-氧氯吡格雷为底物,采用离体大鼠肝脏灌流法生物转化和C18制备柱分离纯化获得目标产物,转化率为11.71%;经质谱和NMR 谱鉴定目标产物为CATM,其中顺式CATM的占比较高。该方法具有成本低、步骤较为简单的优点,但同时也存在实验操作技术要求较高的缺点。

