加减益经汤对大鼠卵巢储备功能下降的影响及机制研究Δ
万云慧,陈晓勇(江西省妇幼保健院中医科/江西省中西医结合女性生殖重点研究室,南昌 330006)
卵巢储备功能下降(decrease of ovarian reserve,DOR)是指女性卵巢产生的卵母细胞数量及其质量下降,主要表现为月经不调、继发性闭经、不孕等症状[1]。DOR是卵巢功能退化至某种程度的一种疾病,若不加以干预,卵巢功能可能继续退化而造成卵巢功能不全或卵巢早衰,因此必须尽早采取有效方法对其进行干预治疗。但目前现代医学对DOR 的发病机制尚未明确,因此临床暂时缺乏安全有效的DOR 治疗方法,西医主要依靠激素补充治疗,但长期激素治疗会增加患者的患癌风险[2-3]。已有报道提出,肾气盛衰与心、肝、脾之气有关,由此创制的益经汤使心、肝、脾、肾四经同治[4]。加减益经汤是在益经汤的基础上去白术、山药,加菟丝子(增强了补肾的作用),去生枣仁、牡丹皮,加丹参(“一味丹参,功同四物”,减少了方剂药物的组成),易人参为党参而组成。有研究认为,加减益经汤对DOR 患者卵巢功能的改善效果十分明显,且在改善卵巢储备功能、提高女性受孕率方面具有一定功效[5-6],但其作用机制尚不清楚。有研究指出,长时间缺氧会诱发多种细胞死亡,是导致卵泡闭锁、卵母细胞数量减少、卵巢功能衰退的重要原因之一[7-9]。低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)、B 淋巴细胞瘤2 基因/腺病毒E1B 相互作用蛋白3重组蛋白(B lymphocytoma 2 gene/adenovirus E1B interacting protein 3 recombinant protein,Bnip3)、自噬关键分子酵母Atg6同系物(Beclin1)通路参与调节细胞缺氧自噬,通过调节上述通路可逆转小鼠卵巢内的缺氧及自噬状态,从而发挥提高DOR 模型小鼠生育力的作用[10-11]。基于此,本研究探讨了加减益经汤对DOR模型大鼠的影响,从HIF-1α/Bnip3/Beclin1 通路出发初步分析其可能机制,以期为DOR的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括XDS-900C型光学显微镜(上海蔡康光学仪器有限公司)、GS-15R型离心机(美国Beckman 公司)、BIOBASE-EL10A 型酶标仪(山东博科再生医学有限公司)、BL2200H 型电子天平(日本Shimadzu 公司)、9700 型聚合酶链反应(polymerase chain reaction,PCR)仪(美国Bio-Rad 公司)、Lodigit 型WB 凝胶成像仪(上海天能科技有限公司)等。
1.2 主要药品与试剂
熟地黄、党参、菟丝子、丹参、杜仲、北沙参、白芍、当归、柴胡药材(批号均为101018)均购自浙江中医药大学中药饮片厂,由江西省妇幼保健院中药房刘迎新副主任中药师鉴定均为真品;环磷酰胺(批号756230,纯度≥99%)购自北京华迈科生物技术有限责任公司;苏木精-伊红染液(批号G1120)和TRIzol 试剂(批号15596-026)均购自北京索莱宝科技有限公司;促卵泡素(follicle stimulating hormone,FSH)、促黄体生成激素(luteinizing hormone,LH)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(批号分别为ER0960、ER1123)均购自武汉恩菲生物科技有限公司;抗苗勒氏管激素(anti-Müllerian hormone,AMH)ELISA 试剂盒(批号E-EL-M3015)购自武汉伊莱瑞特生物科技有限公司;雌激素(estrogen,E2)ELISA 试剂盒(批号20201214)购自上海研启生物科技有限公司;鼠源HIF-1α、Bnip3、Beclin1 单克隆抗体(批号分别为ab179483、ab109362、ab254511)均购自英国Abcam 公司;BCA 蛋白浓度检测试剂盒(批号S0131S)购自上海碧云天生物技术有限公司;逆转录试剂盒(批号4374966)购自美国Thermo Fisher Scientific 公司;戊酸雌二醇片(批号201710BJ125,规格1 mg/片)购自拜尔医药保健有限公司广州分公司;HIF-1α转录抑制剂YC-1(批号Y1027)购自美国Sigma-Aldrich公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G 二抗和鼠源β-肌动蛋白(β-actin)抗体(批号分别为20181225、16AF0207)均购自北京中杉金桥生物技术有限公司;其他试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 实验动物
SPF 级SD 成年雌性大鼠140 只,7~8 周龄,体质量(200±20)g,购自浙江省医学科学院,实验动物生产许可证号为SCXK(浙)2019-0002。所有大鼠饲养在无菌环境中,温度约为27 ℃,相对湿度约为55%,自由进食。本实验经南昌大学实验动物科学中心伦理委员会批准(批号2020JXFYKY06013)。
2 方法
2.1 加减益经汤的制备
取熟地黄、党参、菟丝子药材各20 g,丹参、杜仲、北沙参药材各15 g,白芍、当归药材各10 g,柴胡药材6 g,加水没过药材并共同煎煮1 h,取滤液,然后将其浓缩成高、中、低质量浓度[2.36、1.18、0.59 g/mL(以生药量计)]的药液,装瓶冷却后,低温储藏。
2.2 分组、造模与给药
通过观察阴道脱落细胞切片对比大鼠的动情周期情况。挑选动情周期正常的大鼠140 只,按随机数字表法分为对照组、模型组、阳性对照组、抑制剂组和加减益经汤低、中、高剂量组,每组20只。大鼠在实验室适应性喂养1周后,对照组大鼠股静脉注射等体积生理盐水,其余各组大鼠股静脉注射环磷酰胺(75 mg/kg)1 mL 复制DOR 模型[12]。注射结束24 h 后根据阴道脱落细胞切片观察大鼠动情周期情况,动情周期≥6 d 或停滞在某一时期≥3 d 者,视为动情周期紊乱,表示DOR 造模成功。造模成功2 h 后,加减益经汤低、中、高剂量组大鼠灌胃加减益经汤(5.9、11.8、23.6 g/kg)[13],抑制剂组大鼠灌胃加减益经汤23.6 g/kg 并同时股静脉注射YC-1(2 mg/kg),阳性对照组大鼠灌胃戊酸雌二醇片0.09 mg/kg,对照组和模型组大鼠灌胃等体积生理盐水,每日给药1次,连续8周。
2.3 动情周期观察
药物干预24 h 后,以生理盐水湿润消毒棉签后,插入大鼠阴道深约0.5 cm,旋转一周,将棉签上的分泌物均匀涂抹于载玻片并晾干,滴加多聚甲醛固定15 min,苏木精浸染5 min,盐酸乙醇分化10 s,伊红染色20 s,流水冲洗后干燥封片,在显微镜下观察脱落细胞形态,评价各组大鼠动情周期变化。
2.4 卵巢指数和病理学观察
药物干预结束后,各组大鼠称定质量后禁食12 h,麻醉后剪开腹腔,分离卵巢并称定质量,计算卵巢指数[卵巢指数=卵巢湿质量(mg)/体质量(g)×100%],然后将大鼠部分卵巢组织制成石蜡切片,采用苏木精-伊红染色后,在显微镜下观察其病理学变化。
2.5 卵巢细胞自噬情况观察
取大鼠病理学观察剩余的部分卵巢,去除周围脂肪组织,低倍镜下用25 号针头刺破卵泡,分离卵母细胞和颗粒细胞,吹打使细胞分离,200 目网筛过滤,以800 r/min 离心10 min,弃上清,收集细胞。24 h 后细胞消化后爬片,用乙醇及丙酮脱水,环氧树脂浸透、包埋,切片(厚50~60 nm),以醋酸双氧铀-柠檬酸铅双重染色,于透射电镜下观察自噬情况。
2.6 血清激素水平检测
抽取各组大鼠腹腔主动脉血5 mL,以3 000 r/min离心15 min,取上清液,按ELISA试剂盒方法,检测血清中FSH、LH、AMH、E2水平。
2.7 卵巢组织中HIF-1α、Bnip3、Beclin1蛋白表达检测
采用Western blot 法检测。取各组大鼠部分卵巢组织,提取总蛋白,采用BCA法测定蛋白浓度,加热变性5 min 后,取部分变性后的蛋白样品,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将蛋白质从凝胶转移至PVDF膜上,在室温下用5%脱脂奶粉封闭1 h,加入HIF-1α、Bnip3、Beclin1、β-actin 一抗(稀释比例均为1∶1 000),4℃孵育过夜;用TBST 缓冲液洗涤3 次,加入HRP 标记的二抗(稀释比例为1∶5 000),室温下孵育1 h,显色显影,通过Image J v1.8.0 软件分析,以目标蛋白与内参蛋白(β-actin)灰度值的比值表示目标蛋白的相对表达量。
2.8 卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA表达检测
采用实时定量PCR 法检测。取各组大鼠部分卵巢组织于匀浆器中,加入TRIzol试剂提取总RNA,按逆转录试剂盒说明书要求,将提取的总RNA逆转录成cDNA,再进行扩增。引物采用PyroMark Assay Design 2.0软件设计,由美国Thermo Fisher Scientific 公司合成,引物序列和产物长度见表1。以β-actin为内参,采用2-ΔΔCT法计算HIF-1α、Bnip3、Beclin1 mRNA的相对表达量。

表1 引物序列和产物长度
2.9 统计学方法
使用SPSS 20.0软件对数据进行统计学分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,事后比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 大鼠动情周期比较
对照组大鼠表现出规律的动情周期;模型组和抑制剂组大鼠动情周期均出现紊乱,主要表现为不同程度的动情周期延长,每次5~9 d,甚至未见完整的动情周期;阳性对照组和加减益经汤各剂量组大鼠动情周期恢复正常,每次4~5 d。实验结束时,模型组有41.6%的大鼠停止动情8 d后自然恢复正常动情周期,58.4%的大鼠未能恢复正常动情周期。
3.2 大鼠卵巢指数比较
如图1所示,相较于对照组大鼠,模型组和各给药组大鼠卵巢指数均显著降低(P<0.05);相较于模型组大鼠,阳性对照组和加减益经汤各剂量组大鼠卵巢指数均显著升高(P<0.05)。
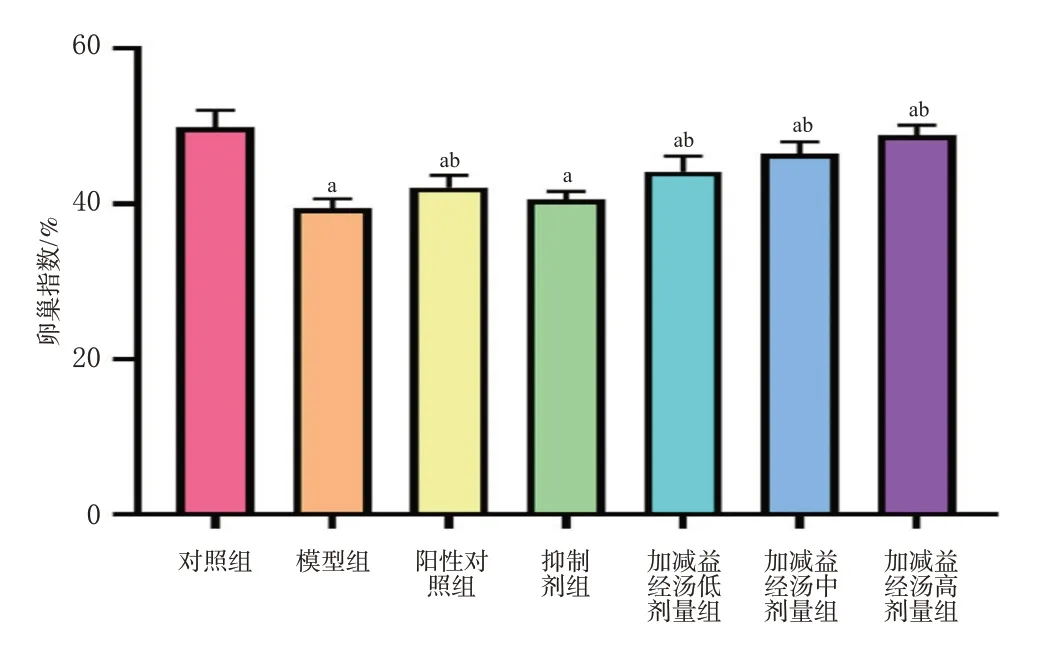
图1 各组大鼠卵巢指数的比较(,n=20)
3.3 大鼠卵巢组织病理形态比较
如图2所示,对照组大鼠卵巢组织内卵泡数量丰富,卵细胞形态完整,细胞排列整齐,黄体数量多且发育完好;模型组大鼠卵巢组织内卵泡数量较少,卵细胞皱缩或消失,细胞排列紊乱,黄体数量少且发育较差;抑制剂组大鼠卵巢髓质虽有萎缩但皮质增生不明显,间质纤维化程度较模型组轻;相较于模型组大鼠,阳性对照组和加减益经汤各剂量组大鼠卵巢组织成熟卵泡增多,黄体增多,病理情况均有所改善。
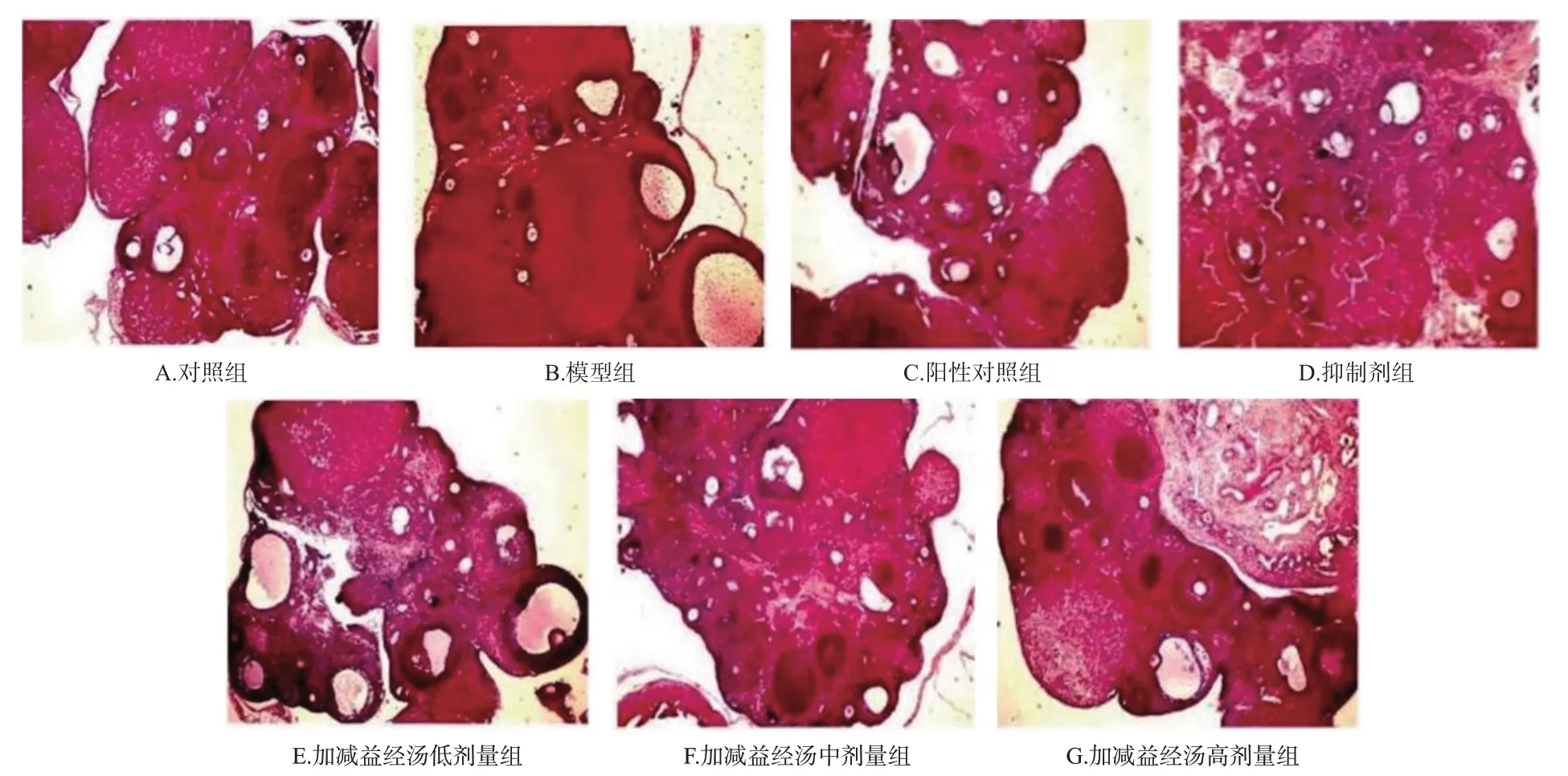
图2 各组大鼠卵巢组织病理形态结构(×40)
3.4 大鼠卵巢细胞自噬情况比较
如图3所示,对照组大鼠卵巢细胞核较大,染色质分布均匀,细胞器明显;模型组和抑制剂组大鼠卵巢细胞核变小,染色质凝聚,细胞质呈现空泡化,可以观察到自噬溶酶体;相较于模型组大鼠,阳性对照组和加减益经汤各剂量组大鼠卵巢细胞自噬情况均有所改善。
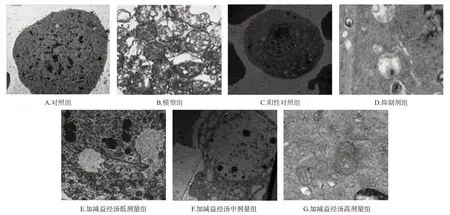
图3 各组大鼠卵巢细胞自噬情况(×25 000)
3.5 大鼠血清激素水平比较
如表2所示,相较于对照组大鼠,模型组大鼠血清中FSH、LH 水平均显著升高,AMH、E2水平均显著降低(P<0.05);相较于模型组大鼠,阳性对照组和加减益经汤各剂量组大鼠血清中FSH、LH 水平均显著降低,AMH、E2水平均显著升高(P<0.05)。
表2 各组大鼠血清激素水平比较(,n=20)
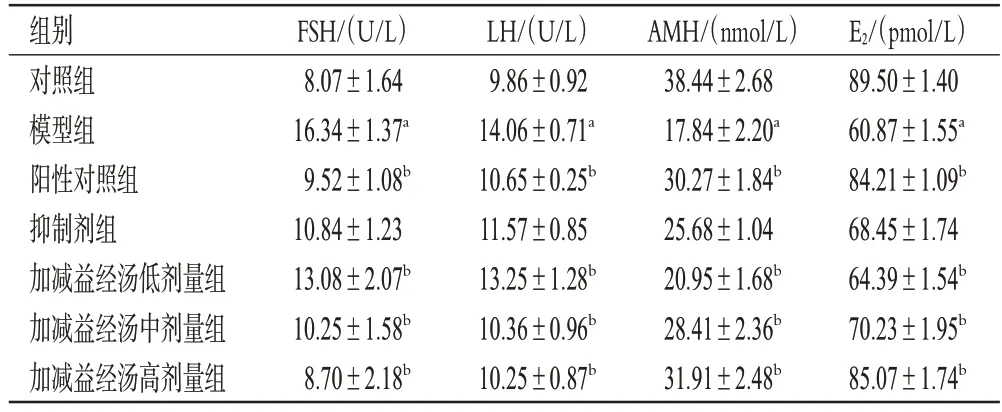
表2 各组大鼠血清激素水平比较(,n=20)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05
3.6 大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 蛋白相对表达量比较
如表3、图4 所示,相较于对照组大鼠,模型组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1蛋白相对表达量均显著升高(P<0.05);相较于模型组大鼠,阳性对照组、抑制剂组和加减益经汤中、高剂量组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1蛋白相对表达量均显著降低(P<0.05),加减益经汤低剂量组大鼠卵巢组织中Beclin1 蛋白相对表达量显著降低(P<0.05)。
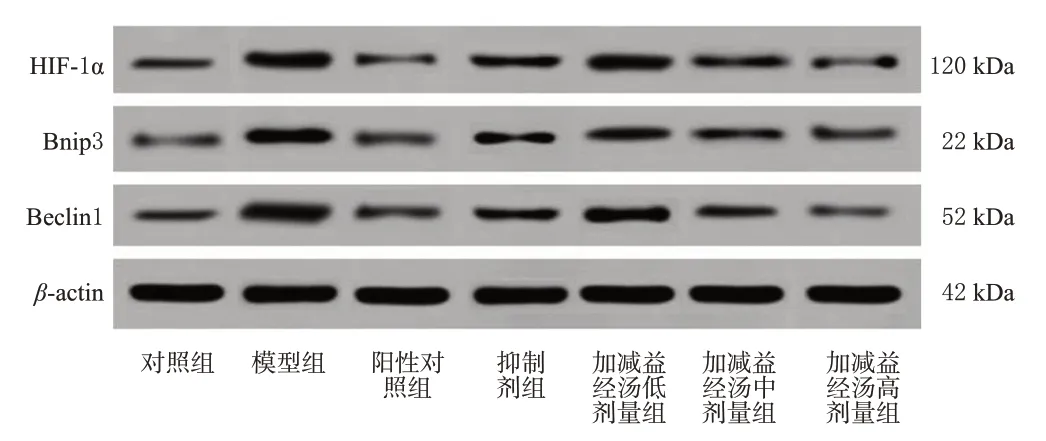
图4 各组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1蛋白表达的电泳图
表3 各组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1蛋白相对表达量比较(,n=20)
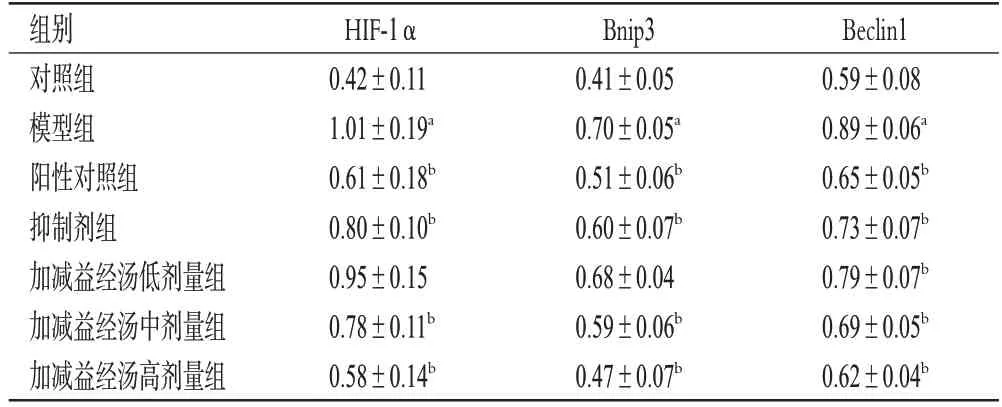
表3 各组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1蛋白相对表达量比较(,n=20)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05
3.7 大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA相对表达量比较
如表4所示,相较于对照组大鼠,模型组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA 相对表达量均显著升高(P<0.05);相较于模型组大鼠,阳性对照组和加减益经汤中、高剂量组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA 相对表达量均显著降低,抑制剂组和加减益经汤低剂量组大鼠卵巢组织中HIF-1α、Beclin1 mRNA相对表达量均显著降低(P<0.05)。
表4 各组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA表达比较(,n=20)

表4 各组大鼠卵巢组织中HIF-1α、Bnip3、Beclin1 mRNA表达比较(,n=20)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05
4 讨论
DOR是一种发病机制复杂且持续性进展的疾病,近年来发病率持续升高,若不加以干预,其将发展为卵巢功能不全或卵巢早衰,进一步加大治疗难度。整体观念、辨证论治的中医思想在调节身体机能方面具有明显优势,可通过多靶点、多通路共同改善DOR患者卵巢功能障碍。DOR 的临床症状在中医上归于闭经、血枯、不孕症等范畴,肾藏精、主生殖,中医认为卵细胞的正常发育及排出均依靠肾气旺盛,肾虚则会导致卵细胞发育或排出受阻,无法受孕,因此中医治疗时多以补肾填精、益气养血为治疗原则;并且临床研究结果也显示,补肾类中药或汤剂对卵巢功能的改善作用明显[14-15]。这提示深入研究补肾方对DOR的临床治疗具有重要意义。
加减益经汤在益经汤基础上增强了补肾作用,同时兼顾健脾疏肝、补血活血、清养心肺之效,调养肾、脾、肝三经,全方补而不腻、疏不耗正。李丽美等[16]通过构建DOR 大鼠模型研究加减益经汤对其影响,结果发现,加减益经汤能够改善DOR 模型大鼠的性激素水平,改善其卵巢组织病理形态。卵巢功能降低会降低血清中E2的水平,同时降低卵泡对FSH、LH 的敏感度,而为提高FSH、LH的作用效率,垂体代偿性分泌大量FSH 与LH,机体内FSH、LH水平明显升高,因此FSH、LH与E2含量常用来评估卵巢储备功能[12]。AMH 是在卵巢中产生的一种蛋白激素,与卵巢功能密切相关且其水平不易受外来因素干扰,因此AMH 也是评价卵巢储备功能的重要指标[16]。已有研究报道,加减益经汤能明显缓解DOR患者的临床症状、改善其卵巢功能[17-18]。本研究以环磷酰胺所致DOR 模型大鼠为对象,研究加减益经汤对其改善作用,结果发现,造模成功后的大鼠动情周期紊乱、卵巢指数明显下降、卵巢组织形态出现病理变化,血清中FSH、LH 含量增加,AMH 及E2含量减少,以上特征均符合DOR的病理特征,提示DOR模型成功构建;经加减益经汤干预后,模型大鼠的动情周期逐渐恢复正常,上述病理特征均有所改善,提示加减益经汤可调节DOR 模型大鼠的性激素分泌、改善其卵巢功能。
DOR 的治疗难点在于无法针对其发病机制采取有效干预手段。机体细胞在程序性死亡、能量代谢等生理过程中会产生缺氧的应激反应,例如卵泡发育时,基底屏障使血管无法向卵泡内部进行渗透,卵泡内部形成低氧环境,不利于卵泡及卵母细胞的生长发育[19]。有研究指出,HIF-1α与卵泡质量呈负相关,HIF-1α水平能在一定程度上反映卵泡质量[20]。本研究结果显示,模型组大鼠卵巢组织中HIF-1α蛋白以及mRNA 水平均高于对照组,提示卵巢组织可能处于缺氧状态并影响卵泡发育;经加减益经汤干预后的DOR 模型大鼠卵巢组织中的HIF-1α蛋白以及mRNA水平降低,提示加减益经汤可改善DOR模型大鼠缺氧状态。缺氧使HIF-1α在细胞内大量积攒,与细胞核内的缺氧诱导因子1β结合形成二聚体,刺激其靶蛋白Bnip3表达;Bnip3与Beclin1相互竞争地与B淋巴细胞瘤2基因结合,Beclin1与B淋巴细胞瘤2基因解离诱导了细胞自噬[21],因此HIF-1α/Bnip3/Beclin1是细胞内缺氧诱导细胞自噬的重要通路。本研究结果显示,模型组大鼠卵巢组织中Bnip3、Beclin1 蛋白以及mRNA水平均显著高于对照组,提示缺氧可激活Bnip3/Beclin1 通路,诱导细胞自噬,从而造成组织损伤;经加减益经汤干预后DOR 模型大鼠卵巢组织中的Bnip3、Beclin1 蛋白及mRNA 水平均有所下降,但抑制剂组较加减益经汤中、高剂量组的上述指标均出现上升,表明抑制剂可能会干扰加减益经汤抑制HIF-1α/Bnip3/Beclin1通路。电镜结果也显示,经加减益经汤干预后,卵巢细胞自噬改善,说明加减益经汤可能通过改变缺氧条件来逆转细胞自噬过程,从而改善卵巢功能。
综上所述,加减益经汤能够改善DOR 模型大鼠卵巢功能、调节性激素分泌、保护卵巢组织,其作用机制可能与抑制HIF-1α/Bnip3/Beclin1通路相关。

