小米饲料干预对高脂膳食联合STZ诱导糖尿病大鼠肠道菌群的影响
任 欣,张付龙,秦梦园,沈 群✉
(1. 北京工商大学 食品与健康学院,食品营养与人类健康北京高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2. 中国农业大学 食品科学与营养工程学院,国家粮食产业(青稞深加工)技术创新中心,北京 100083)
Ⅱ型糖尿病是一种复杂的慢性代谢疾病,已经给全球人类健康构成了重大威胁。我国更是成为全球糖尿病患者数量最多的国家[1]。近年来随着肠道微生物研究的不断深入,不仅给人们研究疾病提供了一个新视角,而且其潜在的医学价值也在不断被挖掘。从肠道微生物结构组成和发挥作用方式两个角度来看,它可能直接或间接的参与了众多复杂代谢疾病的发展,且关系十分紧密[2]。已有研究表明,Ⅱ型糖尿病和肥胖均与肠道菌群的紊乱有关,具体表现在肠道微生物组成和相对丰度上与健康个体的偏离[3],而个体饮食的差异在很大程度上又会影响其体内肠道菌群的变化[4]。现阶段对肠道菌群结构组成的鉴定及发挥功能的机制探究已经成为人类疾病研究领域内的一个重要组成元素[5],包括Ⅱ型糖尿病[6]。然而由于肠道微生物体量巨大、复杂多变,有关不同条件下,包括特定膳食干预条件下以及膳食干预前后,肠道微生物的组成变化仍需进一步深入细致的研究。
前期研究已经证明,糖尿病大鼠经小米膳食干预后,血糖代谢有所改善,并且对糖耐量减低患者也能发挥良好的降糖效果[7-8],并且均与肠道菌群组成与结构变化有关[9-10]。但是,以往有关肠道菌群的研究均是单独进行不同组别间在同一时间点的横向比较,从未进行过同一组别在不同时间点的纵向比较,未能全面清晰的展示小米膳食干预对肠道菌群的影响。因此,本研究以前期人群实验为指导,以高脂膳食联合链尿佐菌素(Streptozotocin,STZ)诱导糖尿病大鼠模型为干预对象,分别从横、纵两个维度分析比较正常对照大鼠、模型对照大鼠与小米膳食干预大鼠肠道微生物的组成和结构差异,阐明小米饲料干预对糖尿病大鼠肠道菌群的影响,为丰富“食物-菌群-疾病”理论提供数据支撑。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
本试验所用的30只6周龄雄性SD大鼠均取自北京维通利华实验动物技术有限公司(动物合格证号:11400700149680)。
1.1.2 动物饲料
试验过程中所用饲料由北京科奥协力有限公司提供。严格按照Research Diet配方要求制作10%低脂对照饲料和60%高脂饲料。在保持各营养素供能比恒定的前提下,根据人与大鼠之间的换算关系[11],设计制作20%小米干预饲料[7]。各饲料具体配方及营养素供能比如表1所示。
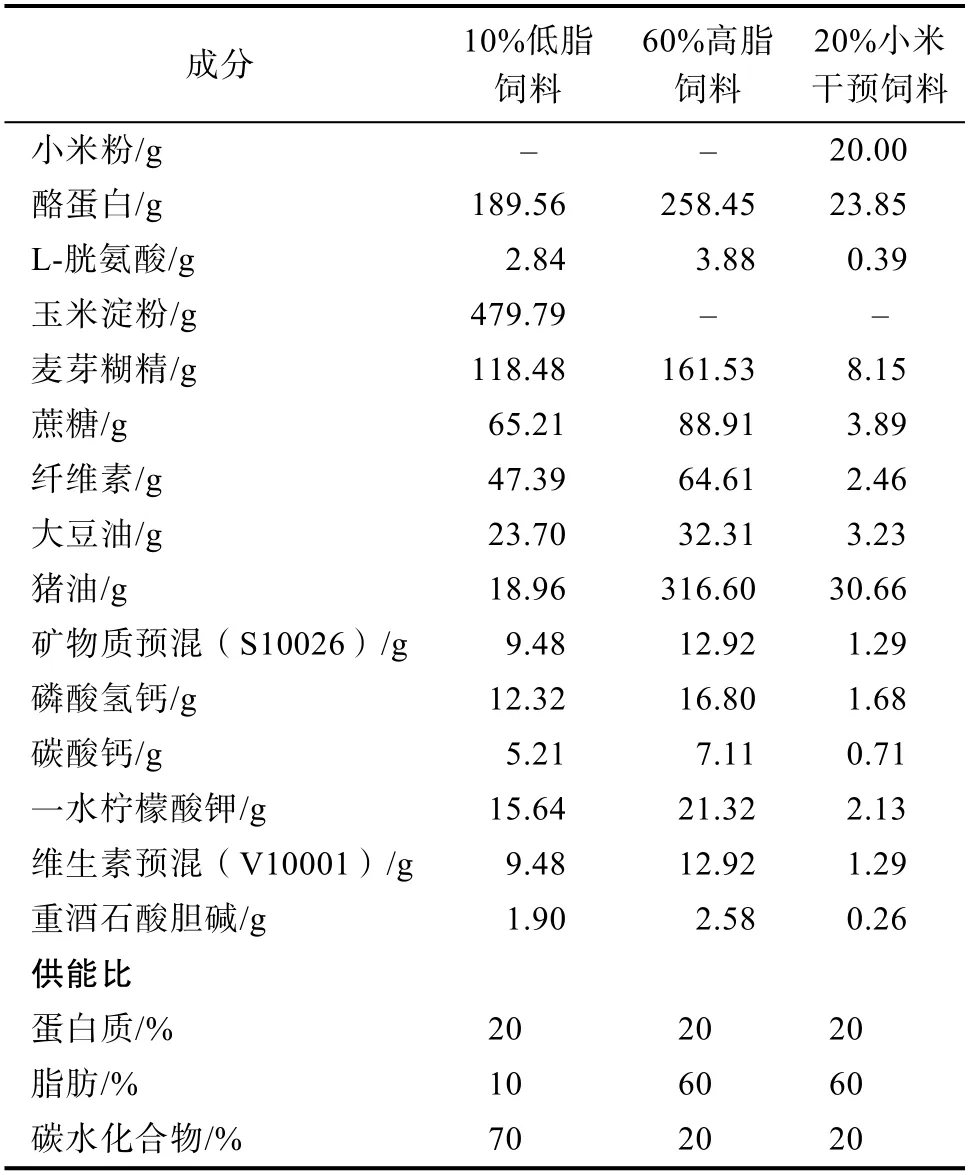
表1 试验用不同饲料的具体配方Table 1 The specific formulas of animal feeds
1.2 仪器与设备
PowerSoil-htp 96 Well Soil DNA Isolation Kit试剂盒:美国MoBio公司;GoTaq® Hot Start Colorless Master Mix:美国Promega公司;QIAquick®PCR Purification Kit试剂盒:Qiagen公司。
1.3 试验方法
1.3.1 大鼠饲养
所有大鼠饲养在SPF屏障环境内,且保持在(22±2)℃、55%±5%相对湿度和12 h∶12 h光暗循环的条件,大鼠可自由摄食和饮水。环境适应1周后,随机从所有大鼠中挑选10只作为正常对照组(NC,10%低脂饲料),剩余20只大鼠进行为期4周的60%高脂饲料膳食干预。
1.3.2 糖尿病大鼠的造模及分组
4周高脂饮食干预后,模型组大鼠禁食12 h,然后腹腔注射STZ溶液(注射剂量为35 mg/kg,将原STZ用0.1 mmol/L的柠檬酸盐缓冲溶液稀释成1%的溶液,并调节pH为4.2~4.5),继续高脂喂养。NC组10只注射等量缓冲液。3天后尾静脉取血,当随机血糖超过16.7 mmol/L时,即判定为糖尿病[12-13]。随后将造模成功的糖尿病大鼠随机分为模型对照组(DC,60%高脂饲料)和小米饲料干预组(FM,20%小米干预饲料)。
1.3.3 样品采集
采集动物粪便时采用逼迫刺激法,用手指轻轻按压大鼠腹部及臀部。在无菌条件下快速收取干预试验前后大鼠的粪便样品,并立即放置在-80 ℃的冷环境下保存,用于后续肠道微生物组检测。
1.3.4 肠道菌群分析
利用PowerSoil-htp 96 Well Soil DNA Isolation Kit试剂盒从动物粪便样本中提取总DNA,用适量的无菌水稀释DNA纯度和浓度双达标的样品,制成0.5 ng/μL的微量溶液。选定扩增区域后,为保证扩增效率和减小出错率,使用GoTaq® Hot Start Colorless Master Mix和带有Barcode的特异引物进行扩增。扩增结束后,将其中等浓度的PCR产物进行混合,混匀后用2%的琼脂糖凝胶电泳检测。QIAquick® PCR Purification Kit试剂盒纯化与回收PCR产物。合格样本基因通过MiSeq上机测序,经质控筛选出的序列按照微生物分类等级定级,最后将序列进行OTU聚类划分(97%的相似度标准)。
1.4 数据分析
本研究数据以Mean ± SD的形式表示。使用IBM SPSS Statistics 20.0软件中的单因素方差分析(ANOVA)或独立样本T检验来确定组间或组内差异的显著性,当P<0.05或P<0.01时,可以判定差异具有统计学意义。使用GraphPad Prism进行图形绘制。
2 结果与讨论
2.1 小米饲料干预对高脂膳食联合STZ诱导糖尿病大鼠肠道菌群多样性的影响
本试验以细菌16S rRNA的V3、V4区(338F_806R)为测序依据,经扩增后共收获193万条序列,8.36 G碱基数据,平均读长达433 bp。所有序列按标准相似度进行聚类划分后共获得810个OTUs,从分类等级角度分析,可分为13个门、22个纲、33个目、58个科和158个属。Rank-Abundance曲线和Shannon-Wiener曲线表明本研究所取样本的物种分布较均匀,测序数据量已足够大。为进一步比较分析各分组样本之间物种多样性的差异,现选取sobs、ace、chao三个指数来衡量群落的丰富度,选取shannon、coverage两个指数来衡量群落的多样性(表2),结果发现小米饲料干预对SD大鼠肠道菌群的物种多样性无显著性影响。

表2 糖尿病大鼠肠道微生物群落丰富度指数与多样性指数Table 2 Indexes for community richness and diversity
2.2 小米饲料干预对高脂膳食联合STZ诱导糖尿病大鼠肠道菌群在门水平的影响
厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidete)是人类肠道中的两大优势菌群,累积占比高达90%以上。相比于人类菌群的结构组成,鼠类肠道中拟杆菌门的相对丰度会显著减少,而厚壁菌门和疣微菌门的相对丰度会显著增加[6],本试验结果与上述结论一致。如图1所示,SD大鼠的肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidete)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)构成,其中厚壁菌门的相对丰度高达83.9%,是优势菌群。Larsen等的研究发现,Ⅱ型糖尿病患者与正常人群相比,其体内的厚壁菌门比例显著降低,拟杆菌门比例显著升高,且厚壁菌门与拟杆菌门比值与血糖浓度显著负相关[14]。目前,长期食用全谷物食品可有效降低血糖的营养观念已渐渐深入人心,Martínez等发现摄入全谷物食品可使厚壁菌门与拟杆菌门比值显著提高[15]。从门水平纵向分析小米饲料对糖尿病大鼠肠道菌群组成的影响,可发现摄食小米饲料的患病大鼠肠道内厚壁菌门所占比例呈上升趋势,而拟杆菌门所占比例则呈下降趋势,即拟杆菌门与厚壁菌门的比值在减小,这意味着小米饲料可在一定程度上改善Ⅱ型糖尿病大鼠体内肠道菌群紊乱的状态,继而使大鼠肠道微生物组成不断向正常大鼠靠拢。
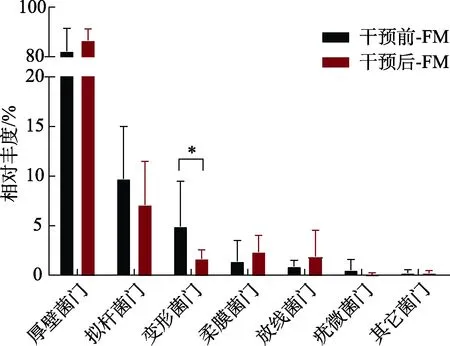
图1 小米饲料干预对糖尿病大鼠肠道微生物在门水平的影响Fig.1 Effect of foxtail millet intervention on relative abundance of gut microbial in phylum level of high-fat diet and STZ-induced diabetic rats
2.3 小米饲料干预对高脂膳食联合STZ诱导糖尿病大鼠肠道菌群在纲目科水平的影响
从纲水平进行比较(图2左),梭菌纲显然是糖尿病大鼠肠道中的优势菌群,占有重要比例,其相对丰度较高,其次是拟杆菌纲和芽孢杆菌纲。糖尿病大鼠连续4周摄食小米饲料后,肠道内梭菌纲和拟杆菌纲所占比列降低,芽孢杆菌纲所占比例上升。此外,α-变形菌纲、β-变形菌纲以及δ-变形菌纲相对丰度减少,这与门水平变形菌门相对丰度减少一致。
从目水平进行比较(图2中),梭菌目是糖尿病大鼠肠道中的优势菌群,同样占有重要比例,其次是拟杆菌目和乳杆菌目。糖尿病大鼠连续4周摄食小米饲料后,肠道内梭菌目和拟杆菌目所占比列降低,乳杆菌目所占比例上升。此外,脱硫弧菌目、伯克霍尔德氏菌目和脱铁杆菌目的相对丰度均减少。
从科水平进行比较(图2右),瘤胃球菌科与毛螺菌科均为糖尿病大鼠肠道内的优势菌群,两者所占比例大致相同。糖尿病大鼠连续4周摄食小米饲料后,肠道内瘤胃球菌科所占比例无明显变化,毛螺菌科所占比例降低,乳杆菌科所占比例上升。此外,拟杆菌科、脱硫弧菌科以及产碱杆菌科的相对丰度均减小。

图2 小米饲料干预对糖尿病大鼠肠道微生物在纲、目、科水平的影响Fig.2 Effect of foxtail millet intervention on relative abundance of gut microbial in class level,order level and family level of high-fat diet and STZ-induced diabetic rats
2.4 小米饲料干预对高脂膳食联合STZ诱导糖尿病大鼠肠道菌群在属水平的影响
依据肠道细菌分类等级,属不仅是肠道微生物对机体产生实际功能作用的单元,同时也是16s RNA高通量测序技术能够准确鉴定的最小单元。从属水平分析,正常小鼠肠道菌群主要由乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus_2)、未分类Lachnospiraceae、别样棒菌(Allobaculum)、布劳特氏菌属(Blautia)等组成。与NC组大鼠相比,DC组大鼠未分类Lachnospiraceae和未分类Verrucomicrobiaceae显著增加,拟杆菌科的norank-Bacteroidales-S24-7-group与瘤胃球菌属(Ruminococcus_2)极显著减少。此外,NC组大鼠肠道内乳杆菌属(约13.9%)明显高于DC组大鼠(3.2%),布劳特氏菌属(NC组约3.6%)明显低于DC组(6.6%),但由于显著性水平易受样本间肠道微生物波动的影响,并未达到显著性差异统计水平。如图3所示,纵向分析比较高脂膳食联合STZ诱导糖尿病大鼠连续4周摄食小米饲料前后体内肠道菌群在属水平上物种相对丰度的差异,可发现干预4周后糖尿病大鼠肠道内布劳特氏菌属显著减少,而乳杆菌属和瘤胃球菌属(Ruminococcus_2)显著增加。如图4所示,为使小米饲料能有助于改善糖尿病大鼠肠道菌群的结论更具科学性,进一步排除糖尿病大鼠自我修复调节的可能性,所以将小米饲料干预末期的Ⅱ型糖尿病大鼠(干预后-FM)与模型组糖尿病大鼠(干预后-DC)肠道菌群在属水平上物种相对丰度的差异进行横向分析。结果发现,相比于干预后-DC 组,干预后-FM组大鼠肠道内的乳杆菌属和瘤胃球菌属(Ruminococcus_2)显著提高,而别样棒菌属和未分类Lachnospiraceae显著减少。

图3 小米饲料干预前后糖尿病大鼠肠道微生物在属水平的差异比较Fig.3 The difference comparation of gut microbial between Before-FM and After-FM in genus level of high-fat diet and STZ-induced diabetic rats
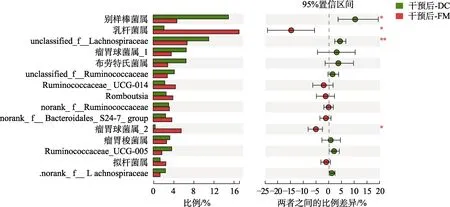
图4 小米饲料干预结束后糖尿病大鼠肠道微生物在属水平的差异比较Fig.4 The difference comparation of gut microbial between After -DC and After-FM in genus level of high-fat diet and STZ-induced diabetic rats
应用Spearman相关性分析各菌属与空腹血糖(FG)、糖耐量后2 h血糖(2h-G)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)之间的相关性,结果如图5所示。由图可知,瘤胃球菌属(Ruminococcus_2)与FG呈极显著负相关关系(r=-0.806,P<0.01),与2h-G(r=-0.644,P<0.05=和TG(r=-0.709,P<0.05=呈显著负相关关系。乳酸杆菌与TG(r=-0.758,P<0.05)呈显著负相关关系,与TC(r=0.661,P<0.05)和HDL-C(r=0.685,P<0.05)呈显著正相关关系。别样棒菌属与2h-G(r=-0.65,P<0.05=和TG(r=-0.661,P<0.05)均呈显著负相关关系。布劳特氏菌属、未分类毛螺菌科均与TG呈显著正相关关系,与HDL-C呈显著负相关关系。相对丰度较低的Lachnoclostridium、厌氧球菌属和嗜胆菌属均与TG呈显著正相关关系,与TC、HDL-C呈显著负相关关系。

图5 属水平上丰度排名前30的细菌与血糖血脂的相关性分析Fig.5 The Spearman correlation analysis between the 30 most abundant genera of gut microbial in genus level and blood glucose and blood lipid
乳酸杆菌作为肠道有益菌参与人体免疫调节和维持机体健康状态的作用早已成为共识[16]。现已证明,许多急慢性疾病与肠道内乳酸杆菌的联系十分密切,如高血脂、结肠炎、肥胖、机体炎症反应、Ⅱ型糖尿病等[17]。例如Lactobacillus plantarumX1、LactobacillusrhamnosusGG和LactobacillusreuteriGMNL-263这三种不同类型的乳酸杆菌,虽都是有益菌,但功能各不相同,Lactobacillus plantarumX1能够刺激胰岛素分泌和抑制α-葡萄糖苷酶的活性[18],而Lactobacillus rhamnosusGG则通过增加血清中的脂联素间接缓解胰岛素抵抗[19],LactobacillusreuteriGMNL-263能够增加脂肪组织中 PPAR-γ和 GLUT4 的表达能力、加速肝脏脂肪的消耗,从而达到改善血糖代谢的目的[20]。由于纵向比较和横向比较在乳酸杆菌相对丰度上的结果保持一致,即After-FM组显著高于After-DC组和Before-FM组,从而推测小米饲料降血糖的功效可能是通过增加肠道内乳酸杆菌的相对丰度来实现的,Zhang等[21]的研究结果也佐证了这一猜测。另外,在本试验相关性结果中显示乳酸杆菌与血清中的TG、HDL-C两个指标显著相关,再结合高血脂模型大鼠中LactobacillusplantarumNCU116的作用可推测其发挥降血脂作用的途径可能是提高血清中HDLC的水平或降低血清中TG的水平[22]。
瘤胃球菌属是革兰氏阳性厌氧细菌,据现阶段研究表明,其主要功能表现在生物降解方面,如降解抗性淀粉和某些纤维物质[23-24]。本研究中糖尿病大鼠肠道内瘤胃球菌属的相对丰度相比于正常对照大鼠而言有所降低,但摄食小米饲料4周后这一变化发生了巨大反转,即干预后大鼠肠道内瘤胃球菌属的相对丰度(1.1%)比干预前大鼠(5.6%)提高了4.5%。现已有许多研究证明抗性淀粉和膳食纤具有降血糖的功效,长期食用可有助于机体血糖代谢的稳步进行,并减小众多慢性代谢疾病的发病率,包括Ⅱ型糖尿病[25]。双歧杆菌和瘤胃球菌属一样也是肠道有益菌,摄食抗性淀粉可有效促进二者在肠道内快速生长繁殖[26-27]。前期研究发现小米中抗性淀粉含量较高[28],这可能是经小米饲料干预后大鼠肠道内瘤胃球菌属相对丰度显著增加和血清中甘油三脂水平降低的主要原因。布劳特氏菌属是肠道内短链脂肪酸的来源之一,其中乙酸最为主要[29]。试验表明布劳特氏菌属在Ⅱ型糖尿病大鼠肠道内的相对丰度高于NC大鼠,且其在肠道内所占比例与血清中的IL-6和糖化血清蛋白水平均呈正相关关系[30],推测经小米饲料干预后其相对丰度降低将更易于血糖代谢的恢复。别样棒菌属是肠道内的一种短链脂肪酸产生菌[31],在本次试验中,可发现此菌的数量会随着糖尿病病情的延续进一步增多,但相比于After-DC组,After-FM组糖尿病大鼠肠道内别样棒菌属的数量显著减少,这说明小米饲料可通过抑制别样棒菌属的生长繁殖,来减轻糖尿病的病情。已有不少文献表明毛螺菌科(Lachnospiraceae)与Ⅱ型糖尿病的关联十分密切[32],在本次试验中毛螺菌科与别样棒菌属的情况较为相似,经4周的小米饲料干预后,相比于DC大鼠,After-FM组大鼠肠道内毛螺菌科相对丰度显著减少,表明小米饲料干预也能够通过减少毛螺菌科的相对丰度来发挥其降血糖的效果。
3 结论
综上所述,SD大鼠的肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门、柔膜菌门、放线菌门和疣微菌门等构成,其中厚壁菌门的相对丰度高达83.9%,是绝对优势菌群。连续4周摄食小米饲料的糖尿病大鼠肠道内拟杆菌门与厚壁菌门的比值减小,表明小米饲料可在一定程度上改善糖尿病大鼠体内肠道菌群紊乱的状态,继而使大鼠肠道微生物组成向着更为健康的方向发展。从属水平分析,正常大鼠肠道内菌群主要由乳酸杆菌、瘤胃球菌属(Ruminococcus_2)、未分类毛螺菌科、别样棒菌属、布劳特氏菌属等组成。相关性分析结果显示,瘤胃球菌属与空腹血糖(r=-0.806,P<0.01)、糖耐量后2h血糖(r=-0.644,P<0.05)呈显著负相关,乳酸杆菌与高密度脂蛋白胆固醇(r=0.685,P<0.05)呈显著正相关。小米饲料干预降糖功效的发挥可能是通过增加糖尿病大鼠肠道内乳酸杆菌和瘤胃球菌属的相对丰度,减少布劳特氏菌属、别样棒菌属和毛螺菌科的相对丰度来实现的。

