miR-28-5p和Nrf2与老年脑动静脉畸形出血的关系
王辰龙 周红 呼群 张瑞云 张海廷 李志方
(1民航总医院神经内科(北京大学民航临床医学院神经内科),北京 100123;2中国人民解放军军事医学科学院)
脑血管动静脉畸形(AVM)是一种先天性脑血管异常结构疾病,多见于中青年人群,但近年在老年人群中发病率呈升高趋势,临床表现为动静脉间形成多量短路,形成曲张的血管团,且管壁厚薄不一,缺乏内弹力纤维层〔1〕。临床表现为颅内出血、癫痫、头痛,自发性颅内出血是AVM的主要风险,平均出血率为50%~70%,可导致严重的神经功能障碍乃至死亡,因此需要积极的治疗〔2〕。研究发现,脑AVM出血与多种因素有关,有出血倾向的AVM具有一些基本特征,血管病变厚度变薄是主要危险因素〔3,4〕。血管病变与内皮细胞生长关系密切,miR-28-5p在细胞的增生、分化、凋亡、基因表达等方面起重要作用,可参与细胞的凋亡和诱导炎性细胞因子的产生,在动脉平滑肌细胞上,其高表达与细胞因子的产生呈正反馈关系〔5〕。研究证明miR-28-5p在肺、结肠癌细胞及胶质瘤细胞中呈低表达〔6〕。也有研究表明miR-28-5p在遗传性出血性毛细血管扩张症(HHT)患者中显著下调,而HHT患者可发展为血管不典型增生,称为毛细血管扩张和AVM〔7〕。但miR-28-5p在AVM中是否低表达及与出血是否存在关系还无相关研究报道。核因子无相关因子(Nrf2)通路是内源性抗氧化系统的核心调控枢纽,通过一系列抗氧化剂保护蛋白编码,促进细胞内氧化还原环境的条件调节〔8〕。血管通透性增加可导致许多疾病相关的血管并发症发生,活性氧(ROS)的过度生成或抗氧化能力的降低可导致内皮功能障碍,作为过量ROS的平衡物,Nrf2作为一种氧化还原敏感的细胞保护性转录因子,将成为抗氧化防御的潜在治疗靶点〔9〕。本文探究miR-28-5p 与Nrf2在老年AVM中的表达并分析其与出血的关系。
1 资料与方法
1.1一般资料 收集2016年2月至2018年2月民航总医院就诊的脑血管AVM未出血患者32例为血管畸形组,年龄60~79岁。Spetzler&Martin分级Ⅰ级7例,Ⅱ级11例,Ⅲ级10例,Ⅳ级4例。收集AVM出血患者25例为出血组,年龄60~80岁。Ⅰ级6例,Ⅱ级6例,Ⅲ级9例,Ⅳ级4例。另选取健康体检者30例为健康组,年龄59~78岁。癫痫患者27例为癫痫组。收集AVM出血组织3例,AVM患者的畸形血管团6例,癫痫患者的颞浅静脉2例。纳入标准:(1)经CT、DSA、MRI检查确诊为脑血管AVM,(2)无高血压及其他心脑血管疾病或重大疾病;(3)出血患者经治疗后病情稳定。排除临床资料不全,患有其他严重疾病患者。参与研究者均签署知情同意书,研究通过伦理委员会批准,4组性别、年龄、体重指数(BMI)、病情分级方面无明显差异。见表1。
1.2仪器与试剂 荧光检测试剂实时荧光定量聚合酶链式反应(RT-PCR,Promega公司,美国),miR-28-5p NRf2、内参GAPDH扩增引物(Biosail公司、加拿大)、9700RT-PCR仪(ABI公司,美国)。
1.3研究方法 (1)每3个月测定一次各组外周血miR-28-5p 与Nrf2的mRNA含量,研究期间新出现出血情况患者待治疗稳定后重新检测,计算中间值,高于等于中间值为强表达,低于中间值为弱表达。(2)随访2年,经CT、数字减影血管造影(DSA)、磁共振成像(MRI)复查,统计AVM患者出血情况并进行检测,术后检测在1 w内完成。
1.4脑AVM内皮细胞分离和鉴定 将手术切除的脑 AVM 血管浸入含庆大霉素、两性霉素 B 及链霉素青霉素的磷酸盐缓冲液(PBS)中,转移至实验室。在超净台仔细清除多余血管组织,显微镜下用眼科剪剪除血管外膜,PBS反复冲洗血管腔,至冲洗液中无肉眼可见的红细胞及血管腔内壁发白。用1 ml 注射器抽取 0.2%胶原酶Ⅰ200 μl,向血管内注入,使血管腔内充满胶原酶,37℃孵育10 min。含 20%血清的 MCDB131 培养液冲洗管腔2次并收集灌洗液,保证灌洗液完全排出。1 500 r/min离心5 min,倒掉上清液加入 EGMTM-2 培养基重悬细胞。接种于 24 孔培养板,将培养板置于5% CO237℃培养箱孵育 24 h内勿动培养瓶使细胞静止生长。将剩余血管用眼科剪剪碎,0.2%胶原酶Ⅰ500 μl,37℃ 孵育10 min。用含20% 血清的 MCDB131 培养液终止胶原酶消化。用 45 μm 细胞筛过滤,收集滤液。1 500 r/min离心5 min,倒掉上清液加入 EGMTM-2 培养。对培养基重悬细胞,接种于 24 孔培养板中,将培养板置于5% CO237℃培养箱孵育 24 h后换液,以后每隔 2 天换液 1 次。出血、癫痫患者颞浅静脉原代培养方法同脑AVM。将分离出来的各组细胞进行流式细胞术分选后得到所需内皮细胞。
1.5细胞培养与处理 将各组细胞复苏后,在EGMTM-2 培养在37℃ 5%CO2的培养箱中孵育24 h,分别将细胞分为:健康组、癫痫组、血管畸形组、出血组、癫痫+Brustaol(Nrf2抑制剂)组、血管畸形+Brustaol组、出血+Brustaol组。按比例加入相应体积的药物进行处理,混匀后在培养箱中培养24 h。
1.6采用RT-PCR法测定患者外周血及各组细胞中miR-28-5p的表达 分别采集血管畸形组、出血组治疗后1 d、健康组空腹时静脉血3~5 ml,抗凝处理,放入7 000 r/min离心机,离心1 min,沉淀分离细胞核;分别将分组细胞7 000 r/min离心1 min,分离细胞核。常规用Trizol提取单个细胞核总RNA,按说明书逆转录成cDNA,进行荧光检测。PCR体系为2倍的GoTaq qPCR、样本cDNA 0.2 μg、蒸馏水,建立40 μl的反应体系。反应条件为96℃ 2 min,96℃ 20 s,55℃ 15 s,72℃ 40 s 连续40个循环。“Ct值倒数”法计算样本cDNA相对含量,即目的基因 cDNA相对含量=目的基因 Ct值倒数/GAPDH Ct值倒数。
1.7采用Western印迹检测外周血及各组细胞中Nrf2蛋白表达水平 采用放射免疫沉淀(RIPA)裂解缓冲液(Beyotime)加上蛋白酶抑制剂(PMSF)(Yeason,中国上海)提取总蛋白。用二喹啉甲酸(BCA)测定蛋白质含量。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白质,然后转移到聚偏氟乙烯(PVDF)膜上。用5%牛血清白蛋白封闭60 min后,用小鼠抗人单克隆Nrf2和GAPDH(1∶10 000,ab8245,Abcam)在4℃下过夜。然后将膜暴露在二抗体中60 min。用电化学发光(ECL)-Plus印迹试剂盒孵育条带,并用成像系统(中国上海塔农)进行分析。
1.8评价标准 Spetzler-Martin分级标准:病灶体积:0.0~3.0 cm为1分,3.1~6.0 cm为2分,>6.0 cm为3分;位置:位于语言区为1分,非语言取0分;深静脉引流:有1分,无0分。以上3项之和为总分1~5分,分级Ⅰ~Ⅴ级。
1.9统计学方法 采用SPSS19.0软件进行独立样本t、χ2检验。
2 结 果
2.14组miR-28-5p、Mrf2表达差异 健康组、癫痫组、血管畸形组、出血组外周血中miR-28-5p依次呈显著低表达(P<0.05);Nrf2蛋白依次呈高表达,差异具有统计学意义(P<0.05)。见表1,图1。
2.2AVM不同病情分级miR-28-5p 与Nrf2蛋白表达 57例AVM患者中,不同病情分级对应的miR-28-5p 表达均随着病情分级增加表达减弱,Nrf2蛋白表达随着病情分级增加表达增强,不同分级之间比较差异具有统计学意义(P<0.05)。见表2,图2。
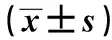
表1 4组一般资料及外周血miR-28-5p 、Nrf2表达比较
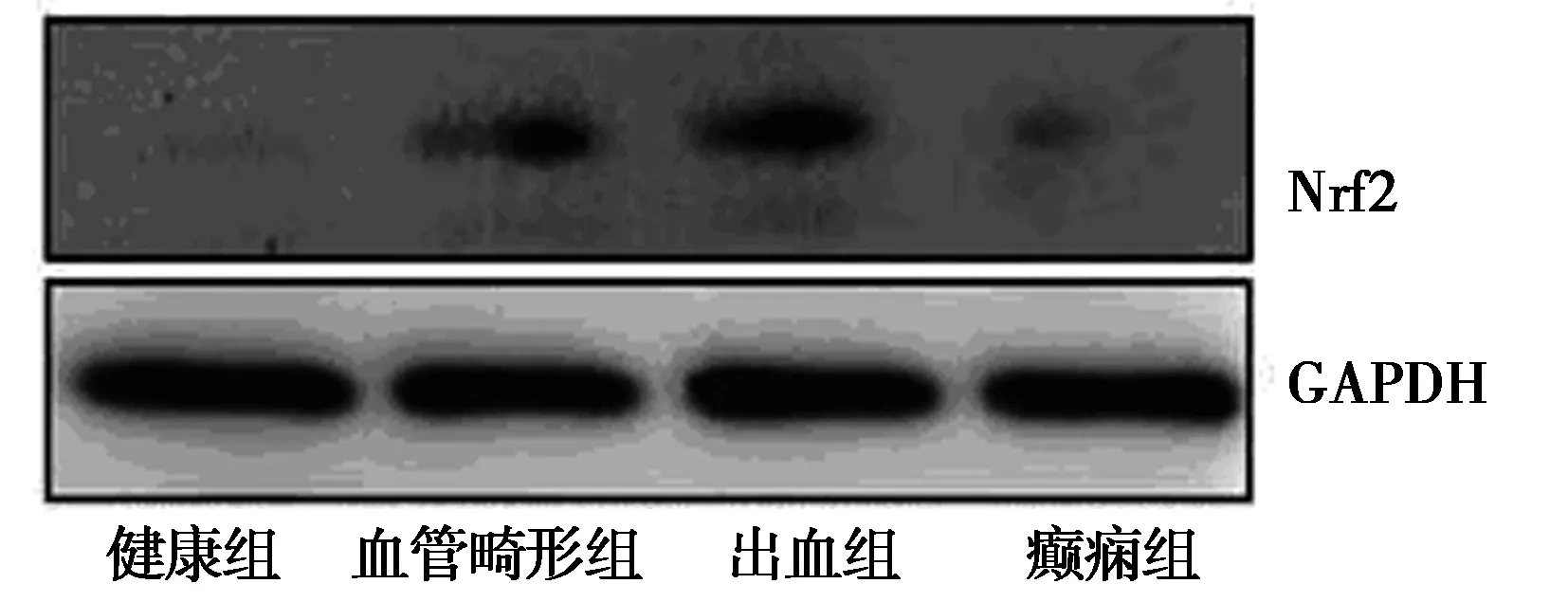
图1 各组外周血Nrf2 蛋白表达
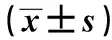
表2 AVM不同病情分级miR-28-5p与Nrf2表达
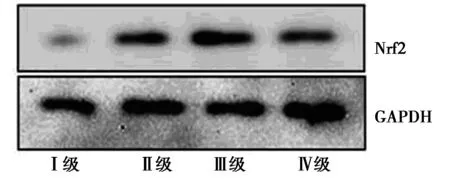
图2 不同病情分级Nrf2 蛋白表达
2.3相关性 病情分级(r=-0.435,P=0.002)、出血(r=-0.651,P=0.000)与miR-28-5p呈负相关,与Nrf2蛋白表达呈正相关(r=0.806、0.752,均P=0.000)。
2.4出血风险与miR-28-5p与Nrf2表达的危险因素cox回归分析 血管畸形组随访期14例出现出血症状,单因素回归分析显示出血危险与miR-28-5p 弱表达相关(P<0.05),与Nrf2强表达相关(P<0.05),见表3。
2.5miR-28-5p与Nrf2 相关性及诊断AVM敏感性 脑AVM患者miR-28-5p与Nrf2呈负相关(r=-0.518,P=0.035 7),受试者工作特征(ROC)曲线表明,miR-28-5p水平可用于筛查脑AVM,曲线下面积为0.916 3(图3)。
2.6使用Nrf2抑制剂后各组miR-28-5p的表达水平 健康组miR-28-5p表达水平为0.23±0.08。血管畸形+Brustaol组、出血+Brustaol组、癫痫+Brustao组miR-28-5p表达水平(0.75±0.13、1.36±0.15、0.62±0.10)较血管畸形组、出血组、癫痫组(0.31±0.09、0.64±0.13、0.29±0.06)显著提高(均P<0.05)。

表3 血管畸形组脑出血危险单因素cox回归分析
3 讨 论
出血是AVM最严重的并发症,多发生在脑内,而老年人因身体功能和耐受力下降,动脉畸形出血率较高,危害性大〔10~12〕。出血型AVM的病理研究显示电镜下可见血管内皮细胞坏死脱落,内膜和中膜变性,平滑肌细胞坏死崩解,内弹力层破坏厚薄不均,存在断裂的情况。对AVM的超微病理进行研究发现,AVM血管壁的病理改变主要为血管内膜的变化,强调血管内皮细胞对内弹力层具有营养和保护作用〔13〕。miR-28-5p 和Nrf2是可影响血管内皮细胞生长的相关因子,且与心血管疾病关系密切〔14,15〕。
miRNA 表达具有高度的组织特异性、保守性及发育阶段特异性,miRNA在血液中检测与机体疾病具有一定相关性,可作为一些疾病的标志物〔16〕。特别是miR-28-5p 的表达和炎症因子的表达呈负相关,其表达的下调能够激活核因子(NF)-κB信号通路,可促进炎症因子的表达〔17〕。研究通过对高血压脑出血患者外周血单个细胞核检测发现miR-28-5p mRNA 呈现低表达,表达程度与出血正相关;大鼠局灶性脑缺血再灌注后miR-28-5p 表达降低,在出血周围组织中呈阳性表达〔18〕。本研究提示miR-28-5p 在AVM病情中发挥重要作用,在出血组低表达可能是由于出血后形成的血肿周围存在一个组织损伤刺激产生炎症反应,miR-28-5p 在细胞炎症反应中同样发挥重要作用,AVM的病情是一个持续发展的过程,推测AVM患者血管内皮细胞的病理损伤是导致了miR-28-5p 的表达升高的原因。
Nrf2是调节细胞抗氧化应激反应的重要转录因子,可介导的抗氧化应激,抗炎症,抗凋亡是细胞抵抗外界不良环境〔19〕。ROS在血管稳态调控中有重要性,过量的ROS可导致细胞功能障碍和细胞死亡。正常情况下细胞质中Nrf2浓度低,氧化应激时Nrf2转位到细胞核,引发抗氧化酶,抗炎症基因等内源性保护基因的转录,抵抗氧化作用保护组织免受伤害〔20,21〕。针对兔的蛛网膜出血的Nrf2研究显示,出血组织中Nrf2表达增加,且阳性表达集中在血管内皮细胞及平滑肌细胞〔22〕。本研究提示Nrf2在AVM出血中发挥一定作用,推测脑出血导致大量ROS释放,Nrf2通路被激活,表达增强,激活下游抗氧化酶,能有效减轻继发性脑损伤,且出血部位的炎症反应同时激活了Nrf2诱导抗炎反应的功能。AVM患者由于先天发育不良、血管生长畸形,研究显示AVM基因型最显著的特点就是血管内皮生长因子(VEGF)的mRNA及蛋白水平均较正常呈高表达状态〔23〕,促进AVM的生长过程中新生血管的增长,也导致了AVM生长阶段miR-28-5p和Nrf2的表达增强〔24,25〕。AVM临床分级复杂,存在多种标准,Spetzler&Martin分级是应用广泛的分级标准之一,临床上可根据AVM分级判断病情制定相应的治疗方案预测手术风险,级别越高,手术并发症越高〔26〕。本研究中,不同病情分级、出血与miR-28-5p呈负相关,与Nrf2呈正相关。分析原因可能是由于AVM分级越高AVM病灶越大,新生血管生长活动越发活跃,导致了Nrf2的表达增强和miR-28-5p 减弱。体外研究提示miR-28-5p与Nrf2呈负相关。AVM的治疗采用显微手术为主,也存在药物血管内治疗,放射疗法等以实现阻塞血管为目的的治疗手段,但由于治疗效果可控性差,并发症难以控制,应用较少〔27,28〕。根据miR-28-5p 和Nrf2在AVM中的表达可设想通过抑制miR-28-5p 和Nrf2表达实现抑制AVM生长的目的,尤其对老年患者保守治疗具有很高价值。
综上,miR-28-5p 和Nrf2在老年脑AVM患者中呈现高表达,与临床分级正相关,是临床出血并发症的危险因素,本研究由于样本量较少,可能存在一定的偏倚,可通过动物实验进一步验证结论,为老年AVM患者治疗提供指导。

