基于Sonazoid超声造影枯否期图像预测肝细胞肝癌微血管侵犯的影像组学研究
左 丹 曹佳颖 邱艺杰 王含章 田晓梵 王文平 董 怡
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的肝脏原发性恶性肿瘤,约占肝恶性肿瘤的85%,外科手术是最理想的根治性治疗手段,然而80%的HCC 患者在术后3~5年内出现复发[1]。微血管侵犯(microvascular invasion,MVI)是HCC 术后早期复发及远处转移的独立危险因素,与患者总体生存率及无进展生存期密切相关[2]。MVI 也称微血管癌栓,是指显微镜下在癌旁肝组织微血管腔内见到癌细胞巢团[3],目前尚无有效的术前影像学预测手段,仅能根据术后标本的病理结果进行判断。超声造影(contrastenhanced ultrasound,CEUS)作为一项安全、无创的影像学检查方法,可以敏感地显示病灶内微循环血流灌注,已广泛应用于HCC 的临床诊治[4]。Sonazoid 是一种肝脏特异性超声造影剂,其特有的枯否期(血管后期)通过巨噬细胞特异性的吞噬作用,实现了HCC 的特异性成像及诊断[5]。影像组学通过对超声影像的高通量信息挖掘、深度学习及量化分析,常用于肿瘤的精准诊断及疗效评估,是近年来国内外研究的热点[6-9]。本研究通过构建基于Sonazoid CEUS 枯否期图像的影像组学预测模型,旨在探讨其在术前预测HCC病灶MVI的应用价值。
资料与方法
一、研究对象
前瞻性纳入2021年4~8月我院拟诊为肝恶性肿瘤且拟行手术治疗的患者。纳入标准:①年龄>18 岁,能配合CEUS 检查;②拟诊为肝恶性肿瘤,拟于我院肝外科接受手术治疗;③术前1 周于我院超声科行肝脏常规超声及Sonazoid CEUS 检查;④既往未接受其他治疗,包括放疗、化疗、靶向治疗及介入治疗等。排除标准:①接受过手术治疗;②最终手术病理结果显示非HCC;③肝脏占位在灰阶条件或造影条件下显示不清;④肝内多发病灶;⑤病灶最大径>5 cm;⑥无法在一帧超声图像上同时显示完整病灶及病灶周围5 mm 的正常肝实质;⑦患者要求退出研究。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.超声检查:使用西门子Acuson Sequoia彩色多普勒超声诊断仪,5C-1 腹部探头,频率1~6 MHz。造影剂使用Sonazoid(GE 医疗集团),使用前每支冻干剂加入2.0 ml生理盐水振荡配置成混悬液备用。首先行灰阶超声观察病灶位置、大小、形态、边缘及内部回声特征,CDFI观察病灶内血流情况。然后将探头保持在能清晰显示病灶及其周围5 mm肝实质的最佳切面,切换至超声造影模式,嘱患者平静呼吸,经肘正中静脉团注造影剂混悬液0.5 ml,随后立即用5.0 ml 生理盐水冲管,连续观察造影剂在病灶动脉期、门脉期、延迟期及枯否期的增强、消退表现,并留存连续2 min 的动态图像及枯否期的静态图像。以上操作均由具有5年及以上肝脏CEUS检查经验的超声医师完成。
2.临床资料获取:记录所有患者的基本信息及术前肿瘤标记物水平,包括性别、年龄和血清甲胎蛋白、癌胚抗原、糖类抗原19-9、甲胎蛋白异质体、异常凝血酶原、微小核糖核酸水平。
3.术后随访:随访所有患者的病理结果,记录HCC病灶的MVI情况。根据2015年《原发性肝癌规范化病理诊断指南》标准[3],即显微镜下是否于癌周微血管腔内观察到癌细胞巢团,将病灶分为MVI 阴性(未见癌细胞巢团)和MVI 阳性(见癌细胞巢团,无论数量及出现范围)。
三、构建基于Sonazoid CEUS 枯否期图像的影像组学模型
1.标注感兴趣区(ROI):将储存的Sonazoid CEUS图像导入3D-Slicer 软件(版本:Slicer-4.11.20200930,slicer.)进行ROI 标注。将ROI 覆盖整个肿瘤,在灰阶超声图像及CEUS 枯否期图像上对病灶进行勾画。病灶周围5 mm 区域由Slicer 软件ROI 外扩功能生成,最终ROI 来自灰阶超声图像及枯否期图像的肿瘤区域(TR)、瘤周5 mm 区域(PR)及肿瘤+瘤周5 mm 区域(ER),分别以灰阶TR、灰阶PR、灰阶ER、枯否期TR、枯否期PR和枯否期ER表示,见图1。对于外扩后ROI覆盖的非肝脏部位区域进行手动删除。以上操作均由两名具有5 年及以上肝脏CEUS 检查经验的超声医师完成。
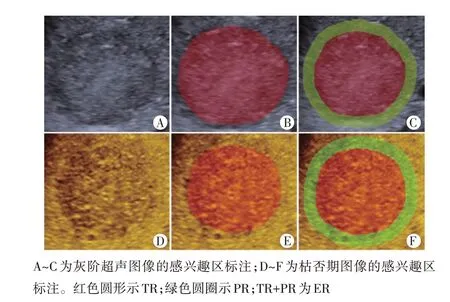
图1 感兴趣区标注示意图
2.提取及筛选影像组学特征:将ROI 内的超声图像转为灰度图,并以2 为组距对灰度值进行离散化。依据图像生物标志物标准化倡议,分别从灰阶超声图像及枯否期图像的TR、PR 及ER 提取形态学、一阶直方图和二阶纹理学影像组学特征。高阶影像组学特征包括高斯拉普拉斯特征、小波变换特征及局部二值特征,由对原始灰阶图像相应特征变换后的衍生图像计算得出。在初始标注1 个月后,由其中一名超声医师对随机选取的10 例患者图像再次进行ROI 标注。通过计算两名医师分别标注的ROI及同一医师在不同时间标注的ROI所提取的影像组学特征的组内相关系数(ICC)及一致性相关系数(CCC),确定并排除不稳定的影像组学特征(ICC<0.75 或CCC<0.90)。以病理结果为金标准,采用单变量逻辑回归再次筛选特征,最后通过最大相关最小冗余算法和LASSO 正则回归筛选出具有预测效力的候选特征。
3.构建模型:将上述筛选出的候选特征通过向后逐步回归法筛选出的6 个区域最具预测价值的特征,通过支持向量机法分别构建6个影像组学模型。通过影像组学模型计算出每例患者的风险概率,视为影像组学评分,评分越接近1,代表该患者MVI 风险更高。然后筛选出在MVI 阴性和MVI 阳性病例中差异有统计学意义且在单因素Logistic 回归中为独立预测变量的临床信息和影像组学评分,通过多因素Logistic回归构建临床影像组学模型。
四、统计学处理
应用Python 3.8 统计软件,缺失或离群值均用群体均值替代。连续性变量的正态性检验采用Shapiro-Wilk检验法,符合正态分布的连续性变量以±s表示,非正态分布的连续性变量以M(Q1,Q3)表示;分类变量以频数或百分比表示。95%可信区间由1000 次自举法重采样得出。模型的效能评估采用留一交互验证法。绘制受试者工作特征(ROC)曲线评估各模型预测HCC 病灶MVI 的效能,曲线下面积比较采用Delong 检验。采用决策曲线评估各模型的临床收益。所有单因素统计学检验中双边P<0.05 为差异有统计学意义,多变量Logistic 回归中P<0.1 为差异有统计学意义。
结果
一、纳入患者临床资料
最终共50例患者纳入研究,均经手术病理证实为单发HCC,其中男41 例,女9 例,年龄28~83 岁,平均(57.62±11.77)岁,甲胎蛋白为8.20(3.10,105.42)ng/ml,癌胚抗原为1.85(1.40,2.90)ng/ml,糖类抗原19-9 为12.75(8.20,17.70)ng/ml,甲 胎 蛋 白 异 质 体 为7.40(0.55,35.62)%,异 常 凝 血 酶 原 为107.50(30.25,1792.25)mAU/ml,微小核糖核酸阳性38例、阴性12例,MVI阳性31例、MVI阴性19例。
二、各影像组学模型的预测效能比较
从灰阶超声图像和枯否期图像的TR、PR 及ER 中各提取1125个影像组学特征,分别剔除239、154、169、382、197和409个不稳定特征。通过进一步筛选,最终筛选出5 个最具预测效力的影像组学特征,分别构建基于灰阶TR、灰阶PR、灰阶ER、枯否期TR、枯否期PR和枯否期ER特征的影像组学模型。
6 个影像组学模型中,以枯否期PR 影像组学模型对MVI 的独立预测效能最佳,其ROC 曲线下面积为0.834,准确率为84.0%,敏感性为90.3%,特异性为73.7%。见表1和图2。

图2 各影像组学模型预测MVI的ROC曲线图
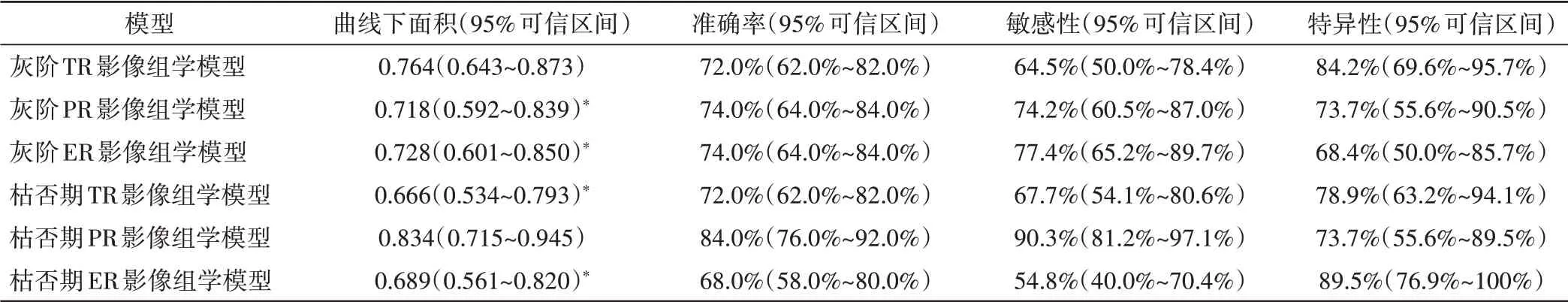
表1 各影像组学模型对MVI的预测效能比较
三、各临床影像组学模型的预测效能比较
1.单因素Logistic 回归分析显示,所有影像组学评分均与MVI 病理结果显著相关。纳入所有预测变量的多因素Logistic 回归分析显示,仅枯否期PR 影像组学评分为MVI的独立预测因素。见表2,3。
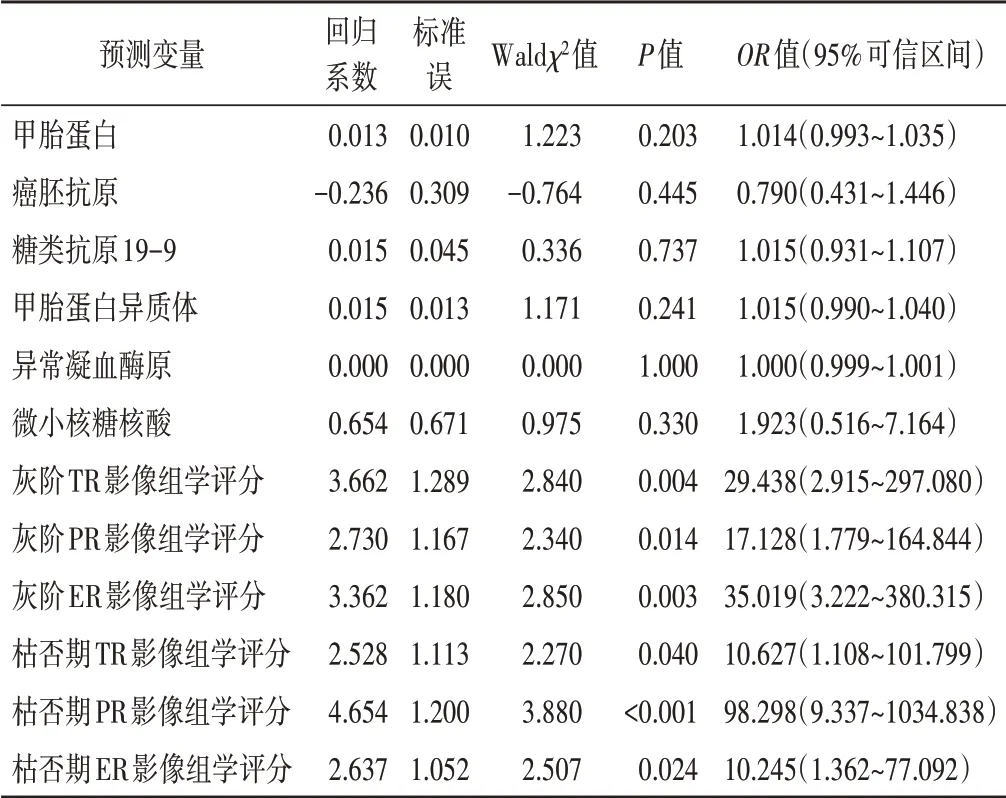
表2 风险变量单因素Logistic回归分析

表3 风险变量多因素Logistic回归分析
2.决策曲线分析显示,当模型预测MVI 概率阈值为0.05~0.85 时,枯否期PR 影像组学评分较其他影像组学评分能够提供更高的临床收益。见图3。
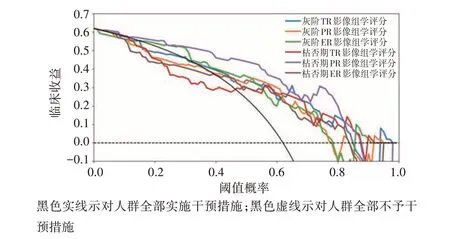
图3 临床模型与临床影像组学模型决策曲线图
讨论
MVI 是目前公认的与HCC 复发及预后直接相关的危险因素。以往研究[2,8,10-11]应用CT 或MRI 影像特征来预测HCC 病灶是否伴有MVI,结果显示HCC 病灶包膜不完整、边界不清、动脉期边缘强化或包膜强化、肝胆特异期肿瘤周围低增强均为MVI 阳性的高危因素。但CT和MRI仅通过间接的影像特征来预测MVI,且CT检查具有放射性,MRI检查价格昂贵,造影剂通过肾脏代谢且容易出现造影剂过敏反应等,临床应用局限。
影像组学通过提取图像中与形状、像素强度分布和纹理特征等相关的信息,能定量反映肿瘤的异质性。近年来,基于术前预测HCC 病灶MVI的影像组学研究主要基于CT 及MRI图像,敏感性为75%~81%,特异性79%~92%,其中肿瘤大小和肿瘤内异质性相关的特征预测术前MVI 的价值最高[6,12-13]。不同增强时期影像组学模型的预测效能不同,在CT 检查中,门脉期影像组学模型表现优于动脉期和延迟期;而在MRI 检查中,基于动脉期的影像组学模型预测效能最高[6,12-13]。但CT 或MRI 影像组学分析仅基于静态图像,图像切面单一且无法提供病灶增强的连续过程。而超声检查具有无创、实时、多切面成像的优势,检查者可以根据病灶特征,选取最佳切面显示病灶,经过影像组学进行特征提取,较CT或MRI能提供更多的信息。本课题组前期研究[10]发现,基于灰阶超声图像的影像组学模型预测HCC 病灶MVI 的准确率约70%。而基于超声原始射频信号的影像组学模型由于不受仪器、检查者等因素的干扰,其预测MVI 的准确率、敏感性和特异性分别为92.86%、85.71%和100%[14]。
CEUS 能实时、连续地显示病灶的增强及消退特征,同时能提供病灶内部及周围微循环血流灌注信息,对肝脏疾病的诊断具有重要价值。本课题组前期研究[9]显示,应用比较动态超声造影特征及定量参数的差异,有助于预测HCC 病灶是否出现MVI。结合临床因素的预测模型能显著提高预测效能,同时相较于动脉期的影像组学特征,基于门脉期及延迟期的影像组学特征在预测MVI 中具有更重要的价值[15]。Sonazoid 是新型的肝脏特异性超声造影剂,其主要成分为全氟丁烷微泡,肝内的枯否细胞通过特异性地摄取在枯否期呈高增强,而恶性肿瘤组织由于不含枯否细胞,在枯否期表现为低回声增强,故Sonazoid CEUS的枯否期能提供更多的与枯否细胞相关的特异性诊断信息。本研究从灰阶超声图像和Sonazoid CEUS 枯否期图像中提取特征,对TR、PR 及ER 分别进行影像组学建模,结果显示枯否期PR 影像组学模型与病理确诊的MVI 显著相关,其预测MVI 的曲线下面积为0.834,均高于其他影像组学模型(均P<0.05)。分析原因可能与MVI 主要发生在HCC 病灶周围相关[3,9-10,14]。既往研究[7]发现基于HCC 肿瘤区域与瘤周区域影像特征建立的影像组学模型具有相当的效能,但在勾画肿瘤ROI 区时较实际肿瘤区域稍大,因此导致基于肿瘤ROI区外扩的瘤周区域影像特征构建的影像组学模型预测效能较肿瘤区域的预测效能稍差。本研究发现当模型预测MVI的阈值概率为0.05~0.85时,枯否期PR 影像组学评分较其他影像组学评分能够提供更高的临床收益,表明基于Sonazoid CEUS 枯否期PR 影像组学模型预测效能较其他影像组学模型表现更好。
综上所述,基于Sonazoid CEUS枯否期图像的影像组学模型为术前无创预测HCC 病灶MVI 提供了新的方法,其中基于枯否期PR 影像组学特征构建的预测模型效能最佳。

