单硬脂酸甘油酯对酪蛋白再制稀奶油乳化稳定性的影响
李 扬,李 妍,李 栋,张列兵*,卢 俭,杜学贤,吴迎乐
(1.中国农业大学工学院,北京 100083;2.北京工商大学食品与健康学院,北京 100048;3.中国农业大学食品科学与营养工程学院,北京 100083;4.宁夏塞尚乳业有限公司,宁夏 银川 750200)
再制稀奶油(recombined dairy creams,RDCs)是将乳脂、蛋白及乳化剂等配料按一定比例复配后制备的水包油乳液,与天然稀奶油相比,RDCs的品质尤其是乳化稳定性较差,因而RDCs稳定性是乳品工业研究的热点之一。课题组前期研究发现,仅使用酪蛋白不足以稳定稀奶油,因此选择小分子乳化剂与酪蛋白共同制备稀奶油以调整其稳定性。
单甘酯有明确的亲水头部和疏水尾部,可作为乳化剂用于稀奶油、蛋黄酱等食品乳液的制备,根据脂肪酸链长和饱和度可分为单硬脂酸甘油酯(glycerin monostearate,GMS)、单油酸甘油酯和单月桂酸甘油酯等。单甘酯在界面的吸附有一定的可逆性,其稳定乳液的主要机制为马兰戈尼效应,即其所形成的油水界面膜具有一定的自动修复功能。当脂肪球发生形变时,小分子乳化剂可快速迁移至新出现的油水界面,且在移动过程中会拖动连续相,恢复脂肪球间渗透压的平衡,避免脂肪球聚结,增加乳液的稳定性。邝婉湄等报道单甘酯在0.2%~1.0%时,乳液的稳定性随单甘酯含量的增加呈先增加后下降的趋势;而楼盛明则报道单甘酯浓度对乳液稳定性的影响较小,乳液体系组成的差异可能导致不同研究结果的不一致。蛋白分子也可作为乳化剂用于制备食品乳液。当乳液体系中同时存在单甘酯和蛋白时,二者可共同吸附在油水界面,从而对乳液的乳化稳定性产生影响。Cheng Jinju等发现单油酸甘油酯不会降低界面蛋白浓度,但可降低乳液的聚集程度。Mao等发现GMS与乳清蛋白的竞争作用使乳液乳化稳定性下降。上述研究主要报道了单甘酯的乳化作用或单甘酯与蛋白的共同作用对乳液稳定性的影响,对作用机制的研究较少。因此,本研究选择稀奶油生产中应用最为广泛的一类单甘酯——GMS作为乳化剂,与酪蛋白共同制备稀奶油。对于RDCs体系,单甘酯添加量为0.4%(/)及以上时,即可较好发挥乳化作用。本研究旨在从界面特性(界面张力、界面流变、界面蛋白浓度)和乳液分散性质(粒径、微观结构)两大方面探究GMS对胶束酪蛋白(micellar casein,MCN)、酪蛋白酸钙(CaC)、酪蛋白酸钠(NaC)RDCs乳化稳定性的影响及其机制。以期为RDCs的工业化生产提供更多的技术借鉴。
1 材料与方法
1.1 材料与试剂
GMS 广州美晨公司;MCN粉 美国Leprino公司;CaC粉、NaC粉 丹麦Arla公司;无水黄油 新西兰恒天然公司;分子筛吸附剂(Florisil型) 美国Sigma-Aldrich公司;去离子水 北京科丰正业商贸中心。
1.2 仪器与设备
APV-1000均质机 丹麦APV公司;DSA100接触角测量仪(配有DS4270振荡发生器) 德国Kruss公司;K9860凯氏定氮仪 中国海能仪器公司;LS 230激光粒度分析仪 美国Beckman公司;TCS SP2共聚焦激光扫描显微镜 德国莱卡公司;LUMiFuge稳定性分析仪 德国LUM公司。
1.3 方法
1.3.1 RDCs的制备
将无水黄油加热至70 ℃以上,称取4 g GMS溶于无水黄油,熔化彻底后作为油相。分别称取酪蛋白(MCN、CaC、NaC)5、10、15、20、25 g,用约600 g、70 ℃的去离子水溶解,在65~70 ℃左右水浴中搅拌90~120 min后备用。将油相与酪蛋白溶液混合,搅拌均匀后定容至1 000 g。进行1 次均质后冰水浴降至室温,置于4 ℃冷藏待测。RDCs中脂肪的质量分数为35.5%,酪蛋白质量分数为0.5%~2.5%,GMS质量分数为0.4%,不添加GMS的RDCs为对照组。
1.3.2 RDCs界面特性的研究
1.3.2.1 无水黄油纯化
无水黄油中含有一定量的表面活性成分,使用前必须经过纯化处理。在熔化的无水黄油中加入10%(/)分子筛吸附剂,60 ℃搅拌2 h,10 000 r/min离心25 min,取上清液。在测定温度42 ℃测定油水界面张力,重复上述操作直至油水界面张力在30 min内变化值小于0.5 mN/m。纯化后的无水黄油的密度为0.904 13 g/cm,油与去离子水的界面张力为(30.50f0.50)mN/m。
1.3.2.2 界面张力测定
用DSA100接触角测量仪测定油水界面张力随时间的变化。取适量油相于2 cmh2 cm透明玻璃槽内,油相温度为42 ℃。分别取约1 mL酪蛋白溶液于注射器中,将不锈钢针(直径1 mm)插入油相,静置20 min,使酪蛋白溶液与油相温度达到平衡(体系中酪蛋白的质量分数为1%)。当注射器针尖上形成15 μL的液滴,立即开始连续采集液滴外形图像,检测界面张力随吸附时间的变化,最大拍摄速率为50 次/s。利用Advance 1.8.0.3软件根据Young-Laplace公式计算界面张力:

式(1)中:∆为液滴界面的压力差;为液滴宽度;为液滴长度。
1.3.2.3 界面流变测定
用DSA100接触角测量仪测定界面流变。酪蛋白溶液的液滴形成后(体系中酪蛋白的质量分数为1%),通过振荡发生器使之发生正弦振荡,同时采集液滴外形图像,由Advance 1.8.0.3软件对图像进行分析。根据液滴的3 个特征参数(表面积、体积及界面张力)的变化,计算所形成的界面膜的扩张模量()、弹性模量(’)及黏性模量(’’)。通过预实验确定正弦振幅为5%,振荡频率为0.1 Hz,此振荡参数位于线性黏弹区。每次测量进行8 个正弦周期。绘制和表面压()曲线,曲线斜率可表征界面分子间的交互作用,其中可根据下式计算:

式(2)中:为无水油与纯水间的界面张力(实验条件下为(30.50f0.50)mN/m);γ为时间时蛋白溶液与无水乳脂间的界面张力。
1.3.2.4 界面蛋白浓度测定
参考Long Zhao等的方法并略作调整后测定界面蛋白浓度。称取10 g稀奶油样品于50 mL离心管中,4 ℃、10 000 r/min离心60 min,分别取奶油层、下层清液及沉淀。用凯氏定氮法分别测定稀奶油的总蛋白质量()、下层清液及沉淀的蛋白质量(),用LS 230激光粒度仪测定脂肪球的比表面积(specific surface area,SSA),界面蛋白浓度计算如下:

式(3)中:为离心后奶油层的质量。
1.3.3 RDCs乳液特性的研究
1.3.3.1 脂肪球粒径测定
利用LS 230激光粒度仪的Mie模式测定RDCs中脂肪球的粒径分布以及大小(用表面积平均粒径表示)。将样品用去离子水稀释10 倍后缓缓滴入样品池,使遮光度处于10%。折射率和吸收率分别设定为1.460与0.001,分散相折射率设定为1.333。
1.3.3.2 脂肪球微观结构的观察
取1.0 mL RDCs样品于离心管中,用去离子水稀释10 倍后,依次加入20 μL、0.2 mg/mL尼罗红溶液和20 μL、0.2 mg/mL异硫氰酸荧光素溶液,轻轻摇匀后制片观察(避光操作)。使用配有20×目镜、63×油镜的共聚焦激光扫描显微镜观察样品的微观结构,激发光源为氩灯,激发波长为488 nm,尼罗红和异硫氰酸荧光素的接收波长分别为595~648 nm和500~536 nm。
1.3.3.3 乳化稳定性测定
参考李扬等的方法并略作调整,用LUMiFuge稳定性分析仪测定样品的相分离时间。测试温度为25 ℃,离心转速为4 000 r/min,光因子为1.0,每30 s取值1 次,共测定7 200 s。透光率积分达到20%为相分离标准,记录相分离时间。相分离时间越长,乳析速率越低,乳化稳定性越好。
1.4 数据统计
界面张力及界面流变实验进行2 次重复,每次重复进行2 次平行测定;其余实验进行3 次重复。利用SPSS 20.0软件进行单因素方差分析,用Duncan法进行差异显著性分析。<0.05,差异显著。
2 结果与分析
2.1 GMS对3 种酪蛋白RDCs界面特性的影响
2.1.1 GMS对3 种酪蛋白界面张力的影响
预实验发现酪蛋白质量分数大于0.05%时,界面张力随蛋白浓度的变化较小,Zhao Qiangzhong等报道过类似结果。因此,使用质量分数为1.0%的酪蛋白研究界面张力。如图1所示,3 种酪蛋白溶液的油水界面张力在0.5 s内从30.5 mN/m迅速下降至15.0 mN/m以下,此后变化较为缓慢,吸附5 400 s后3 种酪蛋白溶液的油水界面张力无显著差异(>0.05),均在13.1 mN/m左右。体系中仅含GMS时,界面张力在0.5 s下降至22.4 mN/m,此后界面张力在0.5~2 400 s下降较为迅速,在2 400~5 400 s下降较为缓慢,在5 400 s GMS在油水界面的吸附达到近似平衡,界面张力约为15.9 mN/m。3 种GMS-酪蛋白复合体系(GMS-MCN、GMS-CaC、GMS-NaC)界面张力在0.5 s内从30.5 mN/m迅速下降至13.5 mN/m以下,此后界面张力下降较为缓慢,在5 400 s界面张力在12.0 mN/m左右。可以看出,GMS-酪蛋白复合体系吸附近似平衡时界面张力低于仅含GMS或仅含酪蛋白的体系,且界面张力曲线与仅含酪蛋白体系的更为接近,说明油水界面仍以酪蛋白吸附为主。Seta等报道过类似结果,单二乙酰酒石酸甘油酯和蛋白浓度比小于0.3时,乳化剂和蛋白复合体系界面张力的变化趋势与仅含蛋白的体系相似。

图1 酪蛋白油水界面的吸附速率Fig.1 Adsorption rate of casein oil/water interface
2.1.2 GMS对3 种酪蛋白界面流变的影响
如图2所示,体系中仅含质量分数为1.0%的酪蛋白时,MCN油水界面膜的’随吸附时间的延长先减小后增加,CaC及NaC形油水界面膜的’随吸附时间的延长不同程度地增加,’’随吸附时间的增加无明显变化。吸附时间为7 000 s时,3 种酪蛋白形成的油水界面膜的’高于’’,分别为(9.3f3.3)、(4.0f0.8)mN/m和(4.5f0.2)mN/m,界面膜以弹性为主;MCN界面膜的弹性高于其他两种酪蛋白,三者界面膜的”间无明显差异。当体系中仅含GMS,油水界面膜的’随吸附时间的延长而显著增加,”随吸附时间的延长无明显变化,’显著高于”(<0.05),表明GMS形成的界面膜也以弹性为主。有研究表明,乳化剂的分子质量较小,在油水界面的排列更为紧密,所形成的界面膜具有一定的流动性,但弹性较低,这与本研究的结果不完全相同。可能是因为在42 ℃条件下,GMS开始结晶,部分界面结晶的存在增加了界面膜的弹性。由图2可知,GMS和3 种酪蛋白形成的界面膜的黏弹性有明显不同。GMSMCN界面膜的’随着吸附时间的延长而显著增加,而”却无明显变化,界面膜以弹性为主;吸附近似平衡时(7 200 s),GMS-MCN界面膜与仅含MCN的界面膜相比弹性较低。GMS-CaC或GMS-NaC所形成的油水界面膜的’显著低于GMS界面膜的’,与仅含酪CaC或NaC所形成的油水界面膜性质较为接近,此时界面上以酪蛋白分子吸附为主。
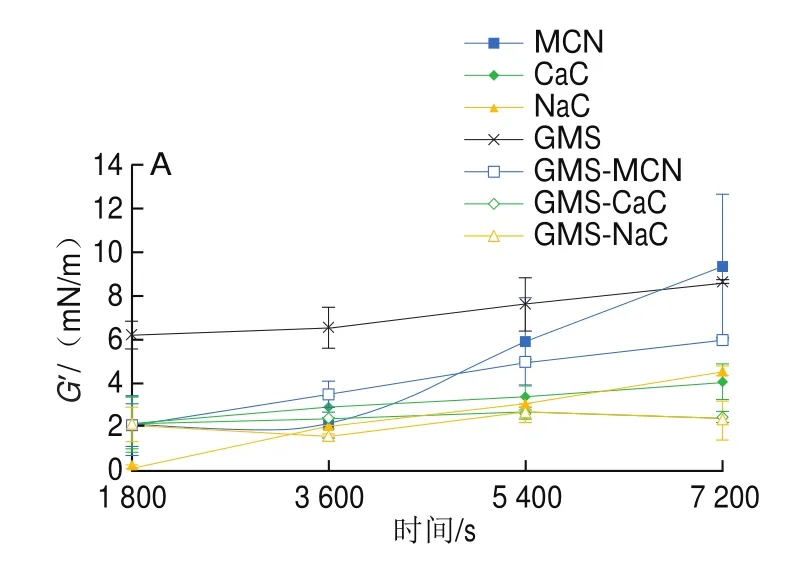

图2 酪蛋白油水界面膜G’(A)、G”(B)随吸附时间的变化Fig.2 Variation in casein oil/water interfacial G’ (A) and G” (B) with adsorption time
根据结果绘制界面扩张模量和表面压曲线(-),曲线斜率越小,界面分子间的交互作用越弱。由图3可知,3 种酪蛋白的-曲线斜率均大于1,MCN、CaC和NaC的斜率分别为4.32、1.69和3.45,说明此时界面蛋白分子间存在较强的交互作用。GMS-MCN的-曲线斜率为3.20,低于MCN体系的斜率。CaC或NaC与GMS共同形成的油水界面膜-曲线斜率均小于1,分别为0.67和0.76,说明此时界面上蛋白分子间的交互作用较弱,可能是因为GMS嵌入界面蛋白网络间隙破坏了酪蛋白界面网络结构。
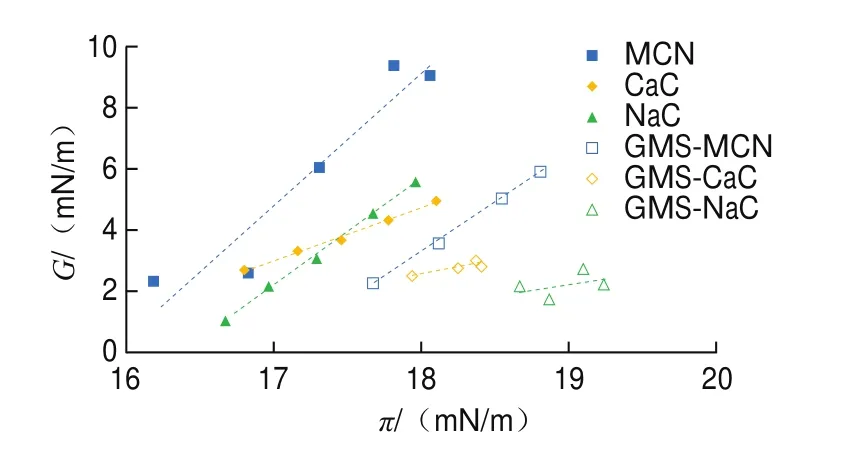
图3 酪蛋白油水界面膜G与π的关系Fig.3 Relationship between G and π of casein oil/water interface
2.1.3 GMS对3 种酪蛋白界面蛋白浓度的影响
本实验条件下,质量分数为0.5%和1.0% MCN无法形成稳定的稀奶油乳液,无法测定其界面蛋白浓度,因此不再做后续研究。如图4所示,MCN质量分数为1.5%~2.5%,RDCs界面蛋白浓度由(15.20f1.87)mg/m显著增加至(30.99f0.78)mg/m(<0.05)。CaCRDCs和NaC-RDCs体系中,界面蛋白浓度也随着酪蛋白质量分数的增加呈现一定的增加趋势,CaC-RDCs的界面蛋白浓度先由1.99 mg/m增加11.09 mg/m再下降至10.84 mg/m;NaC-RDCs界面蛋白浓度由(0.98f0.34) mg/m增加至(3.81f0.46)mg/m。蛋白质量分数增加,油水界面上蛋白分子的去折叠受到限制,每分子蛋白所覆盖的油水界面面积降低,因而需要吸附更多的蛋白以充分覆盖油水界面。另一方面,蛋白分子可通过疏水作用与界面蛋白结合形成多层界面膜,因而界面蛋白浓度也会有所增加。
由图4可知,蛋白质量分数为0.5%~2.5%,GMSMCN-RDCs、GMS-CaC-RDCs和GMS-NaC-RDCs界面蛋白浓度分别为4.7~12.1、2.0~7.4 mg/m和1.0~5.5 mg/m。可以发现,GMS对3 种酪蛋白RDCs界面蛋白浓度的影响有所不同。GMS可明显降低MCN-RDCs体系的界面蛋白浓度;其对CaC-RDCs和NaC-RDCs界面蛋白浓度的影响与蛋白质量分数有关,CaC质量分数为0.5%时,界面蛋白浓度无明显变化,CaC质量分数大于0.5%时,界面蛋白浓度有不同程度地下降。加入GMS后,质量分数2%和2.5%的NaC-RDCs界面蛋白浓度升高,分别由3.59 mg/m升至4.31 mg/m,由3.81 mg/m升至5.46 mg/m;其他质量分数的NaC-RDCs界面蛋白浓度无明显变化。
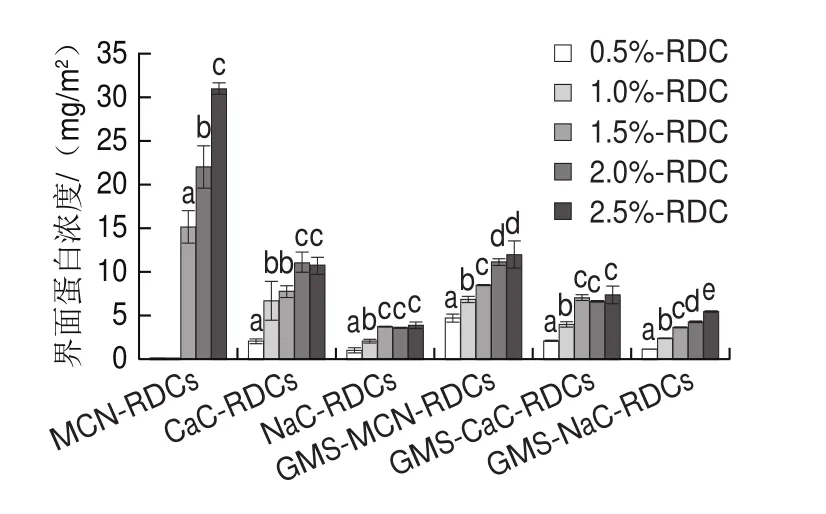
图4 不同酪蛋白RDCs的界面蛋白浓度Fig.4 Interfacial protein concentrations of different casein RDCs
2.1.4 GMS对3 种酪蛋白RDCs界面特性的影响机制
Maldonado-Valderrama等表明,离子型乳化剂因为带有一定的电荷,可与蛋白分子通过静电结合形成可溶性的复合物(溶解机制)吸附在油水界面,从而改变界面特性。GMS为一种非离子型乳化剂,无法通过静电作用直接与蛋白结合,更倾向与蛋白共同吸附在界面上,逐渐取代蛋白(取代机制)。GMS对3 种酪蛋白的取代作用不同。MCN-RDCs中,GMS吸附在界面蛋白网络结构上,并逐渐嵌入网络结构内部,降低界面蛋白分子间的交互作用,迫使部分蛋白离开,界面蛋白吸附量随之下降,界面特性改变;同时被取代的蛋白进入连续相后,继续乳化其他游离脂肪,这可能会导致脂肪球的分散特性相应发生变化。CaC-RDCs和NaC-RDCs体系中,酪蛋白分子质量及粒径较小,在油水界面形成的网络结构较为致密,GMS对CaC-RDCs和NaC-RDCs界面特性的影响较MCN-RDCs小。CaC质量分数为0.5%时,GMS虽也嵌入了界面蛋白网络结构,降低界面蛋白分子间的交互作用,但未使界面网络结构崩塌,因而蛋白并未真正离开界面。CaC质量分数增加,蛋白分子可吸附在界面蛋白网络结构上,在部分区域形成多层的油水界面膜,GMS可能通过导致多层界面膜结构破坏,促使蛋白离开界面,界面蛋白吸附量略有下降,界面特性也略有改变。NaC-RDCs体系中,NaC质量分数小于2.0%时,GMS也并未促进蛋白离开界面,而质量分数为2.0%和2.5%时,界面蛋白浓度增加,可能是因为GMS促进了体系乳化,促使更多的NaC分子吸附在油水界面上,这点仍需进一步的研究证实。
2.2 GMS对3 种酪蛋白RDCs乳液特性的影响
2.2.1 GMS对3 种酪蛋白RDCs粒径分布的影响
如图5A所示,MCN质量分数为1.5%~2.0%,MCNRDCs中可见两个分离的粒径分布峰,分别为0.4~1.5、1.6~19.0 μm。质量分数增加至2.5%时,脂肪球粒径分布范围无明显变化,主要粒径分布峰的峰宽变小,表明体系中脂肪球粒径均匀性略有增加。在CaC-RDCs体系中,CaC质量分数大于0.5%时,脂肪球的粒径呈单峰分布,为0.4~13.0 μm。在NaC-RDCs体系中,NaC质量分数为0.5%~1.5%时,脂肪球呈单峰分布,为0.4~10.0 μm内;质量分数再增加,粒径峰的分布范围无明显变化,但峰宽增加,且在5.0 μm左右有小肩峰出现,可能是排斥絮凝导致的脂肪球聚集。

图5 酪蛋白RDCs(A)及GMS-酪蛋白RDCs(B)粒径分布Fig.5 Particle size distribution of lipid droplets in casein RDCs
由图5B可知,MCN质量分数为0.5%时,GMSMCN-RDCs的粒径分布范围较大,主粒径峰的分布范围为6.1~17.2 μm;质量分数增加至1.0%,粒径分布峰为1.6~13.0 μm;质量分数在1.5%~2.5%时,粒径分布峰为0.4~8.2 μm。CaC质量分数为0.5%,GMS-CaC-RDCs主要粒径峰的分布为1.5~10.0 μm;CaC质量分数为1.0%~2.5%,粒径分布峰为0.4~7.5 μm。NaC质量分数为0.5%~2.5%,GMS-NaC-RDCs粒径分布为0.4~6.7 μm。与未添加GMS的RDCs粒径分布相比,GMS可促进MCN为蛋白原料的稀奶油中脂肪球的粒径分布向小粒径方向移动,这是因为GMS和酪蛋白复合体系可降低油水界面张力,因而脂肪球粒径有所下降。类似的,CaC和NaC为蛋白原料时,GMS也促进了脂肪球粒径分布向小粒径方向移动,但移动幅度较MCN-RDCs的小。可能是因为CaC和NaC中酪蛋白以非胶束状态存在,乳化活性较好,仅CaC和NaC即可较好覆盖油水界面,因而GMS的添加对体系脂肪球分布的影响较小。
2.2.2 GMS对3 种酪蛋白RDCs微观结构的影响
用共聚焦激光扫描显微镜观察RDCs中脂肪球的微观结构,结果如图6所示,其中红色代表脂肪球。MCNRDCs体系中,MCN质量分数为1.5%,稀奶油体系中存在较多的脂肪球聚集体;质量分数增加至2.5%时,微观图像与1.5% MCN-RDCs相似,也可见较多的脂肪球聚集体。添加GMS后,0.5% GMS-MCN-RDCs体系中可见脂肪球聚集体,质量分数增加,体系中无明显的脂肪球聚集体。CaC-RDCs体系中,CaC质量分数为0.5%时,稀奶油体系中也可见脂肪球聚集体,质量分数增加,体系中无明显的脂肪球聚集体。添加GMS后,0.5% GMS-CaCRDCs中无明显的脂肪球聚集体,其他质量分数的酪蛋白体系中无明显的脂肪球聚集体。对于NaC-RDCs体系,无论是否添加GMS,所有质量分数下脂肪球分散均匀,均无明显的聚集体(图像未给出)。

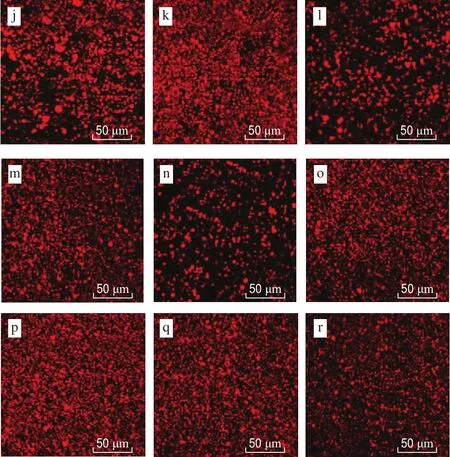
图6 酪蛋白RDCs微观图像Fig.6 Microcosmic images of casein RDCs
2.2.3 GMS对3 种酪蛋白RDCs乳化稳定性的影响
如图7所示,MCN-RDCs的相分离时间随MCN质量分数的增加而增加,MCN质量分数为2.5%时,相分离时间最大,为(474f46)s,此时乳化稳定性最大。CaC-RDCs体系中,相分离时间随CaC质量分数的增加呈现先无显著差异后显著增加的趋势,质量分数为2.5%时,相分离时间为(922f86)s,乳化稳定性最大。NaC-RDCs体系中,相分离时间随NaC质量分数的增加呈现先无显著差异后显著下降至无显著差异的趋势,质量分数为1.0%相分离时间最大,为1 300 s左右,高质量分数时相分离时间的下降可能与体系的排斥絮凝有关。由图7可知,GMS-MCN-RDCs和GMS-CaC-RDCs体系的相分离时间随蛋白浓度的增加有不同程度的增加,相分离时间分别为130~4 630 s和170~550 s。GMS-NaCRDCs体系相分离时间随NaC质量分数的增加而下降,至不再发生显著变化,NaC质量分数为0.5%,相分离时间最大,为(1 460f47)s,此时乳化稳定性最大。由图7可知,相同质量分数下GMS和MCN的共同吸附可以使MCN-RDCs的乳化稳定性有明显增加。CaC质量分数在0.5%~2.0%内时,GMS的添加可使乳化稳定性略有增加;而CaC质量分数为2.5%时,GMS的添加对乳化稳定性有不利影响。GMS的添加可使0.5% NaC-RDCs的乳化稳定性略有增加,但会导致其他质量分数NaC-RDCs的乳化稳定性不同程度下降。
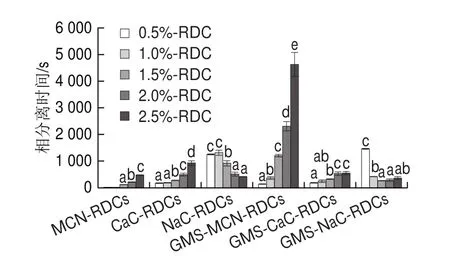
图7 GMS对3 种酪蛋白RDCs相分离时间的影响Fig.7 Effect of GMS on the phase separation time of three casein RDCs
2.2.4 GMS对3 种酪蛋白RDCs乳化稳定性影响的作用机制
Fang Yuan等报道酪蛋白浓度较低时,小分子乳化剂的添加可以增加稀奶油的稳定性,这与本研究的结果不完全一致。本研究发现小分子乳化剂对稀奶油乳化稳定性的影响除与酪蛋白浓度有关外,还与酪蛋白的种类有关。MCN中酪蛋白多以胶束形式存在,乳化能力较小,以MCN为蛋白原料时,GMS和MCN的共同吸附可降低界面张力和界面蛋白分子间的交互作用,较大程度促进脂肪球分散,因而乳化稳定性显著增加。CaC为蛋白原料时,GMS和CaC的共同吸附也可促进脂肪球分散,因此质量分数在0.5%~2.0%时,体系稳定性略有增加;但质量分数为2.5%时,体系中脂肪球粒径和未吸附的酪蛋白分子数量可能处于引起排斥絮凝的范围,因而发生排斥絮凝,乳化稳定性有所下降。NaC为蛋白原料时,仅用NaC即可制备脂肪球分散较为均匀的乳液。添加GMS后,在较高蛋白质量分数下,脂肪球粒径的下降和体系中未吸附的NaC数量的增加使排斥絮凝程度增加,从而导致乳化稳定性有明显的下降。
3 结 论
GMS对3 种酪蛋白RDCs乳化稳定性的影响因蛋白种类和浓度的差异而有所不同。对于MCN-RDCs体系,GMS嵌入界面蛋白网络结构,使界面蛋白浓度由15.2~31.0 mg/m降至4.7~12.1 mg/m,此时GMS与MCN共同乳化脂肪球,促进了脂肪球分散,因而乳化稳定性增加。而对于CaC-RDCs、NaC-RDCs体系,GMS虽也嵌入了界面蛋白网络结构,但其对界面膜性质的影响较小,因而对脂肪球分散的促进作用也较小。当CaC质量分数为0.5%~2.0%时、NaC质量分数为0.5%时,GMS和酪蛋白的共同乳化作用才可使这2 种RDCs体系的乳化稳定性略有增加。本研究虽然分析了GMS对3 种酪蛋白RDCs稳定性的影响,但在实际仓储条件下,GMS对酪蛋白RDCs长期稳定性的影响尚不明确,仍有待于进一步的研究。

