超高效液相色谱-串联质谱法检测畜肉及内脏中苯甲酸和马尿酸残留
王娟强,刘梦瑶,张明悦,赵文涛*,李莹莹,郭文萍
(中国肉类食品综合研究中心,肉类加工技术北京市重点实验室,北京 100068)
苯甲酸及其钠盐对酵母菌、霉菌和部分细菌均有抑制作用,作为防腐剂在我国被广泛应用于蜜饯、酱及酱制品、饮料等各类食品中,GB 2760ü2014《食品添加剂使用标准》规定了部分食品中苯甲酸及其钠盐的允许使用范围和最大使用量,并规定肉制品、生鲜肉中不得检出苯甲酸。2013年美国农业部食品安全检验局批准苯甲酸钠用于畜禽产品,最大限量为0.1%(以质量计)。日本禁止在肉制品中使用苯甲酸钠,欧洲和澳大利亚虽然允许苯甲酸钠用于肉制品,却不建议在儿童食品中使用。苯甲酸及其钠盐对人体的毒副作用较小,但过量摄入会损害神经系统,破坏细胞平衡,产生有毒物质,严重威胁生命健康。近年来,苯甲酸钠毒性大小备受争议,其使用的安全性也越来越受关注。
近年来,市场上出现一些不法商家在暴利驱使下,制造、销售添加了苯甲酸钠的“注水肉”,注水后的肉易造成微生物污染,不法商家添加苯甲酸钠,达到杀菌防腐效果,减缓生鲜肉的腐败。注水肉现象屡禁不止,2014年兴化市一家屠宰场被举报给活猪注水,通过增加猪肉质量非法盈利。2017年锦州市某镇肉联厂向待屠宰的生猪注水,同时注射盐酸肾上腺素针剂,生产、销售大量“注水猪肉”。2018年报道发现注水时加入保水药和消炎药等新作案手法。注水肉不仅损害消费者的利益,更会引入非肉源性污染物威胁消费者的健康。目前尚无针对生鲜肉中苯甲酸钠及代谢物的检测方法。为严厉打击非法注水肉行为,亟需建立生鲜肉中苯甲酸及其代谢物的检测方法,为执法提供技术支撑。
此外,苯甲酸已被欧盟批准作为生长肥育猪饲料添加剂,其日粮添加水平为0.5%~1%。在我国,近年来苯甲酸及钠盐开始应用于畜禽饲料中。研究表明苯甲酸可提高生长猪的日增质量,缩短达到肥育体质量时间。Kristensen等研究发现生长猪在摄入苯甲酸后被肝脏迅速吸收并被肾脏代谢,以85%马尿酸和15%苯甲酸形式排出体外。而Shu Yan等研究发现日粮添加2.5%或5.0%苯甲酸组猪肝脏和肾脏中苯甲酸残留量高于0.5%苯甲酸组,摄入过量苯甲酸会导致仔猪器官受损,苯甲酸会在猪组织器官中累积。以上研究表明,长期摄入过量苯甲酸会在动物组织器官累积,苯甲酸主要代谢产物是马尿酸。通过检测畜肉及内脏中苯甲酸及马尿酸含量可评估使用饲料的合理性,监测苯甲酸及代谢物在畜肉及内脏中的残留量可有效保障食品安全。
目前国内外关于苯甲酸和马尿酸检测方法的研究报道主要采用毛细管电泳法、气相色谱法、高效液相色谱法以及高效液相色谱-串联质谱法。GB 5009.28ü2016《食品中苯甲酸、山梨酸和糖精钠的测定》中仅规定了一般食品中苯甲酸的液相色谱和气相色谱检测方法。气相色谱法前处理操作繁琐、耗时较长,高效液相色谱法灵敏度较低、定性能力较差,阳性样品通常需要进行质谱确证,用于多组分复杂基质的同时测定难以克服基质干扰的不足。而高效液相色谱-串联质谱联用技术一般采用多反应监测方式,不但抗干扰能力强、操作简便、选择性强,准确度和灵敏度也高,逐渐成为多组分高通量痕量、微量分析的重要方法。目前,国内外针对苯甲酸和马尿酸的研究中,采用检测的样品基质并未涉及新鲜畜肉及内脏,且未有同时检测苯甲酸和马尿酸的超高效液相色谱-串联质谱检测方法。现有国家标准中也没有专门针对生肉样品的前处理方法,已有文献报道的动物源食品基质多为肉制品和乳制品,主要通过水相提取、沉淀剂沉淀蛋白除杂,而生肉样品中不仅含蛋白还包括磷脂、酶等复杂成分,如何有效减少样品杂质干扰是畜肉及内脏样品前处理的难点。随着固相萃取小柱填料的发展,固相萃取技术发挥较大优势,如避免乳化现象、操作简单方便、溶剂消耗少、回收富集效率高、重复性好,被广泛应用于多个领域。因此,本实验专注于畜肉及内脏样品前处理条件优化,通过固相萃取技术净化样品,建立能够检测畜肉及内脏中苯甲酸和马尿酸的超高效液相色谱-串联质谱检测方法。本检测方法能够高通量、快速检测畜肉及内脏中的苯甲酸和马尿酸,可用于评估监测饲用苯甲酸的畜肉食品安全,为执法机关监管违法添加苯甲酸的行为提供有力技术支撑。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈、甲酸、乙酸铵(均为色谱纯) 德国CNW公司;乙腈、甲醇、乙酸(均为分析纯) 国药集团化学试剂有限公司;水为一级水。
对照品:苯甲酸钠(纯度98.94%) 德国Dr.Ehrenstorfer GmbH公司;马尿酸(纯度98%) 德国CNW公司。
1.2 仪器与设备
PRiME HLB固相萃取柱(60 mg/3 mL)、HLB固相萃取柱(60 mg/3 mL)、MAX固相萃取柱(60 mg/3 mL) 沃特世科技(上海)有限公司;C固相萃取柱(500 mg/3 mL)、PAX固相萃取柱(200 mg/3 mL)、PWAX固相萃取柱(200 mg/3 mL)天津博纳艾杰尔科技有限公司;ExionLC高效液相色谱-QTRAP 5500串联四极杆质谱仪 美国AB SCIEX公司;AUW220电子天平(分度值0.1 mg) 日本Shimadzu公司;S-100涡旋仪 日本Taiyo公司;离心机日本Hitachi公司;Milli-Q纯水仪 美国Millipore公司;固相萃取装置 美国Agilent公司;HGC-24A氮吹仪天津恒奥科技发展有限公司。
1.3 方法
1.3.1 溶液配制
标准溶液:准确称取对照品,折算成苯甲酸、马尿酸各10 mg(精确至0.000 1 g),置于100 mL烧杯中,加适量甲醇溶解,用甲醇转移并定容至刻度,摇匀,配制成质量浓度为100 mg/L标准储备液。置于-18 ℃以下冰箱中保存。
混合标准溶液:分别吸取苯甲酸、马尿酸标准储备液适量,用甲醇配制成混合标准溶液,置于-18 ℃以下冰箱中保存。
标准工作溶液:使用时将上述混合标准溶液用甲醇-水(1∶1,/)逐级稀释为标准工作溶液。临用现配。
1.3.2 样品制备与前处理
取空白或供试动物组织样品,绞碎,均质,得空白或试样。称取样品2 g(精确至0.01 g)于50 mL离心管中,加入10 mL甲醇,加盖后涡旋提取20 min,4 ℃、12 000 r/min离心5 min,将2 mL上清液过PRiME HLB固相萃取柱,接收流出液,并用2 mL甲醇洗脱,收集全部流出液,在40 ℃以下氮气吹近干至0.5 mL,加入0.5 mL水,涡旋复溶,过0.22 μm滤膜,供测定。
1.3.3 仪器条件
色谱条件:Phenomenex Luna Omega Polar C色谱柱(2.1 mmh100 mm,3 μm);柱温30 ℃;进样体积5 μL;流动相:A为5 mmol/L乙酸铵(含0.1%甲酸);B为乙腈;流速0.4 mL/min。洗脱梯度见表1。
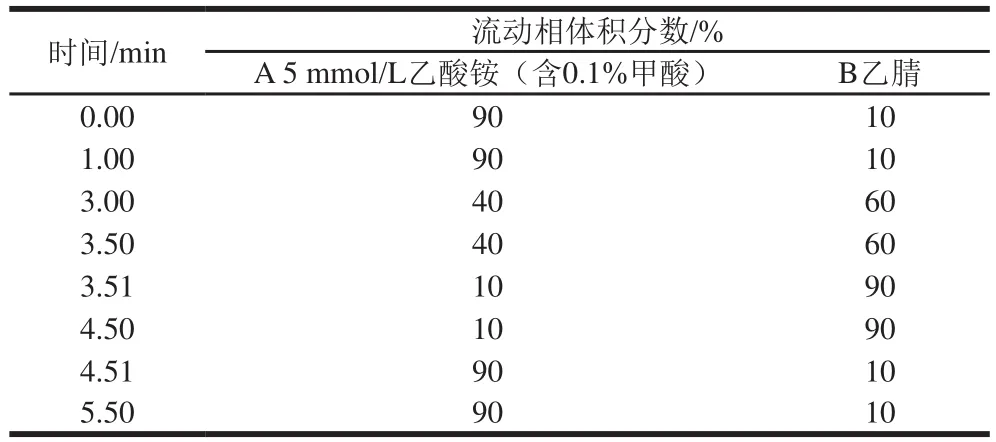
表1 梯度洗脱程序Table 1 Gradient elution program
质谱条件:电喷雾离子源(electrospray ionization,ESI)负离子模式(ESI);离子化电压4 500 V;气帘气压力30 psi;雾化气压力55 psi;辅助气压力60 psi;雾化温度550 ℃;多反应监测参数见表2。

表2 苯甲酸和马尿酸的多反应监测质谱参数Table 2 MS parameters in MRM mode for benzoic acid and hippuric acid
2 结果与分析
2.1 仪器条件的优化
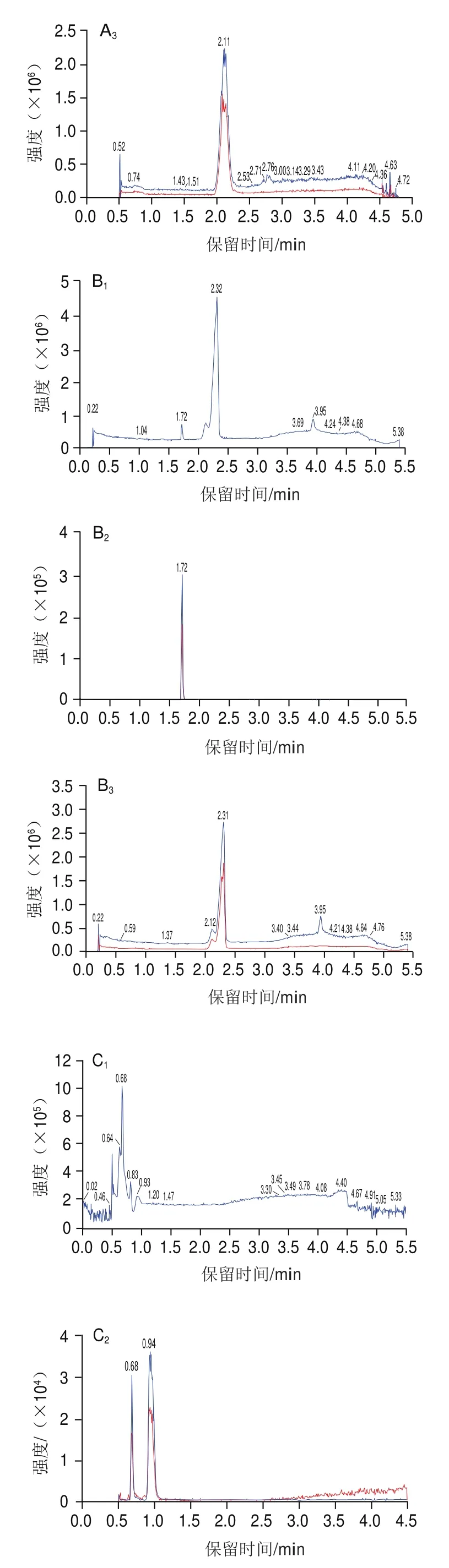
液相色谱条件的优化主要考察色谱柱和流动相对目标化合物的保留和分离情况。实验过程中比较不同的色谱柱Phenomenex Luna Omega Polar C(2.1 mmh100 mm,3 μm)、Phenomenex Kinetex C(3.0 mmh50 mm,2.6 μm)、Agilent SB-AQ(3.0 mmh100 mm,1.8 μm)对化合物分离效果的影响。如图1B所示,使用Agilent SB-AQ色谱柱时,在苯甲酸出峰处左边有1 个干扰峰。使用Kinetex C色谱柱时,苯甲酸峰形不佳(图1A)。Phenomenex Luna Omega Polar C色谱柱不仅能使化合物完全分离,还能有效减少杂质对苯甲酸和马尿酸的干扰。Luna Omega Polar C色谱柱填充了具有极性基团修饰的颗粒,其表面增强了极性保留能力,对苯甲酸和马尿酸保留和分离效果好。为使化合物峰形更佳,响应更高,本实验考察在水相为纯水、5 mmol/L乙酸铵溶液和5 mmol/L乙酸铵(含0.1%甲酸)溶液,有机相为乙腈的流动相体系下,苯甲酸和马尿酸的出峰情况。结果表明,水相为纯水时,苯甲酸和马尿酸出峰时间较早,并且苯甲酸出峰时间右侧有1 个干扰峰(图1D);水相为5 mmol/L乙酸铵溶液时,苯甲酸未出峰,可能是乙酸铵溶液抑制了其电离(图1C)。通过加入一定量甲酸调节流动相5 mmol/L乙酸铵溶液的pH值,使目标化合物出峰时间后移,从而减少洗脱杂质对目标物的影响,更好地改善峰形,得到对称的尖峰。因此,本实验选择含0.1%甲酸的5 mmol/L乙酸铵溶液作为流动相水相。
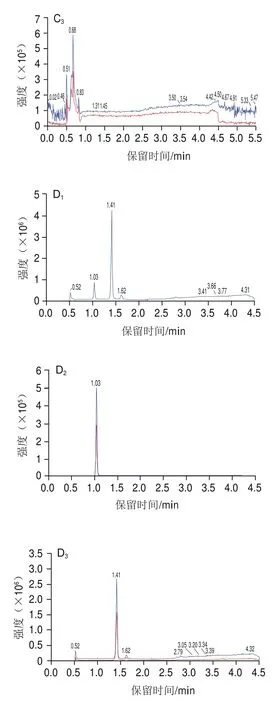
图1 不同液相色谱条件下化合物的离子流图Fig.1 Ion current chromatograms of the target compounds under different liquid chromatography conditions
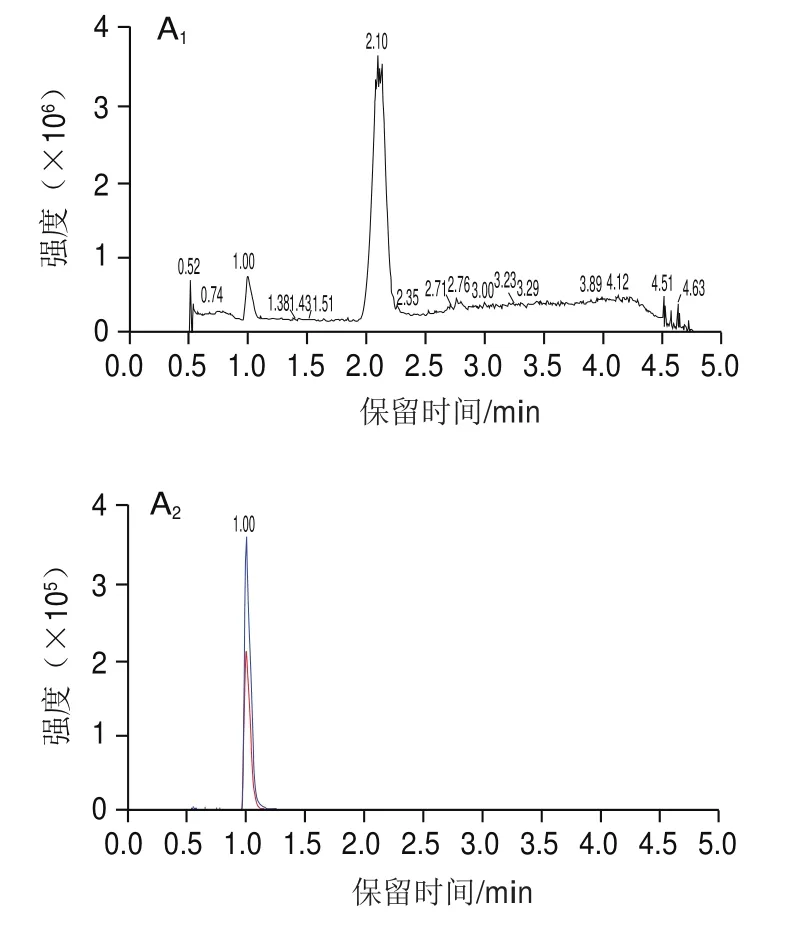
如图2所示,苯甲酸和马尿酸的结构中均含有羧基,苯甲酸钠以钠盐形式存在,在极性溶剂中易失去氢离子形成带负电荷的基团[M-H],因此选取负离子模式对化合物混合标准溶液进行全扫描,以确定分子离子峰。然后进一步碎裂母离子,并对子离子进行全扫描。在此基础上,选择2 个丰度较高、峰形好、干扰小的特征子离子,并优化去簇电压和碰撞能量等参数,最终选定定量分析条件,结果见表2。苯甲酸和马尿酸的离子流图见图3。
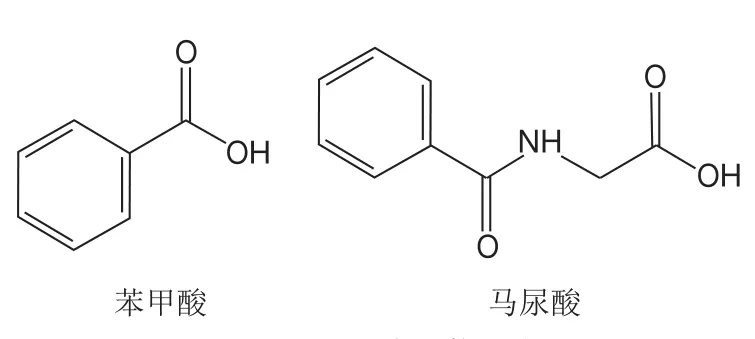
图2 目标化合物的结构式Fig.2 Structures of the target compounds
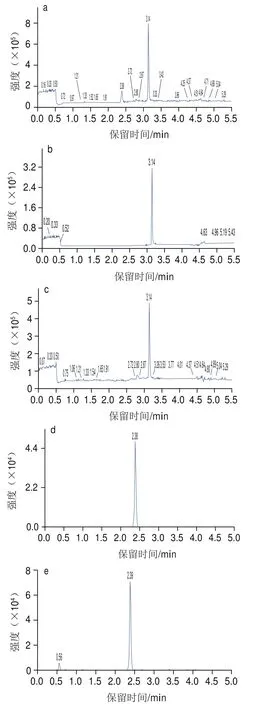
图3 苯甲酸(200 ng/mL)和马尿酸(40 ng/mL)的离子流图Fig.3 Ion current chromatograms of the target compounds (benzonic acid at 200 ng/mL and hippuric acid at 40 ng/mL)
2.2 样品前处理条件优化
2.2.1 提取溶剂的选择
苯甲酸和马尿酸属于极性化合物,根据相似相溶原理,采用极性溶剂进行样品提取。对比甲醇、乙腈、甲醇-水(1∶1,/)、乙腈-水(1∶1,/)、甲酸-甲醇-水(0.02∶1∶1,/)、甲酸-乙腈-水(0.02∶1∶1,/)作为提取溶剂时的提取效率。如图4所示,甲醇作为提取溶液时对苯甲酸的提取效果最好,乙腈和甲醇-水(1∶1,/)次之。对马尿酸提取效果依次为甲醇-水(1∶1,/)>甲酸-乙腈-水(0.02∶1∶1,/)>乙腈-水(1∶1,/)>甲醇。在甲醇-水和乙腈-水体系下马尿酸提取率较纯有机相更高,说明加入一定比例的水,有利于马尿酸的提取。此外,实验结果表明加入甲酸并不能提高对苯甲酸和马尿酸的提取效率。综上,甲醇和甲醇-水(1∶1,/)对苯甲酸和马尿酸提取效果更佳。
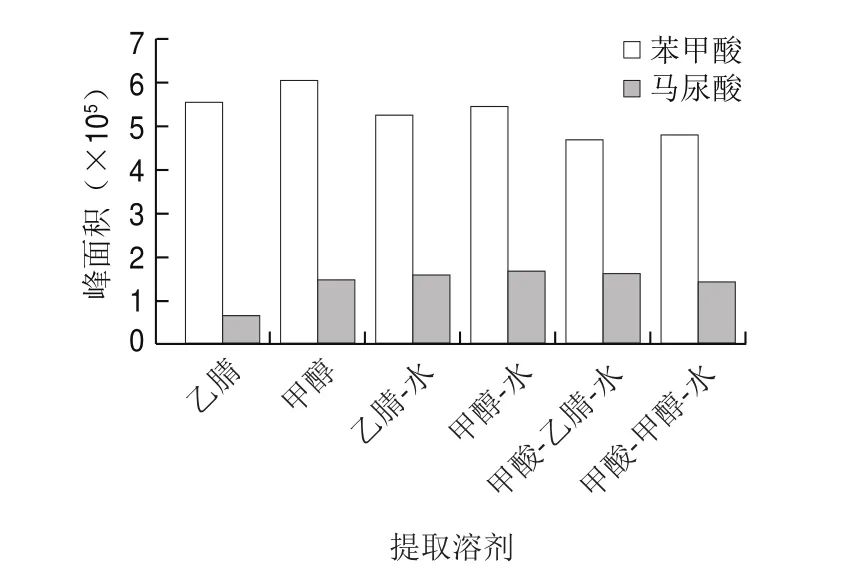
图4 不同提取溶剂对苯甲酸和马尿酸提取效果的影响(n=3)Fig.4 Effect of different solvent systems on the extraction of benzoic acid and hippuric acid (n = 3)
为进一步优化溶剂对目标化合物的提取,考察不同比例甲醇和水体系下,甲醇、甲醇-水(75∶25,/)、甲醇-水(50∶50,/)、甲醇-水(25∶75,/)以及纯水对苯甲酸(加标量1 mg/kg)和马尿酸(加标量0.2 mg/kg)的提取回收效果。如图5所示,以上几种提取溶剂对马尿酸的提取效果差别不大,回收率在100%~115%之间。而提取溶剂为甲醇时,苯甲酸回收率最高,达到90%以上。为有效提取两种目标化合物,本实验选择甲醇作为提取溶剂。
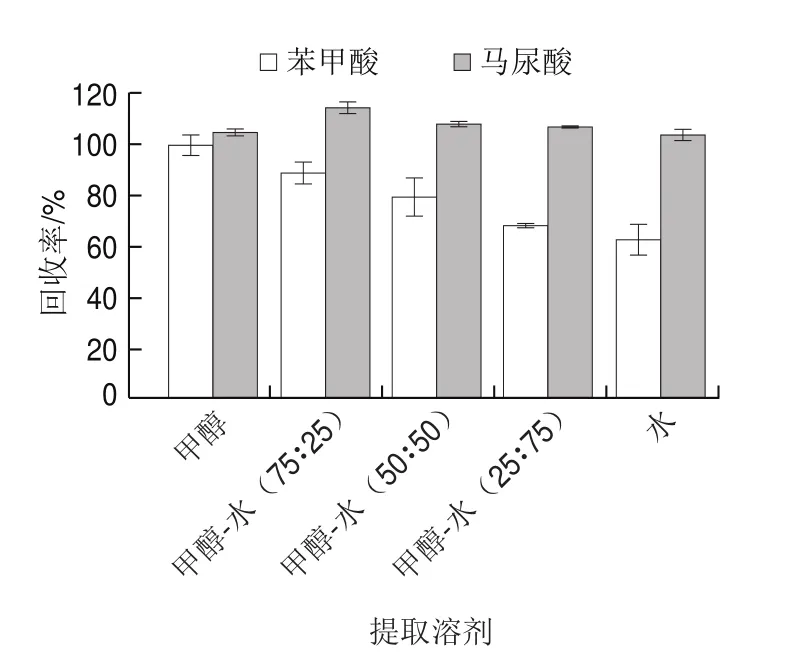
图5 不同比例甲醇-水溶剂体系下目标物的提取回收率(n=3)Fig.5 Effect of methanol, water and their mixtures on the recoveries of target compounds (n = 3)
2.2.2 净化方法的优化
虽然样品在提取、离心过程中去除了大部分脂肪、蛋白,但提取溶液中仍含有大量杂质,还需进一步净化。相较于液液萃取等净化方式,固相萃取柱净化可以有效保留目标物,去除多余杂质,因此选取固相萃取柱对其进行富集、除杂。净化过程中,不同类型固相萃取柱对目标化合物的保留程度不同,本实验选取6 种固相萃取柱,对比苯甲酸1 mg/kg、马尿酸0.2 mg/kg添加水平下的回收率。如图6所示,PRiME HLB小柱能够有效减少畜肉及内脏样品中磷脂等杂质的干扰,使苯甲酸和马尿酸得到高回收率。HLB具有一定比例的亲水基,能够有效萃取极性酸性化合物,对苯甲酸和马尿酸吸附效果好,但用甲醇洗脱时,苯甲酸未能全部洗脱下来,回收率约为57%。C反相固相萃取小柱对苯甲酸和马尿酸吸附效果均较差,水相上样和淋洗时大部分流出,导致基本无回收。混合型阴离子色谱柱MAX和PAX具有强阴子交换作用,对苯甲酸和马尿酸具有较强的吸附保留,但由于苯甲酸的苯环与羧基共轭,形成较为稳定的苯甲酸负离子,吸附剂作用强,较难洗脱,从而导致回收较差。弱阴离子交换柱PWAX与强阴离子交换柱相比,与苯甲酸作用相对较弱,洗脱回收更好。虽然阴离子交换固相萃取小柱对马尿酸的回收率大于90%,但对苯甲酸的回收率均小于70%。综上所述,本实验选择PRiME HLB对样品进行净化,苯甲酸和马尿酸回收率分别约为105%和98%。

图6 固相萃取柱对苯甲酸和马尿酸回收率的影响(n=3)Fig.6 Effect of SPE columns on the recoveries of benzoic acid and hippuric acid (n = 3)
2.3 方法学验证
2.3.1 线性范围、检出限和定量限
该方法采用外标法定量分析,配制苯甲酸和马尿酸系列混合标准溶液进行分析,如表3所示,在苯甲酸20~1 000 ng/mL和马尿酸4~200 ng/mL质量浓度范围内线性关系良好,线性相关系数均大于0.99,线性范围良好。以3 倍信噪比及10 倍信噪比确定检出限及定量限,本方法马尿酸检出限和定量限分别为2.5 μg/kg和10 μg/kg,苯甲酸检出限12.5 μg/kg和定量限50 μg/kg,远低于GB 5009.28ü2016《食品中苯甲酸、山梨酸和糖精钠的测定》中液相色谱法检测苯甲酸的检出限(0.005 g/kg)和定量限(0.01 g/kg),有利于低含量苯甲酸的检测,具有明显优势。
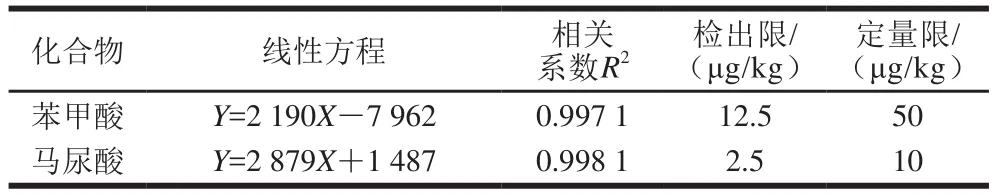
表3 苯甲酸和马尿酸的回归方程、相关系数、检出限、定量限Table 3 Regression equations, correlation coefficients, LODs and LOQs of benzoic acid and hippuric acid
2.3.2 准确度及精密度
向畜肉及内脏中按定量限、2 倍定量限和10 倍定量限浓度水平加入苯甲酸和马尿酸标准溶液,每个添加量分别做6 个平行,通过提取净化后测定其含量,计算回收率确定方法的准确度,并计算测定结果相对标准偏差(relative standard deviation,RSD)评价方法精密度。如表4所示,两种化合物的回收率在70.5%~99.7%之间,精密度RSD在0.3%~7.1%之间(=6),均小于8%,其精密度和回收率均符合实验要求。
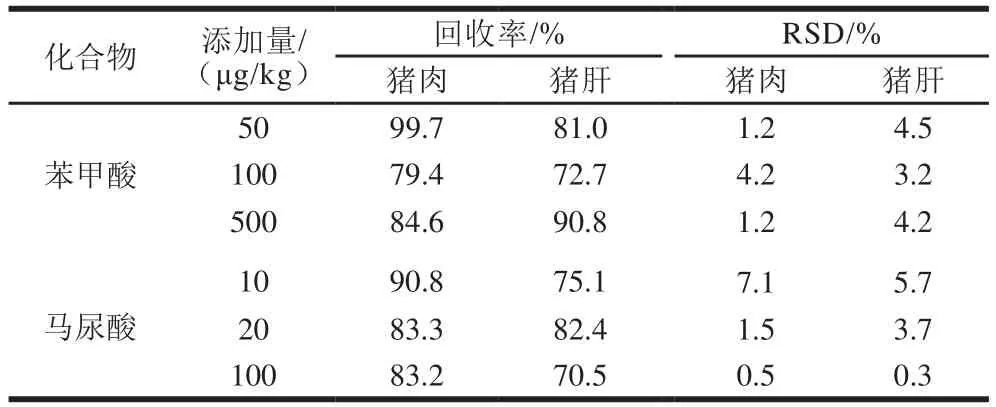
表4 不同基质中苯甲酸和马尿酸的加标回收率和精密度(n =6)Table 4 Recoveries and RSDs of benzoic acid hippuric acid spiked into different matrices (n = 6)
2.3.3 重复性和稳定性
为考察方法重复性,由3 个不同实验人员重新取苯甲酸和马尿酸3 个不同质量浓度样品溶液,计算测定结果RSD,由表5可知,重复性实验中苯甲酸和马尿酸RSD为1.1%~5.8%。在方法稳定性实验中,日内稳定性实验中对同一个样品在1 d内检测5 次,计算RSD,其范围为2.0%~6.9%。日间稳定性实验中对同一个样品在1 d内检测1 次,检测3 d,计算RSD,其范围0.7%~7.2%。结果表明该方法具有良好的重复性和日内、日间稳定性。
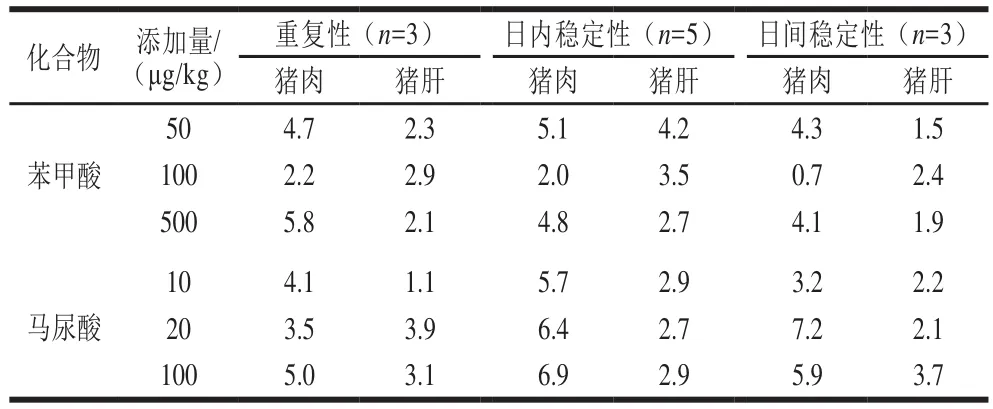
表5 不同基质中苯甲酸、马尿酸的重复性和日内、日间稳定性的RSDTable 5 Repeatability and intra- and inter-day stability of benzoic acid hippuric acid in different matrices%
2.4 实际样品检测
采用超高效液相色谱-串联质谱法对收集的5 个可疑牛肉样品进行检测,马尿酸均有检出,其中1 个牛肉样品中马尿酸含量较高,为0.013 6 g/kg;4 个样品苯甲酸检出量均超过0.010 0 g/kg,2 个样品苯甲酸检出结果甚至超过0.300 g/kg,均超过了美国农业部食品安全检验局对苯甲酸和苯甲酸钠用于畜禽产品的最大限量0.01 g/kg。
通过该方法对市售75 个样品进行检测,包括猪肉27 个、猪肝16 个、牛肉16 个、羊肉6 个、猪肾5 个和羊肾5 个。猪肉样品中苯甲酸检出率为44%,牛肉样品中苯甲酸检出率为50%,6 个羊肉样品均有检出,其中1 个猪肉样品苯甲酸检出量较高,为0.006 04 g/kg,2 个牛肉样品苯甲酸检出量较高,分别为0.019 3 g/kg和0.130 g/kg,其他样品苯甲酸检出量为52.1~198.0 μg/kg。对于马尿酸,猪肉样品中马尿酸检出率为67%,含量为30.4~251.0 μg/kg,牛肉样品中3 个样品马尿酸未检出,其余样品马尿酸检出量为25.3~726.0 μg/kg,羊肉中马尿酸检出量为193~674 μg/kg。此外,猪肝样品中苯甲酸检出量为60.5~403.0 μg/kg,马尿酸检出量为25.6~653.0 μg/kg。猪肾和羊肾样品苯甲酸检出量分别为960~5 276 μg/kg和407~690 μg/kg,马尿酸检出量分别为2 401~13 192 μg/kg和1 018~1 725 μg/kg,远高于猪肉和羊肉样品。实验结果表明,在畜肉及内脏中苯甲酸和马尿酸检出率相对较高,可能存在非法添加和过量使用饲用苯甲酸现象,且存在较大风险。
3 结 论
建立畜肉及内脏中苯甲酸和马尿酸残留的超高效液相色谱-串联质谱检测方法。该方法经甲醇涡旋提取,PRiME HLB净化,前处理操作简单、方便,上机检测时间5.5 min,快速、高效。加标实验中,在猪肉和猪肝基质中回收率在70.5%~99.7%之间。苯甲酸检出限为12.5 μg/kg、定量限为50 μg/kg,远低于GB 5009.28ü2016中液相色谱法检测苯甲酸的检出限(0.005 g/kg)和定量限(0.01 g/kg),可用于低含量苯甲酸的检测。方法学考察结果表明,该方法准确、可靠,具有良好的重复性和稳定性,可适用于大批量畜肉及内脏样品的监测分析。目前,国家标准并无针对畜肉及内脏中苯甲酸及代谢物马尿酸残留的检测方法,且未对畜肉及内脏中苯甲酸及马尿酸残留限量进行规定,不利于执法机构对违法注水添加苯甲酸及钠盐和过量饲用苯甲酸的行为进行监管。本方法的建立弥补了检测方法的空缺,为打击违法添加苯甲酸行为提供有力的技术支撑,对保障畜肉及内脏食品安全具有重要意义。

