肝内胆管癌病人肝脏手术切缘与预后的关系
尹彦江,罗治文,陈 晓,张业繁,黄 振,赵 宏,赵建军,李智宇,周健国,蔡建强,毕新宇
(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院肝胆外科,北京 100021)
肝内胆管癌 (intrahepatic cholangiocarcinoma,ICC)占所有原发性肝癌的5%~30%,是仅次于肝细胞癌的第2大肝脏原发恶性肿瘤。过去的30年里,ICC发病率在全球范围内不断攀升[1]。手术切除是唯一可能治愈ICC的方法,其5年生存率为15%~40%,但多达2/3的病人在术后复发,阳性(R1)切除、淋巴结转移、血管侵犯和多发肿瘤等都是影响术后生存和复发的不良因素[2-5]。
近年,阴性(R0)切除的切缘距离对于预后的影响受到重视,但对于最佳切缘距离目前仍存在争议[6]。本研究对ICC的预后因素展开讨论,重点探讨R0手术切缘的距离对总生存(overall survival,OS)和无复发生存(recurrent free survival,RFS)的影响,并探索手术参考切缘距离。
资料与方法
一、一般资料
回顾性分析2011年1月至2017年1月中国医学科学院北京协和医学院肿瘤医院肝胆外科ICC术后病人临床病理资料,共纳入71例。纳入标准如下:①临床病理资料完整,有随访资料;②>18岁;③既往无肝脏手术史;④无术前抗肿瘤治疗史;⑤无其他肿瘤病史;⑥组织病理学诊断为肝内胆管细胞癌。排除标准如下:①病理为肝门部胆管癌、远端胆管癌或混合性肝癌;②肝转移癌;③病理类型非腺癌;④围术期死亡者。本研究通过我院伦理委员会批准,病人及家属均签署知情同意书。
二、术前评估
本研究所有病人入院均进行血常规、肝功能、病毒学和肿瘤标志物等检查。病毒学检查包括乙肝二对半、HBV-DNA、HCV-DNA、抗HCV抗体等。血清肿瘤标志物包括甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)、CA-242。影像学检查包括胸部CT、腹部螺旋CT/CT血管造影、腹部MRI、腹部超声等。怀疑远处转移的病人建议行正电子发射计算机断层显像(positron emission tomography/computed tomography,PET-CT)检查。肝功能评估方式主要有肝脏的血清学检查和Child-Pugh评分等。
三、标准的定义
R0切除即切缘阴性,代表切缘平面无肉眼可见或显微镜下残留肿瘤;R1切除代表显微镜下可见切缘平面残留肿瘤。切缘距离为手术切缘至肿瘤主体的最短距离。本研究纳入的原始数据为病理切缘,考虑到病理标本制作过程中存在缩水情况,需将病理切缘换算为手术切缘,确保切缘距离最大程度接近术中真实数值。根据相关研究数据,当手术切缘距离<0.5 cm时,认为病理标本制作过程中不存在缩水情况;当手术切缘距离>0.5 cm时,认为病理标本制作过程中存在缩水情况,且平均缩水率为 10.00%±1.23%[7-10]。
四、随访
术后1年内每3个月随访1次,之后每3~6个月随访1次。采用门诊或电话方式随访,了解生存和复发情况。随访截止日期为2020年12月31日或病人死亡,详细记录复诊信息。
RFS期为手术至诊断肿瘤复发或转移的时间间隔。OS期为手术至病人死于癌症或最后一次随访的时间间隔。随访时间计算为手术至诊断肿瘤复发、转移、病人死亡或失访的时间间隔。
五、统计学处理
采用RStudio(运行环境R 4.0.3)软件、SPSS 26.0软件进行数据分析。R程序包包括survival、rms、survminer、ggplot 2等。正态分布的计量资料以均数±标准差表示[年龄、肿瘤最大径、手术时间、白蛋白 (albumin,ALB)、凝血酶原时间(prothrombin time,PT)],组间比较采用非配对t检验。偏态分布的计量资料以中位数表示[淋巴结清扫数、阳性淋巴结数、切缘距离、术中出血量、术中输液量、术后住院时间、CA19-9、AFP、CEA、谷氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、γ谷氨酰转移酶(gamma-glutamyl transferase,GGT)、总胆红素(total bilirubin,TBIL)],组间比较采用Mann-Whitney U检验。计数资料采用例数和百分比表示,组间比较采用方差检验或Fisher精确检验。OS期和RFS期的估计及生存曲线的绘制采用Kaplan-Meier法,组间OS、RFS期比较采用Log-Rank检验。使用Cox比例风险模型筛选影响ICC预后的独立危险因素。采用限制性立方样条(restricted cubic spline,RCS)分别探索R0切缘距离与OS期和RFS期的关系。所有统计检验基于双侧检验。P<0.05或<0.1为差异有统计学意义。
结 果
一、基线特征
病人随访时间为2~107个月,中位RFS期为8个月,中位OS期为17个月。1、3、5年的RFS率分别为 35%、20%、10%,OS率分别为 68%、38%、23%。71例病人的基本资料和临床病理学特征见表1。
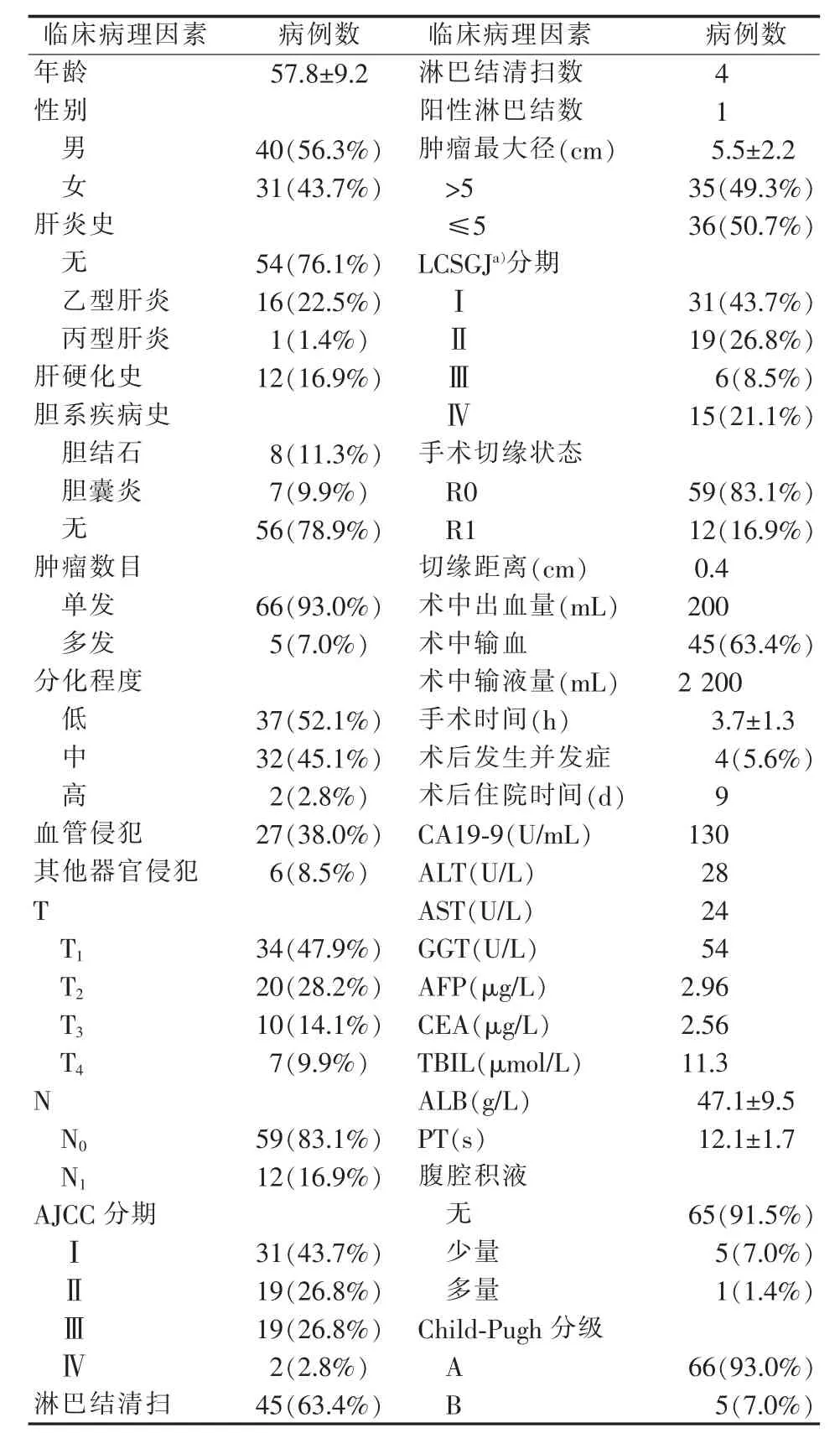
表1 基线特征
二、OS和RFS时间的影响因素分析结果
单因素Cox回归分析发现,肿瘤数目、肿瘤最大径、其他器官侵犯、淋巴结转移、美国癌症联合委员会 (American Joint Committee on Cancer,AJCC)分期、血管侵犯、手术切缘状态、GGT、AFP、CEA、CA19-9是ICC病人预后的影响因素(见表2)。其中肿瘤数目、淋巴结转移、AJCC分期、手术切缘状态、AFP、CA19-9与 OS 和 RFS期均有关 (P<0.05);血管侵犯和GGT与RFS期有关(P<0.05),但与OS期无关(P>0.05)。肿瘤最大径、其他器官侵犯、CEA与OS 期有关(P<0.05),但与 RFS 期无关(P>0.05)。

表2 OS期和RFS期的单因素Cox分析
多因素Cox回归分析发现,AJCC分期、手术切缘状态、AFP、CA19-9是ICC病人预后的独立危险因素 (见表3)。其中手术切缘状态、AFP与OS和RFS期均有关 (P<0.05);AJCC分期与RFS期有关(P<0.05),但与 OS 期无关(P>0.05);CA19-9 与 OS 期有关(P<0.05),但与 RFS 期无关(P>0.05)。 对多因素Cox回归分析纳入的变量进行多重共线性诊断,得出各变量的方差膨胀因子(variance inflation factor,VIF)均<10,条件指数(condition index)<30,变异构成(variance proportion)<0.5。结果提示各变量不存在多重共线性。
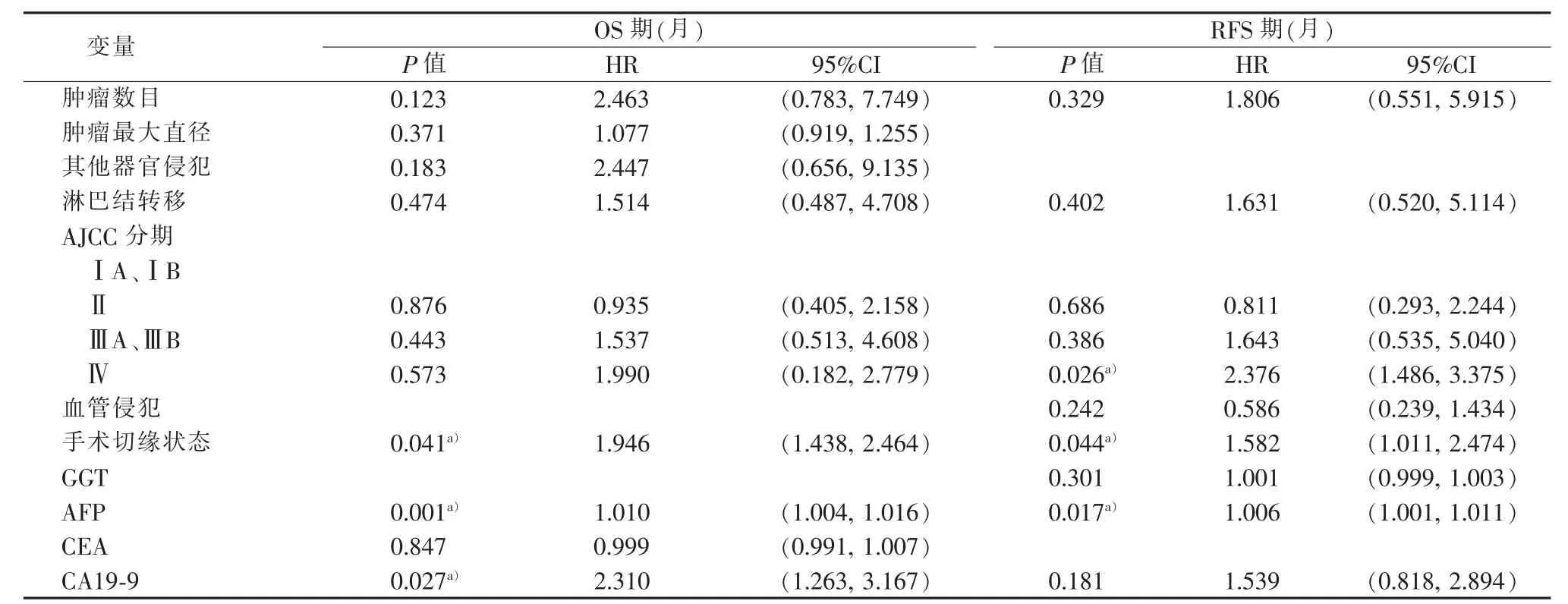
表3 OS期和RFS期的多因素Cox分析
三、切缘对OS和RFS的影响
71例ICC病人中,R1切除12例(17%),R0切除59例(83%),R0切缘距离为0.1~2.8 cm。 R0切除病人的中位RFS期为 10个月,1、3、5年的RFS率分别为37%、22%、12%;中位OS期为18个月,1、3、5年的OS率分别为68%、42%、27%。R1切除病人的中位 RFS期为 5个月,1、3、5年的RFS率分别为 17%、8%、0;中位 OS期为 13个月,1、3、5年的OS率分别为66%、17%、0。用Kaplan-Meier法绘制R0切除和R1切除的生存曲线(见图1),用Log-Rank检验比较组间OS、RFS。结果显示,R1切除预示着较差的RFS期(P=0.025)和OS期(P=0.030)。对R1切除与R0切除病人的术前临床病理因素进行比较,得出当病人肿瘤单发、AJCC分期或日本肝癌研究组(Liver Cancer Study Group of Japan,LCSGJ)分期处于Ⅰ期、Ⅱ期时,病人达到R0切除的可能性更大(P<0.05)(见表4)。

表4 R0和R1切缘病人术前临床病理数据特征

图1 ICC术后的RFS和OS曲线
分别在RFS和OS的10、50、90百分位数处取3个节点,使用RCS探索R0切缘距离与RFS、OS之间的关系(见图2)。经RCS分析确定,当切缘距离以0.5 cm为界时,两侧的术后复发风险差异有统计学意义 (P<0.1)。当切缘距离为0.1~0.5 cm,HR>1,说明此时ICC术后复发率升高;切缘距离为0.5~2.8 cm,HR<1,说明此时 ICC 术后复发率降低。另经分析可确定,当切缘距离以0.3 cm或0.7 cm为界时,两侧的术后死亡风险差异无统计学意义(P>0.1)。 当切缘距离为 0.1~0.3 cm,HR<1,说明此时ICC术后死亡率降低;切缘距离为0.3~0.7 cm,HR>1,说明此时ICC术后死亡率升高;当切缘距离为0.7~2.8 cm,HR<1,说明此时术后死亡率降低。
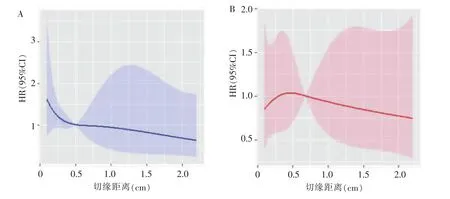
图2 RCS分析结果
四、探究参考R0切缘距离对预后的意义
使用Kaplan-Meier法分析RCS方法得出的参考切缘距离对预后的意义(见图3)。以0.5 cm为界,将R0切缘病人分为宽切缘组 (0.5 cm<X1<2.8 cm,29例) 和窄切缘组 (0.1 cm<X2≤0.5 cm,30例)。Kaplan-Meier法分析发现,宽切缘组病人的RFS期较窄切缘组更长(P=0.015),而宽切缘组病人的OS期与窄切缘组相比,差异无统计学意义(P=0.912)。

图3 不同切缘距离的RFS和OS曲线
比较宽切缘组与窄切缘组病人术中和术后的部分临床数据特征。最终发现两组的术中出血量、术中输液量、手术时间、术后住院时间、复发方式的差异均无统计学意义(P<0.05)(见表5)。

表5 宽切缘与窄切缘病人术中和术后的部分临床数据
讨 论
目前手术切除是治疗ICC最有效的手段,既往研究发现R1切除、淋巴结转移、血管侵犯和多发肿瘤等都是影响术后生存和复发率的不良因素。本研究通过Cox回归分析发现,AJCC分期、手术切缘状态、AFP、CA19-9是ICC病人预后的独立危险因素。将病人分为R1切除组和R0切除组,通过比较术前临床病理因素,笔者得出当肿瘤单发、AJCC分期或LCSGJ分期处于Ⅰ期、Ⅱ期时,达到R0切除的可能更大。在临床实践中,达到R0切除是实现ICC病人长期生存的唯一治疗选择[11-13],但关于R0切除切缘距离的研究目前仍有争议[14]。既往研究大多提示切缘距离>1.0 cm有利于长期预后[15-18]。通过一项多中心平台研究,Spolverato等[19]发现R0切缘距离>1.0 cm明显增加病人RFS期和OS期。国内也有研究发现宽切缘的根治性肝切除术对预后的积极作用[20]。但有研究指出,大范围肝切除对术后生存并无获益[21-23]。Bartsch等[24]研究发现,肝切除切缘距离对ICC预后无明显影响,并指出过度手术会增加术后并发症发生风险。本研究重点探讨R0手术切缘距离对OS和RFS的影响,并对手术切缘推荐距离的预后意义进行探索。
本研究纳入的原始数据为病理切缘,考虑到病理标本制作过程中存在缩水情况,将病理切缘换算为手术切缘。通过RCS,将R0切缘病人分为宽切缘组(0.5 cm<X1<2.8 cm,29 例)和窄切缘组(0.1 cm<X2≤0.5 cm,30例)。其中窄切缘组的中位RFS期为8个月,中位OS期为16个月;宽切缘组的中位RFS期为11个月,中位OS期为18个月。通过Kaplan-Meier法分析发现,宽切缘组病人的RFS期较窄切缘组更长(P=0.015),而宽切缘组病人的OS期与窄切缘组差异无统计学意义(P=0.910)。研究表明ICC特殊的扩散机制和缺乏肿瘤包膜的特点易导致肿瘤周围出现组织侵犯,进而术后出现肝内转移和脉管侵犯[25-27],故术中采用宽切缘切除肿瘤会降低肿瘤复发风险。同时通过随访,推测窄切缘组病人较高的复发率,促使其更积极地接受定期复查及后续的治疗措施,这可能是两组病人长期生存率差异无统计学意义的潜在原因。
ICC术中为获得根治性切除,倾向于切除更大范围的肝脏。但一方面ICC病人自身耐受程度不同;另一方面部分病人有肝硬化等肝胆系统疾病史,过度损伤癌旁正常肝组织对预后无益,相反增加围术期并发症的发生[28-29]。本研究比较宽切缘组与窄切缘组病人术中和术后的部分临床数据特征,发现两组的术中出血量、术中输液量、手术时间、术后住院时间、复发方式的差异均无统计学意义,在一定程度上证明采取>0.5 cm至<2.8 cm的手术切缘并不会增加术后并发症发生的风险。
综上所述,当ICC病人肿瘤单发、AJCC分期或LCSGJ分期处于Ⅰ期、Ⅱ期时,达到R0切除的可能更大。对于这部分病人,推荐肝切除时至少实现0.5 cm以上的R0手术切缘距离,以改善预后。本研究为单中心的回顾性研究,局限性如下:①样本量较少,可能存在一定的选择偏倚;②未统计术中具体肝切除范围和手术方式;③研究变量有不同程度的数据缺失。因此,有待大样本、多中心的前瞻性对照试验对R0手术切缘的距离选择进行更深入的探讨。

