碳酸酐酶在红细胞分化发育过程中的功能研究
吴静, 张英楠, 徐长禄, 刘金花, 石莉红
中国医学科学院血液病医院(中国医学科学院血液学研究所),北京协和医学院,实验血液学国家重点实验室;国家血液系统疾病临床医学研究中心;细胞生态海河实验室,天津 300020
截至目前,输血仍是临床实践中不可或缺的一种治疗方法。根据前期的研究数据,在62个国家中,血液供应几乎全部(99.9%以上)来源于无偿献血[1],但是由于人口老龄化,未来50年内老年人(大于65岁)的数量会迅速增加,需要输血的人数会随之增加,同时由于全球生育率的下降,符合献血资格的捐献者会进一步减少[2],需要输血者和血液捐献者之间的数量不平衡会造成血液制品的供应不足,促使人们探究在体外进行红细胞的诱导分化和扩增。但是,在体外诱导各种干细胞或红系前体细胞分化为成熟红细胞的过程中,脱核效率低是一个非常普遍的问题[3],这为体外红细胞的生产增加了难度。所以,为了解决这些难题,体外红细胞扩增和分化相关的机制研究显得至关重要。
碳酸酐酶 1(carbonic anhydrase 1,CA1)和碳酸酐酶2(carbonic anhydrase 1,CA2)属于碳酸酐酶CA(carbonic anhydrase)家族成员。在人类细胞中一共有16种CA同工酶表达,它们具有不同的细胞/组织定位和酶学特征[4]。CA是一种催化二氧化碳可逆性水合的含锌酶[5],这一反应对于许多生理过程都至关重要,其中包括pH和碳酸氢盐稳态的维持、呼吸、骨代谢和肿瘤发生[6]。在人类红细胞中主要存在碳酸酐酶1和碳酸酐酶2这两种同工酶,而且其表达量仅次于血红蛋白[7],但目前在红细胞中有关CA1和CA2的研究主要集中在其二氧化碳水合功能,关于其在红系分化中的功能研究还相对不足。
红细胞是在哺乳动物的胚胎发育过程中最早产生的一种血细胞类型,对胚胎的整个发育具有重要的支持作用。成年期的红细胞生成主要可分为3个阶段:第一阶段(早期红系分化)是指造血干细胞向红系祖细胞[BFU-E(burst forming uniterythroid)和CFU-E(colony forming unit-erythroid)]分化的阶段;第二阶段(终末期红系分化)指红系终末分化和晚期红细胞的去核过程,包括原始红细胞、早幼红细胞、中幼红细胞和晚幼红细胞;第三阶段(成熟阶段)主要指网织红细胞向成熟红细胞的发育阶段[8]。另外,红系分化整个过程会伴随着一系列的变化,包括细胞体积的缩小、血红蛋白类型的转化、染色质固缩等,由此可见,红系分化的过程是十分复杂的,所以研究红系分化的调控对体外红细胞的生成具有非常重要的意义。
为了深入研究CA1和CA2在红系分化中的功能,本研究在脐带血来源的CD34+向红系分化的过程中敲降CA1和CA2的表达,然后通过流式检测CD71+CD235a+细胞的比例,研究在CA1和CA2被敲降后,CD34+细胞向红系的分化过程,以期探讨CA1和CA2在红系分化中发挥的功能。
1 材料和方法
1.1 仪器与试剂
流式细胞仪LSR-Ⅱ(美国BD公司);shRNA质粒由擎科生物构建(载体为pSIH1-H1-copGFP,shRNA序列见表1):CD71、CD235a抗体购自BD公司;293T细胞、HEL细胞购自ATCC细胞库(https://www.atcc.org/);CD34+细胞来源于中国医学科学院血液病医院(中国医学科学院血液学研究所)生物样本库;FuGENE®HD转染试剂购自Promega公司;胎牛血清(fetal bovine serum,FBS)、Opti-MEM减血清培养基、培养基DMEM(Dulbecco′s modified eagle medium)、L-谷氨酰胺、青霉素-链霉素抗生素、丙酮酸钠试剂购自Gibco公司;细胞培养基IMDM(Iscove′s modified dulbecco′s medium)、肌醇、叶酸、硫代甘油、硝酸亚铁、硫酸亚铁、氢化可的松(hydrocortisone,HC)、白细胞介素-3(interleukin-3,IL-3)购自Sigma公司;BIT营养液购自StemCell Technologies公司;干细胞因子(stem cell factor,SCF)购自Prospec公司;重组人促红细胞生成素(erythropoietin,EPO)购自Pro-Tech公司;TRIZol购自Invitrogen公司;SYBR Green PCR试剂盒购自Applied Biosystems公司;CD34磁珠购自Miltenyi Biotech公司,psPAX2及pMD2.G质粒由周家喜研究员课题组惠赠。

表1 本研究shRNA序列Table 1 shRNA sequences in this study
1.2 细胞培养与条件
1.2.1 人脐带血来源CD34+细胞体外分化培养在第0~8天(Day 0~8),在红系分化基础培养基[9]中加入 SCF(100 ng·mL-1)、EPO(3 UI·mL-1)、IL-3(5 ng·mL-1)、HC(10-6mol·L-1),1% 青霉素-链霉素;在第8~14天(Day 8~14),在红系分化基础培养基中加入SCF(100 ng·mL-1)、EPO(3 UI·mL-1)、1%青霉素-链霉素[9]。
1.2.2 293T及HEL细胞的培养 293T细胞培养基:DMEM基础培养基中加入10%FBS、1%青霉素-链霉素、1%L-谷氨酰胺、1%丙酮酸钠;HEL细胞培养基:IMDM基础培养基中加入10%FBS、1%青霉素-链霉素。
1.3 慢病毒包装
1.3.1 用脂质体包装慢病毒 包病毒体系:A液:Opti-MEM 516µL,FuGENE®HD 34.5µL;B液:Opti-MEM 150µL,psPAX23.75µg,pMD2.G 1.25µg,目的质粒5µg。A液配制完成后室温静置5 min,再与B液混合,二者混匀后室温静置15 min,然后加于293T细胞中[10]。
1.3.2 慢病毒浓缩及感染细胞 病毒包装48 h后收集病毒上清于15 mL离心管中,3 000 r·min-1,4℃离心15 min以去除细胞碎片,收集离心后的病毒上清于无菌病毒管中,置于预冷的超高速离心机中,20 000 r·min-1,4 ℃离心2 h。离心后获得的病毒沉淀用DMEM培养基重悬(与病毒上清体积比为1∶100)。并按照细胞数量加入到HEL及CD34+(分化培养至第4天)细胞悬液中,37℃,1 420 g离心1 h,感染后细胞置于恒温37℃,5% CO2培养箱中培养,细胞密度为2×105个·mL-1。
1.4 流式检测
将细胞从培养皿中取出,离心后弃上清,标记抗人CD71-APC及CD235a-PE抗体,在4℃孵育30 min后,用1×PBS缓冲液洗涤,使用流式细胞仪LSR-Ⅱ进行检测,检测结果通过FlowJo V10(https://www.flowjo.com/)软件进行分析。
1.5 RNA提取及RT-qPCR
利用 TRIZol法[11]进行 RNA 提取,然后利用Qiagen公司生产的反转录试剂盒得到cDNA,并利用Applied Biosystems公司生产的SYBR Green PCR试剂盒进行RT-qPCR。
1.6 统计分析
实验所得数据利用Graphpad Prism 8(https://www.graphpad-prism.cn/)软件制作图表,采用单因素方差分析(One-way analysis of variance,ANOVA)进行统计学分析,实验数据以平均值±标准误(±SEM)表示,以P<0.05认为具有统计学意义。
2 结果与分析
2.1 CA1和CA2基因在红细胞中的表达情况及在红系分化过程中的变化
基于本团队前期发表的人骨髓各谱系血细胞单细胞转录组数据[12]发现,在造血谱系表达的CA家族基因中,大部分基因均表达极低甚至不表达,仅个别基因存在特异性表达现象。其中,CA1和CA2仅在红细胞中呈现显著高表达(图1A),提示CA1和CA2在红系分化发育的过程中可能发挥至关重要的作用。为了进一步深入探究CA1和CA2在红系分化发育过程中的表达情况,借助红细胞分化发育各阶段的转录组分析数据[13],发现在整个红系分化的过程中,CA1和CA2的表达呈现出动态变化,主要体现为在原始红细胞向网织红细胞发育的过程中,二者都表现出先升高后降低的趋势,但是在原始红细胞和早幼红细胞阶段,CA2表达高于CA1,随着分化的持续进行,CA1表达逐渐高于CA2(图1B)。
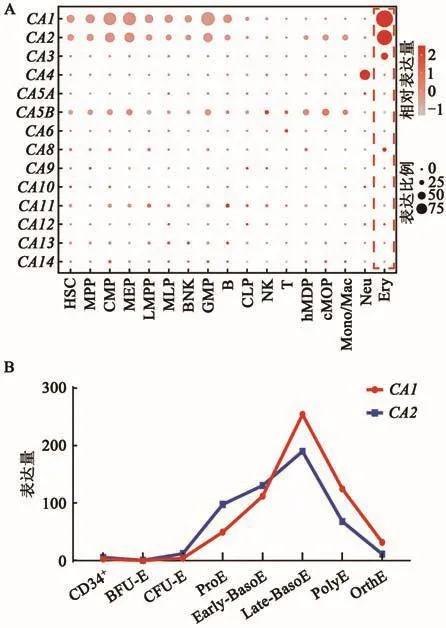
图1 CA家族基因在人类各造血细胞中的表达情况及CA1、CA2在红系分化过程中的动态变化过程Fig.1 The expression of CA family genes in each human hematopoietic lineage and the dynamic changes of CA1 and CA2 during erythroid differentiation
2.2 CA1和CA2的敲降
为了研究CA1与CA2在红细胞分化过程中的功能,本研究首先构建了二者的敲降载体,针对CA1构建了CA1-sh1、CA1-sh2、CA1-sh3 3种shRNA,针对CA2构建了CA2-sh1、CA2-sh2两种shRNA。为了验证所构建的shRNA的敲降效率,在HEL细胞系中进行了CA1和CA2敲降效率的验证实验。向处于对数生长期的HEL细胞中加入慢病毒颗粒,收集感染48 h后的细胞提取RNA,反转录后进行RT-qPCR检测CA1与CA2的敲降效率。实验结果表明,与对照Scrambled相比,CA1、CA2在转录组水平得到了明显的敲降(图2)。以上结果表明,在本实验体系中,CA1-sh1、CA1-sh2、CA1-sh3以及CA2-sh1、CA2-sh2均具有较好的敲降效果。
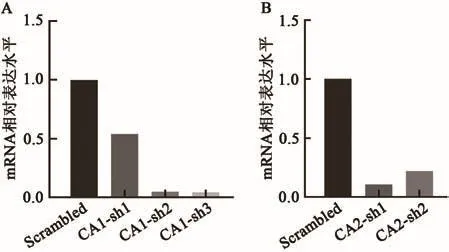
图2 HEL细胞中检测CA1和CA2的敲降Fig.2 Detection of the CA1 and CA2 knockdown in HEL cells
2.3 CA1在CD34+细胞向红系分化过程中的作用
CD71和CD235a是常用的红细胞标记物[14],CD71主要表达于BFU-E、CFU-E、原始红细胞、早幼红细胞、中幼红细胞和晚幼红细胞,CD235a主要表达于原始红细胞、早幼红细胞、中幼红细胞、晚幼红细胞、网织红细胞和成熟红细胞,所以在红细胞分化成熟的过程中,CD235a的表达量逐渐升高,CD71的表达量逐渐下降[15]。
为了研究体外CA1对CD34+细胞向红系分化的影响,本研究利用慢病毒系统对CD34+细胞中的CA1进行敲降。从脐带血中分离CD34+细胞后,用红细胞体外分化体系进行细胞培养,在分化第4天(Day 4)时进行慢病毒感染,其中Scrambled作为对照组。在分化第8天(Day 8)、第11天(Day 11)和第14天(Day14)时分别利用流式细胞仪检测CD71与CD235a的表达情况(图3A~B),并使用FlowJo V10和Graphpad Prism 8对结果进行分析(图3C~D)。流式结果显示,在敲降CA1的Day11开始,CD71+CD235a+细胞的比例明显下降(图3B)。该结果提示CA1表达的缺陷抑制了CD34+细胞向红系分化,而且主要在红系分化的后期发挥作用,这与CA1在红系分化中的动态表达数据是一致的(图1B)。此外,CD71-CD235a-细胞的比例从Day8开始出现升高(图3D),提示在CD34+细胞分化的早期阶段也可能存在阻滞。

图3 CA1的敲降对CD34+细胞分化的影响Fig.3 The effect of CA1 knockdown on differentiation of CD34+cells
2.4 CA2在CD34+细胞向红系分化过程中的作用
为了研究CA2对CD34+细胞向红系分化的影响,本研究同样采用2.3的方法对CA2的表达进行敲降,并在Day 8、Day 11和Day 14时流式检测CD71+CD235a+细胞的比例(图4A)。结果显示,CA2的表达水平降低后CD71+CD235a+细胞的比例在Day 8、Day 11和Day 14均具有较明显的下降趋势(图4B),由此提示CA2表达的降低将红细胞的分化阻滞在了原始红细胞阶段,与CA1相比,CA2在红系分化的更早阶段即原始红细胞阶段便已经开始发挥作用,这一结论也与红系分化早期CA2的表达高于CA1的结果保持一致(图1B)。同时与CA1相似,敲降CA2后,CD71-CD235a-细胞的比例在Day 8、Day 11和Day 14也具有较明显的增加(图4C),提示CA2的敲降对CD34+细胞早期阶段的分化也可能具有阻滞作用。
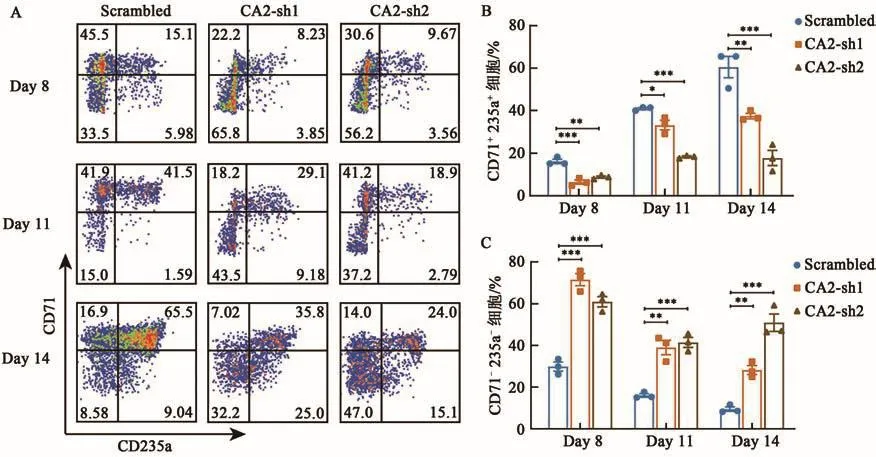
图4 CA2的敲降对CD34+细胞分化的影响Fig.4 The effect of CA2 knockdown on differentiation of CD34+cells
3 讨论
体外人工诱导红细胞生成主要有3种不同的干细胞来源:造血干细胞、胚胎干细胞和诱导多能干细胞[16],本研究中体外分化的红细胞来源于脐带血中CD34+造血干细胞,这是在红细胞分化相关研究中比较常用的一种细胞来源[17],与其他几种干细胞来源相比,脐带血来源CD34+细胞具有更加明显的优势,因为它们在向红细胞诱导分化的过程中更容易实现脱核。
本研究主要探究了碳酸酐酶家族成员CA1和CA2对红系分化的调控作用。碳酸酐酶于20世纪30年代被发现,它在各种疾病的病理生理学中都发挥了重要作用,如溶血性贫血、青光眼、肾小管酸中毒、骨质疏松症、神经性疼痛、结直肠癌等[18-19],但其在红系分化中调控功能的研究仍不够深入。已有研究表明,在小鼠红白血病细胞系和人红白血病细胞系中,CA1和CA2仅在分化起始时有较高的表达水平,而在正常人的红系祖细胞中,CA1和CA2的表达水平随着细胞分化的进行有上升趋势[20]。另有研究表明,在小鼠红白血病细胞系中,CA1的过表达可以抑制小鼠红白血病细胞系细胞分化并使它们保持在增殖状态,其中CA1可能作为c-Myb下游分子发挥作用[21]。所以CA1和CA2可能在正常红系分化和红白血病细胞系的分化过程中发挥着不同的调控作用。现有研究表明,GATA1是红细胞生成过程中非常重要的转录因子,它可在转录水平调节红细胞的成熟和功能[22],因此,CA1和CA2是否也在GATA1的调控下在红系发育中发挥功能,还有待进一步研究。本研究利用shRNA技术[23-25]在人脐带血来源CD34+细胞体外向红系诱导分化过程中对CA1和CA2进行敲降,通过流式细胞仪检测红系特异性标志物评估细胞的分化效率,结果显示,CA1和CA2的敲降明显抑制了红系的分化,而且二者发挥作用的时间有所不同,CA1敲降后CD71+CD235a+细胞的比例在Day 11和Day 14具有明显的下降,CA2敲降后CD71+CD235a+细胞的比例在Day 8、Day 11和Day 14均具有明显的下降。
综上,本研究证明了CA1和CA2对红系分化均具有重要调控作用,其中CA1主要在红系分化的后期发挥较强的调控作用,CA2则在原始红细胞阶段便已开始发挥作用,这一发现将为红系分化调控的后续研究提供重要的理论依据,但是,CA1和CA2调控红系分化的具体机制以及碳酸酐酶家族的其他成员是否也参与了红系分化的调控还需要更进一步探索。

