右美托咪定对肠源性脓毒症大鼠肠黏膜屏障的影响及其机制
王 玥,王建刚
(1山西医科大学麻醉学院麻醉教研室,太原 030001;2山西医科大学第一医院麻醉科;*通讯作者,E-mail:2676083197@qq.com)
脓毒症是由细菌等病原微生物侵入机体导致的全身性炎症反应综合征,而肠道是脓毒症全身反应的启动器官[1]。据报道,脓毒症可激活Wnt/β-catenin信号通路并损伤肠黏膜机械屏障,大量炎症因子释放引起瀑布效应促进脓毒症恶化[2,3]。右美托咪定(dexmedetomidine,DEX)具有抗炎、保护肠道通透性和肠道屏障等功能[4],但具体机制尚不明确。本研究拟探究DEX对肠源性脓毒症产生保护作用的机制,对于临床治疗脓毒症提供依据。
1 材料及方法
1.1 实验动物及分组
8~9周龄雄性SD大鼠60只,体质量250~300 g,由山西医科大学实验动物中心提供,SPF级,生产许可证号SCXK(晋)2019-0005。实验前禁食24 h,不限饮水。按照随机数字表法分为对照组、脓毒症组和DEX组,每组20只。脓毒症组和DEX组均以盲肠结扎穿孔法建立脓毒症模型,DEX组腹腔注射DEX,对照组仅暴露盲肠,不做结扎及穿孔。
1.2 主要试剂
右美托咪定(200 μg/2 ml),批号:210804BC,国药准字:H20090248,购自江苏恒瑞医药股份有限公司;Wnt3a蛋白单克隆抗体、β-连环蛋白单克隆抗体、细胞周期蛋白D1单克隆抗体、闭合蛋白单克隆抗体以及闭锁蛋白单克隆抗体均购自英国Abcam公司;酶联免疫吸附法(ELISA)IL-1β、TNF-α、IL-6试剂盒购自武汉华美生物工程有限公司。
1.3 脓毒症大鼠模型的建立
结扎盲肠并穿孔建立SD大鼠脓毒症模型[1]。具体操作方法:腹腔注射戊巴比妥钠(45 mg/kg)麻醉大鼠:切开腹壁,暴露盲肠,于回盲瓣的远端(距盲肠尖端1 cm处)将盲肠用4-0丝线紧密结扎并用针穿刺造成肠道损伤,从损伤口轻轻挤压挤出穿孔部位少许粪便,尽量保证挤出粪便量一致(直径约为1 mm的小液滴),完成后闭合手术切口。对照组仅暴露盲肠远端,不做结扎、不穿孔。给予无菌生理盐水溶液(24 ml/kg)皮下注射;模型建立成功后,DEX组即刻腹腔注射40 μg/kg DEX(8 ml/kg,5 μg/ml),对照组以及脓毒症组腹腔注射等体积的生理盐水后使大鼠自然苏醒。实验期间不使用任何抗生素。
1.4 肠组织病理学观察
分别于脓毒症模型建立成功24 h后使用戊巴比妥钠腹腔注射处死大鼠(每组5只),手术切取空肠组织,甲醛固定、常规石蜡包埋,切片,HE染色。光学显微镜下观察肠组织切片。
1.5 ELISA试剂盒检测大鼠血清炎症因子IL-6、TNF-α、IL-1β的浓度
末次给药后24 h,尾静脉采血1.5 ml,3 000 r/min,4 ℃离心20 min后收集上清,按照ELISA试剂盒说明书操作,包被后封闭、加样、孵育酶标抗体(抗体稀释比例均为1 ∶100),加底物工作液、终止液,测量血清中炎症因子(IL-6、TNF-α、IL-1β)的浓度。
1.6 Western blot检测大鼠肠组织Wnt3a、β-catenin、Cyclin D1、ZO-1、Occludin蛋白的表达量
将空肠组织蛋白(RIPA试剂提取)与上样缓冲液(SDS)混合煮沸;电泳分离蛋白样品;凝胶转至聚偏氟乙烯膜;膜在室温下加脱脂奶粉封闭;加入一抗:兔抗Wnt3a单克隆抗体、兔抗β-catenin单克隆抗体、兔抗Cyclin D1单克隆抗体、兔抗β-actin单克隆抗体,兔抗ZO-1单克隆抗体、兔抗Occludin单克隆抗体(稀释比例均为1 ∶4 000),冰箱冷藏孵育过夜;加入山羊抗兔二抗(1 ∶10 000),室温孵育2 h,化学发光法显色,灰度值分析后得到各蛋白相对表达水平。
1.7 免疫组化染色观察大鼠肠组织Wnt3a、β-catenin、Cyclin D1的表达
石蜡切片脱蜡至水;抗原修复;过氧化氢处理;牛血清白蛋白(BSA)封闭;加入一抗:兔抗Wnt3a单克隆抗体、兔抗β-catenin单克隆抗体、兔抗Cyclin D1单克隆抗体、兔抗β-actin单克隆抗体,兔抗ZO-1单克隆抗体、兔抗Occludin单克隆抗体(稀释比例均为1 ∶200);加入山羊抗兔二抗(1 ∶10 000);二氨基联苯胺(DAB)显色;复染细胞核;脱水封片;置于显微镜下观察并采集图像。
1.8 统计学分析
计量资料符合正态分布,均以均值±标准差表示,使用SPSS24.0软件分析处理数据。组间数据比较采用单因素方差分析,两两比较用LSD法,以P<0.01为差异具有统计学意义。
2 结果
2.1 HE染色观察肠黏膜病理学表现
HE染色检查结果显示,对照组大鼠肠黏膜完整,绒毛结构排列规律且紧密,不存在肠黏膜损伤;脓毒症组肠组织结构混乱,存在严重的黏膜绒毛水肿和上皮细胞脱落以及中性粒细胞浸润;与脓毒症组比较,DEX组可见肠道病理损伤明显改善,组织水肿得到显著改善,绒毛排列较为整齐,肠道黏膜屏障较好,中性粒细胞浸润明显减少(见图1)。

图1 各组大鼠肠道黏膜病理学变化 (×200)Figure 1 HE staining of intestinal mucosa in each group (×200)
2.2 大鼠血清中IL-1β、IL-6、TNF-α浓度结果
与对照组相比,脓毒症组大鼠血清中TNF-α、IL-1β、IL-6水平增高(P<0.01);与脓毒症组相比,DEX组TNF-α、IL-1β、IL-6水平降低(P<0.01,见表1)。
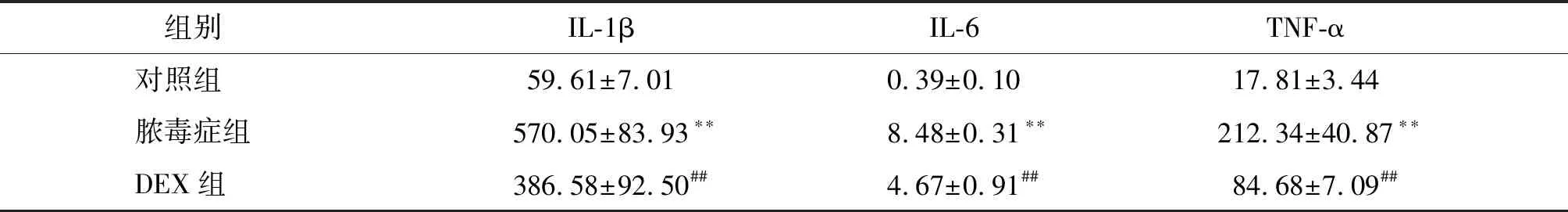
表1 大鼠血清中IL-1β、IL-6、TNF-α浓度 (pg/ml,n=20)
2.3 Western blot检测各组大鼠肠黏膜组织Wnt3a、β-catenin、Cyclin D1、ZO-1、Occludin蛋白表达结果
与对照组相比,脓毒症组大鼠肠黏膜组织β-catenin、Cyclin D1、Wnt3a的蛋白表达水平明显增高(P<0.01),ZO-1和Occludin蛋白表达水平明显降低(P<0.01);与脓毒症组相比,DEX组大鼠肠黏膜组织β-catenin、Cyclin D1、Wnt3a的蛋白表达水平均明显降低(P<0.01),ZO-1和Occludin蛋白表达水平明显增高(P<0.01,见图2)。
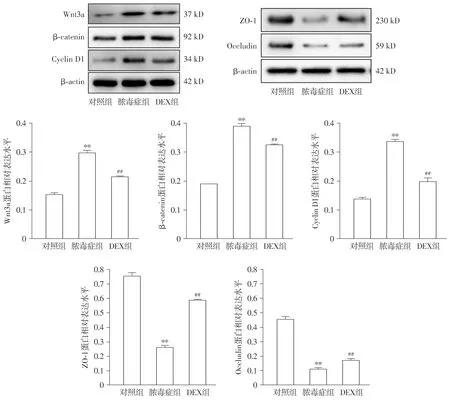
与对照组比较,**P<0.01;与脓毒症组比较,##P<0.01图2 大鼠肠道组织Wnt3a、β-catenin、Cyclin D1、ZO-1、Occludin蛋白表达Figure 2 Expression of Wnt3a, β-catenin, Cyclin D1, ZO-1 and Occludin in rat intestinal tissue
2.4 免疫组化染色各组大鼠肠黏膜组织Wnt3a、β-catenin和Cyclin D1蛋白表达结果
免疫组化法观察显示,Wnt3a蛋白主要位于细胞质或内质网中(呈深褐色),β-catenin蛋白主要位于细胞质和细胞骨架中(呈黄褐色),Cyclin D1蛋白主要位于细胞质中(呈黄褐色,见图3)。与对照组比较,脓毒症组肠黏膜组织Wnt3a、β-catenin和Cyclin D1蛋白表达水平均显著升高(P<0.01);与脓毒症组相比,DEX组肠黏膜组织β-catenin、Cyclin D1、Wnt3a表达水平均明显降低(P<0.01,见图4)。

图3 大鼠肠组织Wnt3a、β-catenin和Cyclin D1蛋白表达结果 (×400)Figure 3 Expression of Wnt3a, β-catenin and Cyclin D1 in rat intestinal tissue (×400)

与对照组比较,**P<0.01;与脓毒症组比较,##P<0.01图4 免疫组化染色检测各组大鼠肠组织Wnt3a、β-catenin和Cyclin D1蛋白表达Figure 4 Immunohistochemical staining of Wnt3a, β-catenin and Cyclin D1 protein expression in the intestinal tissues of rats in each group
3 讨论
脓毒症是国内外重症医学界研究的热点问题。世界卫生组织2017报告中指出年全世界有4 800万例脓毒症病例和1 100万例脓毒症相关的死亡,占全球死亡总数的近20%。全世界大约85%的脓毒症病例发生在低收入和中等收入国家。肠道作为人体内最大细菌贮存的场所,在脓毒症发生发展过程中具有重要的作用。机体健康的情况下,肠道内的细菌无损害作用;肠黏膜被损害时,细菌迁移进入肠系膜及其淋巴组织甚至血液中,引发全身性的脓毒症[5]。因此,肠黏膜屏障的结构及功能至关重要,保护其完整性可缓解肠源性脓毒症的症状,改善预后[6]。
脓毒症发生时内毒素入血,刺激血液中的炎性细胞分泌炎症因子,这些因子一方面可对机体的组织细胞产生炎性损伤;另一方面,可进一步刺激机体产生更多的炎症因子,最终导致“瀑布效应”,这种恶性循环进一步导致脓毒症恶化[7]。而Wnt/β-catenin信号通路可调控炎症因子释放,并有研究证实抑制Wnt/β-catenin信号通路中Wnt3a、β-catenin和cyclin D1蛋白的表达可以降低TNF-α等炎性因子的产生,缓解脓毒症所导致的机体器官损伤[2,8]。大量文献及临床研究表明,DEX的抗炎等作用对脓毒症的治疗具有积极意义[9]。本实验HE染色结果证明脓毒症组大鼠肠道组织结构混乱,存在严重的黏膜绒毛水肿,上皮细胞脱落,中性粒细胞浸润。与脓毒症组比较,DEX组可见肠道组织水肿减轻,绒毛排列较为整齐,肠道病理损伤明显缓解。同时本研究ELISA结果与文献中[10]DEX对脓毒症释放炎症因子的调控作用结果一致,即与脓毒症组相比,DEX组TNF-α、IL-1β、IL-6水平降低,DEX可有效减少促炎因子的释放,从而改善脓毒症预后。
本实验同时对Wnt/β-catenin信号通路与紧密连接蛋白进行了检测,探讨在脓毒症的发生发展过程中DEX是否会通过影响Wnt/β-catenin信号通路与紧密连接蛋白缓解脓毒症症状。Western blot检测结果和免疫组化染色结果共同提示:与对照组相比,脓毒症组大鼠肠黏膜中Wnt3a、β-catenin和Cyclin D1的蛋白表达水平显著升高;与脓毒症组相比,腹腔注射DEX的大鼠肠黏膜中Wnt3a、β-catenin和Cyclin D1的蛋白表达水平明显降低。表明DEX可能参与并抑制了Wnt/β-catenin信号通路,从而减少了炎性因子的表达,发挥对肠黏膜的保护作用。
在肠源性脓毒症导致机体应激时,细胞间的连接遭到破坏,肠黏膜屏障功能缺失,细菌经过细胞旁间隙进入机体,这将促进脓毒症的发展进程[11]。肠黏膜细胞与细胞间的常见连接方式有紧密、黏附、缝隙连接等[12]。ZO-1是紧密连接结构的骨架成分,Occludin在维持紧密连接屏障中起关键作用,研究表明,在体内和体外肠上皮细胞中,Occludin的缺失将导致大分子的选择通透性增加[13,14],造成肠道屏障功能损伤。本实验Western blot检测结果提示:与对照组相比,脓毒症组大鼠肠黏膜中ZO-1蛋白和Occludin蛋白表达水平显著降低,与脓毒症组相比较,DEX组大鼠肠黏膜中ZO-1蛋白和Occludin蛋白表达水平明显升高。表明DEX参与促进紧密连接蛋白的表达,证实了DEX的肠道黏膜保护作用。
综上所述,本实验初步证明脓毒症大鼠肠损伤有Wnt/β-catenin信号通路参与,DEX参与并抑制Wnt/β-catenin信号通路,从而发挥对肠道的保护作用,并调控相关炎症介质的释放。同时,DEX对紧密连接蛋白ZO-1和Occludin的调控作用,可改善肠道黏膜屏障的完整性,并抑制内毒素和细菌的移位。因此得出结论,右美托咪定通过Wnt/β-catenin信号通路及紧密连接蛋白对脓毒症肠黏膜屏障损伤产生保护作用,这对于临床治疗脓毒症具有积极意义。

