高浓度CO2与磷浓度对葛仙米生长和光合作用的耦合效应
郭宏勇 朱俊杰 沈伊洁 王茜 金鹏 夏建荣
(广州大学环境科学与工程学院,广州 515006)
葛仙米(拟球状念珠藻,Nostoc sphaeroidesKutzing)是一种淡水丝状多细胞固氮蓝藻,其主要产地为我国湖北省鹤峰县,主要生长于水稻田中[1]。葛仙米是我国珍贵的野生食药两用蓝藻,其营养价值极高,食用历史悠久,同时它在保健食品、食品添加剂、动物饲料、医药、美容及精细化加工等领域具有广阔的开发应用前景[2—5]。近年来,由于化肥农药的过度使用,导致野生葛仙米的产量逐年减少[6],合理地开发利用葛仙米资源,构建葛仙米人工高密度培养技术变得迫在眉睫。葛仙米人工培养需要解决其碳源(CO2)和营养盐(氮、磷)供应等问题。高浓度CO2培养不仅可以为藻类光合作用提供更加充足的原料,它还能提高 1,5-二磷酸核酮糖(RuBP)羧化酶的活性并抑制RuBP加氧酶的活性,降低光呼吸强度,有利于光合产物的积累。高浓度CO2对藻类光合作用的影响具有明显的种间差异性。Chu等[7]的研究表明15% CO2浓度连续培养小球藻,其ATP酶活性、光合固碳、甘油和脂质合成酶活性也会增强。卢璐[8]研究中发现高浓度的CO2使葛仙米的光合能力大大地提高,但葛仙米弹性、干鲜重比增大,蛋白质和多糖含量明显增加。周智[9]在研究大气CO2浓度对地木耳生长的影响时也发现在高浓度CO2导致其生长速度速率和干重都明显地增加。
由于葛仙米自身具有一定的固氮能力,所以对营养盐的需求主要集中在磷的供应上。磷元素参与植物生长发育过程中的各种代谢活动,在细胞结构、物质代谢及信号传导、光合作用等方面都起着极为重要的作用[10,11],也直接参与了光的吸收与同化、Calvin-cycle 及对一些酶的活性起着调节作用等[12]。Chen等[13]在研究葛仙米对环境中磷的响应机制时,发现磷浓度越高,葛仙米生长越迅速,其光合效率越高。在磷浓度较低时,葛仙米从丝状成球及小球变到大球的生长过程会受到限制,且光合作用对无机碳的亲和力增强[14]。汪丰海[15]研究表明葛仙米多糖、色素含量与培养基磷浓度呈正相关,但是磷浓度较高时会抑制葛仙米球体的破裂。可见磷在葛仙米生长和成球过程中起了非常重要的作用。
但目前国内外有关研究主要侧重于CO2浓度或磷浓度单因子变化对葛仙米的生理学影响上,有关两个因子的耦合效应尚未见报道。本文通过设置不同CO2浓度和磷浓度培养实验,探讨两者的耦合作用对葛仙米生长和光合作用的效应,为葛仙米人工高密度培养提供理论基础与技术支持。
1 材料与方法
1.1 实验材料
葛仙米藻种取自湖北师范大学陈雄文教授实验室,葛仙米小球用玻璃匀浆器匀浆,然后用无菌BG110培养液稀释用于扩大培养。培养温度为(20±1)℃,光强为100 μmol·photons/(m2·s),通入无菌空气,通气量为500 mL/min。经过20d左右培养得到粒径为1—2 mm的葛仙米,用于实验。
1.2 实验设计
挑选10 g生长状态良好的葛仙米小球,置于1 L玻璃管中,调整BG110培养液中磷浓度分别为0.088(LP),0.175(MP),0.350 mmol/L(HP),其中MP为BG110中无机磷浓度。分别通入大气浓度CO2(LC)和2000 ppm CO2(HC),通气速率为500 mL/min。每组设置3个平行实验,培养温度(20±1)℃,光照强度为100 μmol/(m2·s),光照周期12h∶12h。培养7d后收获用以测定。
1.3 相对生长速率测定
将收获的葛仙米小球用滤纸吸干样品表面水分,将样品置于冰箱中冷冻,然后放置于冷冻干燥机中冷冻干燥,相对生长速率(Relative growth rate,RGR)用以下公式计算[16]:
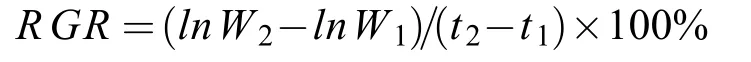
式中,t1、t2为开始和结束的时间,W1、W2分别代表实验开始与实验结束时的干重。
1.4 直径分布和粒数测定
将收获的葛仙米小球用网孔直径不同的筛网进行筛选,分别获得直径大小为1—2 mm、2—4 mm、大于4 mm的葛仙米个体,并计数,计算不同直径的葛仙米群体所占的比例。
1.5 叶绿素a含量测定
将冷冻干燥的葛仙米加入100%的甲醇,然后在60℃下水浴30min,反复提取2—3次,直至提取液变为无色为止,冷却至室温后用紫外分光光度计测其在665 nm处的OD值,叶绿素a的含量用以下公式计算[17]:

式中,ε为光系数74/cm,l是比色杯的内径为1 cm。
1.6 藻蓝蛋白、别藻蓝蛋白和藻红蛋白的测定
取1 g的葛仙米鲜藻,反复融冻5次,加入磷酸缓冲溶液研磨,然后用细胞破碎仪破碎5次,将其进行离心,转速为4000 r/min,时间为30min。取上清液,用分光光度计分别测定上清液在562、615和652 nm波长的吸光度A562、A615和A652。计算藻蓝蛋白(Pycocyanin,PC)、别藻蓝蛋白(Allophycocyanin,APC)和藻红蛋白(Phycoerythrin,PE)的含量。根据Siegelman等的公式计算[18]:
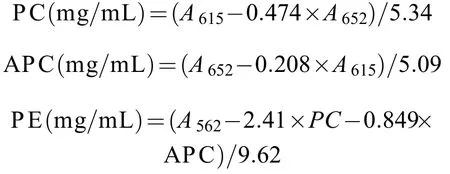
1.7 叶绿素荧光参数测定
利用调制脉冲叶绿素荧光仪(PAM-2100,Walz,Effeltrich,Germany)测定葛仙米的叶绿素荧光参数。弱测量光和光化光分别为0.01 μmol/(m2·s)和培养光强,饱和脉冲光为 4000 μmol/(m2·s)(0.8s)。叶绿素的荧光参数PSII的最大光能转化效率(Maximal photochemical efficiency of PSII,Fv/Fm)、PSII的实际光能转化效率(Actual photochemical efficiency of PSII,Yield)用以下公式计算[19]:
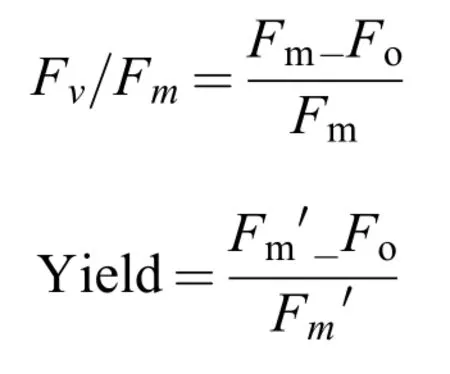
式中,Fm′和Fm分别是光照和暗适应(15min)后藻的最大荧光水平。F是激发状态下的实时荧光,调制蓝光和远红光测量光束分别用于测量Fo和Fo′。
1.8 P-I曲线的测定
光合放氧速率利用YSI生物测氧仪测定,选定5—6个直径为2—4 mm的葛仙米小球放入反应槽中,在20℃下,测定不同光强下光合放氧速率。通过调节光源和反应槽的距离来控制不同光强。通过P=Pm×tanh(α×I/Pm)+Rd方程对实验数据进行非线性参数拟合[20-21],其中P是光强为I时的光合速率;Pm为光饱和光合速率[μmol O2mg/(Chl.a·h)];α是光合效率[μmol O2mg/(Chl.a·h)];I为光强[μmol/(m2·s)];Rd为暗呼吸速率[μmol O2mg/(Chl.a·h)]。
1.9 统计分析
应用软件Excel和Origin 2015(Origin Lab Corp,Northampton,MA,USA)进行数据分析,运用双因子方差分析(Two-way ANOVA)和DunCan多重比较,分析数据间的差异性。
2 结果
2.1 相对生长速率
如图 1所示,培养液中P或CO2浓度变化对葛仙米生长均有明显的影响(P<0.05)。在大气CO2浓度下,HP、MP培养的葛仙米相对生长速率比LP分别提高7.63% (P<0.05)和7.40% (P<0.05);而在高浓度CO2下,HP、MP培养分别提高10.81% (P<0.05)和7.00% (P<0.05)。而仅在MP浓度下,高浓度CO2培养的葛仙米相对生长速率比大气CO2浓度培养提高9.10% (P<0.05),在LP和HP浓度下,高浓度CO2对葛仙米生长的效应不显著(P>0.05)。双因子方差分析表明,CO2和P对葛仙米相对生长速率的交互作用不显著(P>0.05)。

图1 葛仙米在不同CO2和P浓度培养下相对生长速率Fig.1 Relative growth rates of N.sphaeroides cultured at different concentrations of CO2 and P
2.2 粒径和数量
如图 2表示,CO2或P浓度均对葛仙米粒径和数量具有显著影响(P<0.05)。而在大气CO2浓度培养下(LC),HP浓度培养的小球(1—2 mm)明显增加(P<0.05),大球数量减少。但在HC培养下,HP浓度培养下大球(大于4 mm)的显著增加(P<0.05)。在相同P浓度时,HC下粒径大于4 mm的葛仙米小球占比显著高于LC(P<0.05)。双因子方差分析表明CO2和P具有显著的交互效应(P<0.05),高浓度CO2培养提升了P浓度对葛仙米球体增大和数量的促进效应。
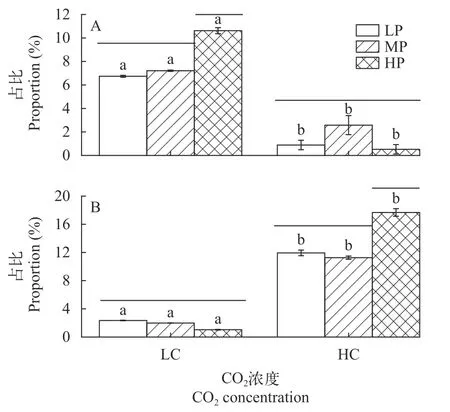
图2 不同CO2和P浓度培养下葛仙米球体所占比例(A.1—2 mm,B.>4 mm)Fig.2 Proportion of N.sphaeroides cultured at different concentrations of CO2 and P (A.1—2 mm,B.>4 mm)
2.3 叶绿素a含量
如图 3所示,CO2浓度变化对葛仙米叶绿素a含量具有显著影响(P<0.05),但P浓度变化的影响不显著(P>0.05)。在大气CO2浓度培养下,LP、MP中叶绿素a含量明显高于HP (P<0.05)。而在HC条件下,P浓度变化对葛仙米叶绿素a含量无显著影响(P>0.05)。在LP和MP浓度培养下,HC导致葛仙米叶绿素a含量显著下降(P<0.05),而在HP下,CO2浓度变化对叶绿素含量并没有显著影响(P>0.05)。双因子方差分析表明,CO2和磷对葛仙米的叶绿素a含量有显著的交互作用(P<0.05),高浓度CO2降低了HP对叶绿素合成的抑制作用。

图3 葛仙米在不同CO2和P浓度培养下Chl.a含量的变化Fig.3 Changes of Chl.a content in N.sphaeroides under different CO2 and P concentrations
2.4 藻蓝蛋白、别藻蓝蛋白和藻红蛋白含量
如表 1所示,CO2浓度变化对葛仙米藻胆蛋白的含量具有显著的影响 (P<0.05),但P浓度变化影响并不明显(P>0.05)。在相同P浓度培养下,LC培养的葛仙米PC、APC和PE含量分别比HC葛仙米含量高46.62%、34.01%和40.89% (P<0.05)。双因子方差分析结果表明,CO2和P对葛仙米的PC、APC和PE含量交互作用不显著(P>0.05)。
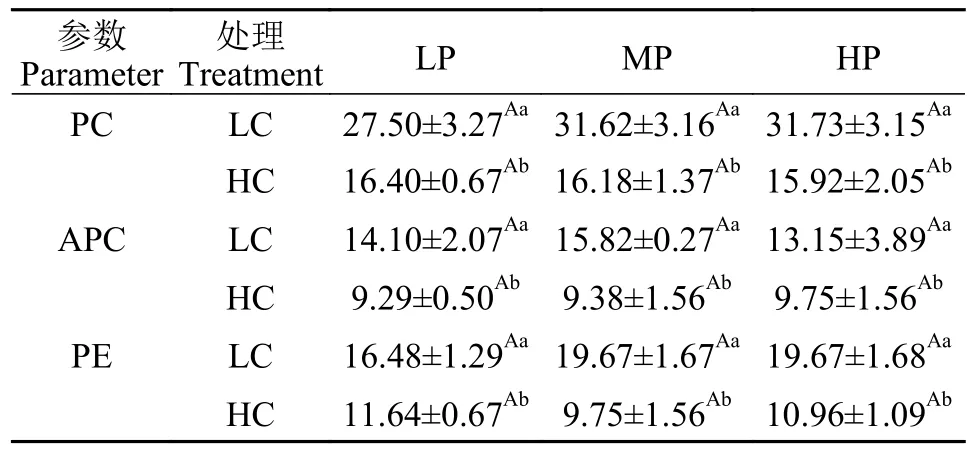
表1 葛仙米对PC、APC和PE含量的影响Tab.1 PC,APC and PE (mg/g DW) contents of N.sphaeroides under different conditions of CO2 and P concentrations
2.5 叶绿素荧光参数
图4和图 5表示不同CO2和P浓度下葛仙米光系统Ⅱ最大光化学效率(Fv/Fm)和光系统Ⅱ实际光化学效率(Yield)的变化。CO2或P浓度单因子变化对Fv/Fm无显著影响(P>0.05),但CO2浓度变化对Yield具有显著影响(P<0.05)。不管LP、MP还是HP,在HC培养下的Yield显著高于LC培养。双因子方差分析结果表明CO2和P对葛仙米的Fv/Fm、Yield的交互作用不显著(P>0.05)。

图4 不同CO2和P浓度培养下葛仙米最大光化学效率的变化Fig.4 Changes of maximum photochemical efficiency of N.sphaeroides under different concentrations of CO2 and P concentrations
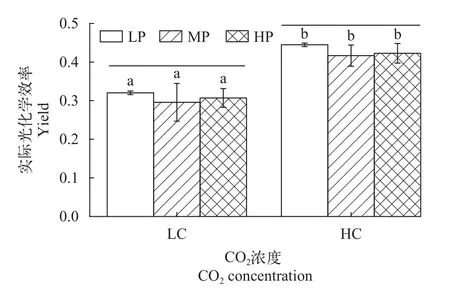
图5 不同CO2和P浓度对葛仙米实际光化学效率的影响Fig.5 Effects of different CO2 and P concentrations on the actual photochemical efficiency of N.sphaeroides
2.6 P-I曲线
如图 6和表 2所示,结果显示在大气CO2浓度下(LC),HP的葛仙米Pm值比MP、LP分别高24.89%和27.65%(P<0.05);在高CO2浓度下,HP比MP、LP培养分别提高18.05%和12.30%(P<0.05),表明高磷浓度有利于提高葛仙米光饱和光合速率。而在LP和MP浓度下,高浓度CO2培养葛仙米Pm显著升高(P<0.05),但HP下影响不显著(P>0.05)。双因子方差分析结果显示CO2和磷对葛仙米Pm的交互作用不显著(P>0.05)。

表2 P-Ⅰ曲线光合参数Tab.2 Photosynthetic parameters of N.sphaeroides grown under different conditions of CO2 and P concentration
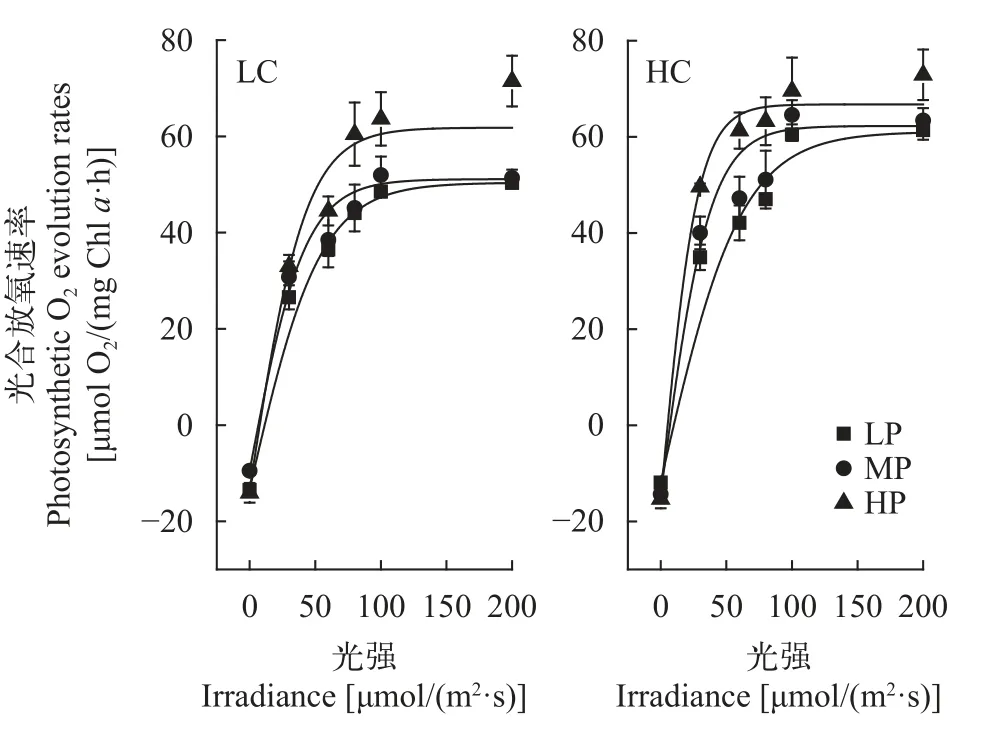
图6 葛仙米在不同CO2和P浓度培养下的P-Ⅰ曲线Fig.6 P-I curves of N.sphaeroides cultured at different concentrations of CO2 and P
CO2浓度对葛仙米的Rd有显著影响(P<0.05)。在大气CO2浓度培养下(LC),MP培养的葛仙米Rd显著低于LP和HP (P<0.05)。而在高CO2浓度下,MP和HP培养的葛仙米Rd显著高于LP(P<0.05);P对葛仙米的Rd也有显著性影响 (P<0.05),高CO2浓度培养导致LP的Rd值明显下降(P<0.05),而MP和HP则明显提高(P<0.05)。双因子方差分析结果表明CO2和P对葛仙米Rd具有显著的交互作用(P<0.05)。
在大气CO2浓度培养下,P浓度的变化对光合效率没有明显影响;但高浓度CO2培养下,P浓度升高导致光合效率明显升高(P<0.05),与LP相比,MP和HP培养下α值分别升高40.7%和89.0%。两因子方差分析结果表明CO2和P对葛仙米α有显著的交互作用(P<0.05),高浓度CO2明显增强了P的效应。
3 讨论
CO2是藻类进行光合作用的原料,但在自然环境中CO2浓度远低于藻类Rubisco的Km,所以有些藻类可以通过形成CO2浓缩机制,以缓解CO2的限制[22]。Riebesell等[23]研究表明海洋浮游植物生长常受CO2供应速率的限制。在藻类高密度培养过程中,无机碳浓度不足也会限制藻细胞的生长,添加无机碳可以促进生物量的增加,但添加CO2的效果明显优于[24]。本研究结果也显示高CO2浓度对葛仙米的生长具有明显促进作用。葛仙米除了能直接通过扩散作用利用CO2外,还具有一定的主动转运能力[25]。高浓度CO2培养下,藻类光合作用可以通过降低对CO2亲和力,增强CO2扩散作用,在叶绿体周围提高CO2浓度,降低光呼吸;同时可以减少在主动转运中的能量消耗,将更多能量用于生长所需[22]。在高浓度CO2培养下葛仙米Pm、Fv/Fm和α值的变化也印证了这一点。葛仙米细胞被胶质外鞘包围,而这些胶质鞘的主要成分是多糖[26],高CO2浓度培养下光合速率的增加有利于有机物质的积累,使葛仙米球体增大和数量增加。但在高浓度CO2培养下葛仙米色素含量(叶绿素和藻胆素)的降低表明高CO2浓度对色素合成具有明显的抑制作用,这可能与色素合成酶在高浓度CO2下受到了抑制有关。
P元素作为葛仙米主要营养物质,参与葛仙米的生长的多种代谢过程。磷限制会影响光合作用中的卡尔文循环和ATP的合成,同时P也参与细胞内能量转换和遗传信息的传递,调节酶活性,进而影响光合作用。Gao等[27]研究发现磷加富能增强中肋骨条藻的主动转运能力促进无机碳的获取,进而增强光合速率。而Chen等[13]研究也反映了提高磷浓度有利于促进葛仙米生长和光合速率,我们的研究结果也与之相一致。Gantt等[28]研究表明藻胆蛋白作为藻类捕获光能天线系统的重要成分,其主要功能是捕获光能,并将光能以95%以上的效率传递给光系Ⅱ(PSⅡ),但本研究显示磷浓度变化对色素含量(叶绿素a和藻胆素)并没有明显影响,表明高磷培养下葛仙米光合速率的增加并不是通过增加光能的捕获,而是可能通过提高光能的利用效率来实现,同时高磷浓度可能通过增加ATP的合成提升无机碳的主动转运能力,增加在Rubisco周围CO2浓度,导致光合速率增加,促进葛仙米生长。
CO2或P浓度单因子变化均可以影响葛仙米的生长和光合作用,但两者的交互作用呈现与单独作用不同的效应。如CO2×P对藻胆蛋白含量、Fv/Fm和Yield等并没有显著的交互效应,表明CO2和P浓度变化对藻胆素合成、最大光化学效率和实际光化学效率的效应仅是独立作用。Xu等[29]在大型海藻(Sargassum muticum)的研究中表明在大气CO2浓度和高磷培养叶绿素含量明显增加,但在高浓度CO2培养下,高磷对叶绿素含量并没有明显影响。我们的研究显示在大气CO2浓度培养下,磷浓度升高导致叶绿素a含量的下降,但高浓度下则未见此现象,表明高浓度CO2培养缓解了高磷浓度对叶绿素a合成的抑制效应,这可能与高浓度CO2培养下能量的分配相关。本研究结果也显示大气CO2浓度培养下P浓度增加对光合效率的影响并不明显,但在高浓度CO2培养下增强了磷对光合效率的效应,两者存在明显的交互作用,表明高浓度CO2和磷浓度对光合效率的提高具有明显的协同作用,这与高浓度CO2和高磷浓度具有较高的相对生长速率、较多的粒径较大球体数量相一致,这也可能与高CO2浓度下和高磷浓度下能提供更多的ATP相关。
总之,在葛仙米大量培养中,添加高浓度CO2有利于葛仙米的生长,同时将BG110培养液中磷浓度加倍,两者的协同效应更有利于促进葛仙米球体的增大和较大球体数量的增加。本研究为葛仙米大量培养过程中CO2和磷的添加提供了生理学理论基础。

