液相色谱-串联质谱法定量分析莱茵衣藻1,3-二油酸-2-棕榈酸甘油三酯
鲁媛晨 李艳华 余丽华 韩丹翔 马海燕
(1.中国科学院水生生物研究所,武汉 430072;2.中国科学院大学,北京 100049;3.北京大学工学院藻类生物技术创新实验室,北京 100871)
1,3-二油酸-2-棕榈酸甘油三酯(1,3-Dioleoyl-2-palmitoylglycerol,OPO)是母乳脂肪中含量最丰富的甘油三酯(Triacylglycerol,TAG)[1]。大量研究证明,TAG的立体化学结构即脂肪酸在甘油骨架上的分布会影响其吸收代谢[2,3]。人乳中这种独特的sn-2位为棕榈酸(C16∶0),sn-1/3位为油酸(C18∶1)的甘油三酯在婴儿的成长期间起着重要的作用,可以促进脂肪酸和钙质的有效吸收,保证婴儿的能量摄入,并且可以改善婴儿便秘,增加婴儿骨骼强度[4—7]。2008年,中华人民共和国卫生部公告批准OPO可以作为营养强化剂应用于婴儿配方奶粉中[8],预计未来我国婴幼儿奶粉市场对OPO纯品的年需求量可达3.6—13×107kg。
然而,目前国内市面上的商业化OPO大多依赖进口,并且是由一步酸解反应或两步醇解酯化反应酶法合成的[9]。酶催化的过程提高了工艺的成本和复杂性,价格与质量之间的矛盾限制了OPO的应用程度[10]。因此亟待开发出可以规模化生产的天然OPO产品,如寻找新的富含OPO的油脂来源以满足市场需求,同时解决依赖进口的问题。
莱茵衣藻(Chlamydomonas reinhardtii)是研究脂质代谢的模式生物,在环境胁迫的条件下可以积累大量的TAG作为储存脂质[11]。分析发现其总脂肪酸组成绝大部分为C16和C18脂肪酸[12]。此前,有研究者发现,在缺氮胁迫条件下莱茵衣藻细胞中90%以上的TAGsn-2位是C16脂肪酸,且60%以上为C16∶0,而sn-1/3位上C16∶0和C18∶1的占比也接近30%[13]。在莱茵衣藻中存在两条TAG从头合成的肯尼迪途径,分别定位于内质网和质体,其中溶血性磷脂酸酰基转移酶(Lysophosphatidic acid Acyltransferase,LPAAT)是负责TAG中sn-2位酰基化的酶。当在莱茵衣藻中过表达莱茵衣藻质体定位的CrLPAAT1时,sn-2棕榈酸酯的含量明显提高[14];而内质网定位的CrLPAAT2也更加偏好C16∶0-CoA作为供体[15]。以上研究暗示莱茵衣藻中可能存在天然合成OPO的通路。
由于细胞内甘油三酯的组成非常复杂,针对特定结构TAG的检测一直是研究的难点,目前国内还未出台有关OPO的标准检测方法。现有的针对OPO的检测方法主要通过气相色谱、高效液相色谱和气相色谱-质谱联用等。其中气相色谱法和气相色谱-质谱联用法无法将OPO和它的同分异构体OOP完全分开[16,17]。银离子色谱柱液相色谱法虽然可以使TAG同分异构体受到不同的束缚力分离开,但稳定性差,柱子使用寿命短[18]。而液相色谱-质谱联用具有更高的灵敏度和精确度,且不需对样品进行前处理,在特定TAG分析上更具优势。超高效液相色谱(Ultra-High Performance Liquid Chromatography,UPLC)可以极大地提高色谱分离能力并缩短分析时间;质谱(Mass Spectrometer,MS)仅利用特征碎片离子就可以进行分子结构分析,其中三重四级杆分析器(Triple Quadrupole System,TQS)是进行单一m/z扫描最灵敏的仪器[19];电喷雾电离(ESI)离子源在脂质分析中早有应用,技术成熟。UPLC与MS联用仪可以对藻油样品中的OPO进行高效分析。
本研究首先建立了基于超高效液相色谱串联三重四级杆质谱(UPLC-MS/MS)的OPO分析方法,并对缺氮胁迫条件下一株野生型莱茵衣藻cc-5325及其半乳糖基水解酶基因敲降突变体M08的OPO进行了定量分析,为进一步研究莱茵衣藻中OPO的生物合成提供了技术支持,也为产业化OPO生产提供了思路和方向。
1 材料与方法
1.1 莱茵衣藻藻种与培养方法
莱茵衣藻C.reinhardtiicc-5325(cw15mt+)和莱茵衣藻半乳糖基水解酶(Galactosyl Hydrolase,CrGH)基因插入突变株LMJ.RY0402.088610均购自美国明尼苏达大学衣藻资源中心(ChlamydomonasResource Center,https://www.chlamycollection.org/)。为方便描述,上述藻株分别简称为cc-5325和M08。Crgh基因插入突变株M08的外源基因插入位点位于该基因内含子,且在缺氮条件下,CrGH蛋白表达水平显著降低[20]。
从TAP固体平板上挑取单藻落接种于20 mL新鲜TAP液体培养基中,在光照强度40 μmol/(m2·s)、温度25℃和转速140 r/min下培养至对数生长期。以起始浓度2.0×105cells/mL转接至200 mL TAP液体培养基培养,3d后更换为缺氮培养条件。以1000×g离心力离心藻液5min收集藻细胞,用缺氮TAP培养基清洗藻泥1次,重复离心后重悬藻泥至对应体积的缺氮TAP培养基中,在同样条件下继续培养3d。从更换缺氮培养基开始,每天取样进行细胞计数、干重测量、定量PCR检测及OPO含量分析。本实验设置3个生物学平行。
1.2 生长曲线和生物质测定
每天固定时刻取藻液1 mL,添加鲁哥氏碘液(终浓度1%)固定藻细胞。使用血球计数板在普通光学显微镜下计数,计算藻细胞密度。每份样品计数4—6次并计算平均值。
藻细胞的干重测定参考Yin等[21]的105℃恒重法。在测定细胞干重前,将玻璃微纤维滤膜(Whatman GF/C膜)编号,于105℃过夜烘干,置于真空干燥容器中冷却,称量记录膜重M1。每天固定时刻取藻液V=10 mL,使用GF/C膜抽滤去除培养基并用1 mol/L碳酸氢铵溶液清洗藻细胞1次。抽滤后的GF/C 膜移至105℃过夜干燥,次日置于真空干燥容器中冷却,称量带有烘干藻细胞的滤膜并记录总重M2,计算藻细胞生物量DW(g/mL)=(M2-M1)/V。
1.3 实验试剂和标准品
三氯甲烷(色谱级)、乙酸铵(质谱级)和甲酸(质谱级)购自美国Sigma-Aldrich公司;甲醇(质谱级)、乙腈(质谱级)和异丙醇(质谱级)购自德国Merck公司。色谱级试剂用于总脂提取,质谱级试剂用于液质联用仪分析。
外标标准品OPO和内标标准品十七烷酸甘油三酯(C17:0/C17:0/C17:0)标准品均购自美国Sigma-Aldrich公司。
1.4 莱茵衣藻Crgh基因转录水平检测
RNA提取方法参照TransZolUp Plus RNA Kit试剂盒(ER501-01,TransGen Biotech)说明书。cDNA合成参照TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR试剂盒(AT341-01,TransGen Biotech)说明书。
采用相对定量法检测Crgh基因的转录水平,内参基因选择α-Tubulin。荧光定量使用的Crgh引物和内参基因引物为:Crgh-F 5′-ACTGGTGGGG CATCAACTACTAC-3′/Crgh-R 5′-GTCTCAGTGA TGTACATGGGAATG-3′;α-Tubulin-F 5′-CTCGCT TCGCTTTGACGGTG-3′/α-Tubulin-R 5′-CGTGG TACGCCTTCTCGGC-3′。
qPCR扩增体系包括5 μL 2 × ChamQ Univeral SYBR qPCR Green Master Mix(Q711,Vazyme),10 μmol/L引物各0.2 μL,100 ng稀释后的cDNA模板,加入ddH2O至反应体系为10 μL。qPCR反应条件为:95℃,600s;95℃,15s;60℃,30s;72℃,30s;40 cycles;95℃,60s;40℃,60s;65℃,1s;97℃,1s;37℃,30s。
1.5 总脂提取
总脂提取参考Yoon等[22]和Guo等[23]的方法并在此基础上改进,在收获的藻泥中加入4 mL甲醇∶氯仿∶甲酸(20∶10∶1,v/v/v),室温下剧烈振荡1h;加入2 mL的0.2 mol/L H3PO4与1 mol/L KCl混合溶液,室温下剧烈振荡5min;1000×g离心力离心10min后,用巴斯德玻璃吸管吸取下层有机层转移至新的玻璃样品瓶中;另外吸取1 mL氯仿加至提取管中,重复前两步操作萃取出残留的油脂;氮气吹除有机溶剂,藻油冻存于-20℃。
1.6 标准溶液配制和标准曲线建立
将OPO标准品和C17∶0甘油三酯标准品分别用氯仿溶解,配制成终浓度为2 mg/mL的OPO标准溶液和20 μg/mL的C17∶0甘油三酯标准溶液,保存于-20℃备用。
定量吸取2 mg/mL的OPO标准溶液,用氯仿:甲醇(1∶1,v/v)溶液稀释成质量浓度为500 μg/mL的OPO溶液,然后由高至低逐级稀释得到质量浓度梯度为250、125、62.5、31.25、15.625和7.8125 μg/mL的OPO系列标准工作液。每个浓度梯度的OPO标准工作液取195 μL并各加入5 μL 20 μg/mL的C17∶0甘油三酯,使内标质量浓度为0.5 μg/mL。绘制OPO峰面积/内标物峰面积——OPO浓度/内标物浓度的曲线,计算内标标准曲线方程及相关系数。
1.7 藻油样品前处理
将提取的藻油复溶于氯仿∶甲醇(1∶1,v/v)溶液中,每10 mg 藻生物质对应1 mL 氯仿:甲醇溶液;经孔径0.22 μm的有机相针式过滤器滤过滤;取195 μL藻油滤液,加入5 μL 20 μg/mL的C17∶0内标溶液,充分振荡混匀后进行UPLC-MS/MS分析。
1.8 UPLC-MS/MS法定量分析OPO
仪器采用ACQUITY超高效液相色谱仪(美国Waters公司)串联三重四级杆质谱(美国Waters公司)。向1 μg/mL的OPO标准溶液加入10 mmol/L乙酸铵,以10 μL/min流速直接进样于质谱的ESI源,在正离子模式下,对OPO的母离子[M+NH4]+(m/z 876.80)进行子离子扫描。高纯氮气作为雾化和干燥气体,流速为600 L/h,去溶剂温度为300℃。毛细管电压和锥孔电压分别为3000和40 V,碰撞能量20 V。
色谱条件参考Li等[24]的方法并在此基础上改进。色谱分离采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司);柱温35℃;进样量为1 μL;流速为0.2 mL/min;流动相:A相为甲醇∶乙腈∶水(19∶19∶2,v/v/v),B相为异丙醇,两者皆含有0.1%的甲酸和10 mmol/L的乙酸铵。梯度洗脱程序见表 1。

表1 UPLC梯度洗脱条件Tab.1 Gradient elution conditions of UPLC
质谱检测的离子源为电喷雾离子源(Electrospray Ionization,ESI),在正离子模式下,采用多反应监测(Multiple Reaction Monitoring,MRM)模式,以高纯氮气作为雾化和干燥气体,流速为800 L/h,去溶剂温度为450℃。毛细管电压和锥孔电压分别为3000和40 V,碰撞能量20 V。
1.9 数据统计
采用MassLynx V 4.1软件(Waters)进行数据采集和分析,采用Microsoft Excel 2010软件进行数据处理和图表制作,实验结果以算术平均值±平均绝对偏差表示,采用Student’st-test对组间数据进行比较,P<0.05时,认为差异显著。
2 结果
2.1 建立基于UPLC-MS/MS的OPO分析方法
在正离子模式下,对OPO标品溶液直接进样进行全扫描,得到其准分子离子为[M+NH4]+,即母离子质荷比m/z为876。对[M+NH4]+(m/z 876)进行子离子扫描,如图 1所示,碎片离子m/z 577.24 [M+NH4-299]+和m/z 603.28 [M+NH4-273]+分别为中性丢失299(C18H34O2+NH3)和中性丢失273(C16H32O2+NH3)的碎片,根据质荷比推算所丢失的碎片分别是sn-1或sn-3位上的油酸酰基和sn-2位上的棕榈酸酰基相关碎片。碎片离子m/z 313.18 [R2CO+74]+和m/z 339.08 [RxCO+74]+(X=1,3)分别为丢失了sn-1,3位酰基和sn-1,2或sn-2,3位酰基的碎片。碎片离子m/z 264.99 [R2CO]+(X=1,3)和m/z 239.02 [R2CO]+分别为油酸酰基和棕榈酸酰基相关碎片。

图1 OPO子离子扫描质谱图Fig.1 The product-ion scanning spectrum of the [M+NH4]+ ion of OPO
根据OPO的子离子扫描图谱,本研究选择了其中相对丰度最高的子离子m/z 577.24及其母离子m/z 876.44作为OPO的MRM定量离子对。考虑到色谱的分离效率和样品中离子化效率,流动相中添加0.1%的甲酸和10 mmol/L的乙酸铵以获得理想的分离度、保留时间和峰型。在优化的质谱和色谱条件下,以MRM模式检测OPO标品的总离子流色谱图如图 2所示,保留时间为21.25min,保留时间窗口为0.6min。

图2 OPO总离子流图Fig.2 Total ion chromatogram of OPO
2.2 OPO标准曲线方程
根据已知浓度的OPO标品溶液建立标准曲线。对1.5中的系列梯度标准溶液进行超高效液相色谱-串联质谱测定,以OPO的浓度/内标物浓度为横坐标(X,μg/mL),标准品OPO与内标C17:0的峰面积之比为纵坐标(Y),进行线性回归分析,得到OPO的标准曲线方程为:Y=0.0083X+0.2248(相关系数R2=0.991),如图 3所示,结果显示OPO在7—250 μg/mL浓度范围内线性关系良好,相关系数R2大于0.99,表明该方法有较高的灵敏度和准确度,因此可采用此方法对样品中的OPO进行定量分析。

图3 OPO的标准曲线方程Fig.3 Standard curves of OPO
2.3 莱茵衣藻cc-5325中OPO的检测
通过上述研究建立的UPLC-MS/MS法对缺氮胁迫条件下的莱茵衣藻cc-5325细胞总脂粗提物中的OPO进行检测,根据提取离子流图中OPO峰强度可以判断cc-5325在缺氮条件下的OPO积累情况(图4)。结果显示,在正常培养条件下(N0),细胞内仅积累极少量的OPO(图4A),而在缺氮胁迫下(N1-N3)可以检测到OPO的特征离子峰,且峰强度远高于正常培养条件下OPO的峰强度,表明莱茵衣藻中的OPO在缺氮时大量积累。

图4 MRM检测模式下特征离子扫描鉴定OPOFig.4 Identification of OPO by characteristic ion scanning detected by MRM
2.4 莱茵衣藻野生型和Crgh突变株的性状表征
图5为遗传背景不同的莱茵衣藻野生型cc-5325和Crgh插入突变株M08的生长、生物质积累及Crgh基因表达性状表征。在正常培养条件下,M08的Crgh基因转录水平相较于野生型下调了85.6%,说明插入突变对M08的Crgh基因表达造成了影响(图5A),以上结果表明,突变株M08的Crgh基因在转录水平下调。
在缺氮胁迫条件下,莱茵衣藻细胞内会积累大量TAG。图 5B和5C为野生型cc-5325和Crgh插入突变株M08在缺氮培养条件下的生长情况,结果显示,两者的生物量在缺氮培养期间持续积累,在缺氮第3天时达到最高,分别为0.60和0.38 mg/mL;两者的细胞密度在缺氮期间不再大幅变化,在缺氮第3天时分别保持在0.85和1.41×105cells/mL左右。整体来看,插入突变株M08的生物量在整个培养期间都低于cc-5325,而细胞密度却高于cc-5325,即cc-5325具有更高的单细胞干重。
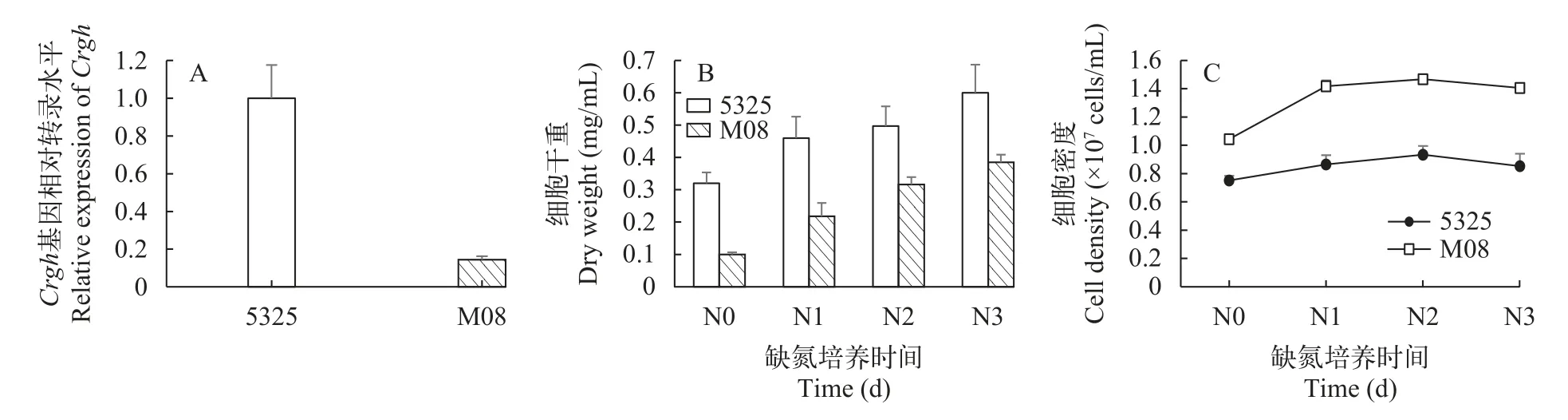
图5 莱茵衣藻野生型cc-5325和Crgh突变株M08的性状表征Fig.5 Characterization of wild-type cc-5325 and Crgh mutant strain M08
2.5 莱茵衣藻野生型和Crgh突变株的OPO含量表征
通过前述研究建立的UPLC-MS/MS方法对cc-5325和M08缺氮条件下的OPO含量进行定量分析。结果如图 6所示,在缺氮胁迫第1至第3天,野生型cc-5325的OPO含量分别为0.82%、1.05%和0.96%,突变株M08的OPO含量分别为3.84%、4.22%和3.59%,两者的OPO含量变化呈现出先升高后降低的趋势,都在缺氮第2天达到了最高。M08的OPO含量始终高于野生型cc-5325,且在缺氮的第2和第3天达到了显著(P<0.05),相较于野生型cc-5325分别提高了3.70、3.04和2.74倍。在缺氮胁迫第1至第3天,cc-5325的OPO产量分别达到了3.76、5.25和5.90 μg/mL,M08的OPO产量分别达到了8.01、13.26和13.73 μg/mL,两者的OPO产量都在缺氮第3天时达到了最高。插入突变株M08的OPO产量也在整个缺氮胁迫期间显著高于野生型cc-5325(P<0.05),相较于cc-5325分别提高了1.13、1.53和1.33倍。

图6 缺氮培养时莱茵衣藻野生型cc-5325和Crgh突变株M08的OPO积累(*P<0.05)Fig.6 The accumulation of OPO in wild-type cc-5325 and Crgh mutant strain M08 under nitrogen deprivation (*P<0.05)
3 讨论
3.1 UPLC-MS/MS法定量定性OPO
本文通过优化高效液相色谱以及质谱条件,建立了适用于分析藻油中OPO含量的UPLC-MS/MS定量定性方法。结果表明,该方法可以有效地鉴定和定量分析细胞中的OPO,同时该方法也将适用于分析其他特定酰基组成的TAG。TAG是一种中性脂质,一般的电离技术很难让TAG带电荷,本研究采用的ESI离子源可以使TAG分子在离子对试剂的辅助下进行很好的电离[25],目前较常用的离子对试剂是金属锂化合物或钠盐,形成母离子加合物[M +Li]+或者[M+Na]+,但是金属离子会污染质谱系统从而导致检测器灵敏度降低。因此在本研究中,选择了较理想的对质谱友好且易挥发的乙酸铵作为离子对试剂,形成母离子加合物[M+NH4]+,同时添加0.1%的甲酸改善分离度、保留时间和峰型。在子离子模式中,母离子[M+NH4]+经过碰撞可分解产生[M+NH4-RCOONH4]+(DAG+)和[RCO]+特征碎片离子,[M+NH4]+、DAG+和[RCO]+的信号对于TAG分子的定性和定量十分重要[26]。本文中所建立的方法正是基于此原理,在电子碰撞作用下,TAG会产生三种脂肪酸酰基碎片和三种DAG+特征碎片,分别为[R1CO]+、[R2CO]+、[R3CO]+和sn-1,2-DAG+、sn-2,3-DAG+、sn-1,3-DAG+,由于OPO的sn-1/3位上具有相同的脂肪酸组成,所以OPO会产生两种脂肪酸酰基碎片和两种DAG+特征碎片。甘油骨架上断裂一个sn-2位脂肪酸所需要的能量要高于断裂一个sn-1/3位的脂肪酸,因此sn-1,2-DAG+和sn-2,3-DAG+的比例要大于sn-1,3-DAG+,而sn-2脂肪酸所对应的[R2CO]+碎片离子的丰度值更低,通过这种方式可以判断TAG上脂肪酸链的组成和位置,从而完成TAG的定性[27]。UPLC-MS/MS方法不需要对样品进行衍生处理,具有重复性好,检测方便快捷,精度高等优点。
本研究建立的方法对OPO标品进行了定性并建立了OPO的定量标准曲线(图1— 3),结果显示在5—250 μg/mL浓度范围内OPO线性关系良好,相关系数可以达到0.99以上,表明本方法能够准确地对样品中的OPO含量进行定量。利用该方法对莱茵衣藻野生型cc-5325中提取的藻油进行了分析,发现总离子流图的特征离子峰保留时间十分稳定(图4),表明本研究方法的重现性较好、稳定性和可靠性高。缺氮条件下的莱茵衣藻细胞中可以检测到天然OPO,外标法定量分析发现其含量可以达到干重的1.05%,这证实了莱茵衣藻作为OPO合成细胞工厂的应用潜力和商业化价值。该方法可以应用于研究不同遗传改造的莱茵衣藻OPO合成情况的动态变化,从而为进一步开发OPO新油脂来源提供方向。
3.2 不同遗传背景莱茵衣藻细胞内的OPO变化
莱茵衣藻在胁迫的环境条件下会积累大量的TAG,这个过程伴随着光合膜脂(类囊体膜和叶绿体膜上的脂质)的降解[11]。不同遗传背景的莱茵衣藻在生长速率、碳流分配等方面存在着差异,TAG合成通路及其关联代谢途径的基因的突变极有可能影响OPO的含量。本研究选择了莱茵衣藻野生型cc-5325和Crgh缺陷突变株M08定量分析其细胞内的OPO合成情况,发现在由正常培养转换为缺氮培养的过程中,两株藻株的OPO含量都在初始阶段急剧增加,随后基本稳定,OPO产量在此过程中持续积累,而M08的OPO积累在缺氮条件下远高于野生型cc-5325。研究发现,在胁迫条件下,莱茵衣藻Crgh基因表达和蛋白水平均有上调,半乳糖基水解酶介导了光合膜脂向TAG的转化,由于Crgh的插入突变,M08的TAG积累会低于其野生型cc-5325[20]。而本研究发现M08的OPO含量和产量均较其野生型cc-5325有显著提高,表明莱茵衣藻中OPO与总TAG的积累不是简单地正相关,其背后还有一些复杂的未知机制。Crgh在高等植物如拟南芥中的同源基因AtSFR2可以利用糖脂合成二脂酰基甘油(Diacylglycerol,DAG)[28],DAG是肯尼迪途径中合成TAG的前体产物。故推测Crgh在莱茵衣藻中也行使相同的功能,M08突变株中该基因的缺陷可能会导致缺氮条件下质体肯尼迪途径TAG合成的降低。OPO含量的升高可能是因为其合成主要由位于内质网的真核肯尼迪途径贡献。但该假说还需要进一步实验验证。
通过遗传改造莱茵衣藻油脂代谢途径的某些相关基因,如Crgh,的确会对莱茵衣藻细胞内sn-2棕榈酸酯如OPO的合成造成影响。此前,有研究者利用代谢工程手段对拟南芥(Arabidopsis thaliana)种子的油脂代谢途径进行遗传操作,在种子中过表达偏好C16∶0-CoA的欧洲油菜(Brassica napus)Bnlpaat1基因,随后敲降了拟南芥真核途径的原生Atlpaat2基因,并敲除了会使磷脂酰胆碱(phosphatidylcholine,PC)和甘油二酯(Diacylglycerol,DAG)互变的磷脂酰胆碱:二酰基甘油胆碱磷酸转移酶(PC:DAG cholinephosphotransferase,PDCT)Atpdct基因,最终使得TAG中sn-2棕榈酸酯含量提高了20多倍[29],这说明利用功能已知的靶基因去理性改造油脂代谢途径可以实现特定立体化学结构的TAG(sn-2棕榈酸酯)的大量积累,使其具有成为细胞工厂的潜力。莱茵衣藻质体来源的CrLPAAT1及内质网来源的CrLPAAT2对棕榈酸的底物偏好性使得其作为OPO细胞工厂的优势更加突出[14,15]。
本研究为定量分析微藻中特定结构的TAG提供了一种高效、准确和便捷的技术手段,并证实了莱茵衣藻作为OPO细胞工厂的可行性。作为一种安全级微生物,莱茵衣藻基底盘细胞的发展空间巨大,在胁迫条件下如何精准地调控微藻细胞内的碳流,将固碳网络向目的产物的方向延伸,加强莱茵衣藻中OPO的积累是未来重点研究的方向。脂质合成途径的关键酶基因作为潜在靶点,对其的进一步研究将帮助加速构建莱茵衣藻绿色生物制造平台。

