芋花叶病毒RNA提取前处理方法优化及快速检测体系的构建
何玉书,吴玲玲,李欣霞,曾颖,张亚楠
(厦门医学院,福建 厦门 361023)
芋(Colocasia esculenta L.Schott.)属于天南星科(Araceae)芋属(Colocasia)多年生宿根草本植物,作为粮食和蔬菜在世界各地广泛种植[1]。在热带和亚热带地区,尤其是东南亚和太平洋岛国具有重要的社会经济意义[2]。芋在传统种植中,属典型的无性繁殖作物,长期的无性繁殖方式导致病毒在芋植株内积累[3],且极易受多种病毒复合侵染[4]。芋花叶病毒病是严重影响芋产量和品质的主要病害之一[5],这些病毒主要包括芋花叶病毒(Dasheen mosaic virus,DSMV)、芋杆状病毒(Taro bacilliform virus,TaBV)和黄瓜花叶病毒(Cucumber mosaic virus,CMV)等[6]。其中,芋花叶病毒侵染最为普遍,易造成植株生长势下降、球茎变小、数量减少以及种性退化、产量和品质下降等问题[7]。其侵染作物后可引起系统症状或隐症现象,严重影响芋的产量和品质[8]。
芋花叶病毒为马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus),其病毒粒子呈线状,长度约为750 nm[9]。一般通过蚜虫传播,还可通过机械摩擦传播[10]。感染DSMV的芋头植株通常表现为叶片花叶、斑驳、皱缩卷曲、叶脉黄化和茎坏死等症状[11]。
近年来,反转录聚合酶链反应(RT-PCR)方法因其快速、简便、灵敏度高和特异性强等优点,在植物病毒的检测上显示出强大优势[12]。一步式RT-PCR,即在PCR仪中一次完成RT-PCR,简化操作程序,节省操作时间,并最大限度地降低了外来因素的污染,目前在病毒检测领域广泛应用。而高效快速提取无污染的完整的植物病毒RNA是对其进行基因表达分析和基因克隆的必要前提条件[15]。
本研究选取福建厦门道地名优品种——仙景槟榔芋为研究对象,对芋叶总RNA的提取前预处理过程进行改良,通过液氮联合组织研磨仪的方法,设计正交实验对组织研磨仪的条件参数进行优化,大大提升了植物总RNA的提取率;同时对该地方品种的芋病毒进行鉴定,在两步式RT-PCR体系的基础上,构建一步式RT-PCR体系及荧光定量PCR体系,比较分析后获得一条简便高效且经济实用的芋病毒RNA快速检测路径。
1 材料与方法
1.1 样本采集
受侵染的芋病毒叶片样本采集于厦门市集美区仙景村的槟榔芋,叶片受DSMV侵染的性状主要表现为羽状花叶、皱缩、叶脉和茎坏死,一般出现褪绿黄点,扩展后呈黄绿相间的花叶,见图1。

图1受DSMV侵染的芋叶Fig.1 Taro leaves infected with DSMV
1.2 试剂和仪器
RNA抽提试剂盒(艾德莱生物,RN09)、植物总RNA提取试剂盒(TIANGEN,U8608)、cDNA试剂盒(艾德莱生物,PC1803)、反转录酶M-MLV(艾德莱生物,PC1803)、dNTPs(艾德莱生物,PC2302)、Taq DNA聚合酶(艾德莱生物,PC0102)及AL 2 000 Marker(艾德莱生物,DM0102)均为艾德莱公司;琼脂糖(Biosharp,9012-36-6)、核酸染料(Solarbio,SY1020)、50 TAE(Solarbio,Cat.T1060-500)。
组织研磨仪(Retsch GmbH,MM 400*)、微量分光光度计(Quawell*)、PCR仪[TC-96/G/H(b)C]、水平电泳槽(北京六一,DYCP-31DN型)、电泳仪(北京六一,DYY-7C型)、超纯水(明澈,D 24UV/*)、离心机(SIGMA,3-18A)、电子天平(sartorius,BSA 2202S)、实时荧光定量PCR仪(ABI,7500 Real Time PCR system)。
1.2 样本总RNA的提取与前处理优化
1.2.1 RNA提取 将芋叶在液氮中迅速研磨成粉末状,称取100~200 mg的粉末至混匀好的EP管中,加入钢珠,然后放入组织匀浆机中研磨,13 000 r/min离心5~10 min;采用RNA提取试剂盒进行抽提。
1.2.2 样本总 RNA提取前预处理条件优化方案 前期实验发现叶片研磨的程度对后续芋叶病毒RNA的抽提率具有较大的影响,且采用不同植物RNA提取试剂盒均受影响,因此选取L9(34)的正交表,对研磨条件进行优化实验设计。选取3因素3水平的正交条件(表1),每个条件同时进行3组平行实验:钢珠的个数(1个、2个、3个);研磨频率10(1/s)、20(1/s)、30(1/s);研磨时间(10 min、20 min、30 min)。采用微量分光光度计(Quawell*)对提取的芋叶总RNA进行浓度检测,作为提取效果的判断依据。

表1 正交试验因素水平表Table 1 Orthogonal test factor level table
1.3 引物筛选
5对引物均由铂尚生物技术(上海)有限公司合成,其中3对根据NCBI GenBank中收录的DSMV病毒外壳蛋白(CP)基因核苷酸序列的保守区域设计,另两对为参考文献[16,17]中引物(表2)。

表2 用于RT-PCR反应的5种芋病毒引物对Table 2 Five primers pairs of taro virus for RT-PCR
对引物采用RT-PCR(Reverse Transcription PCR)及琼脂糖凝胶电泳实验进行筛选。
1.4 两步式RT-PCR
反应条件为:94℃预变性3 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,循环35次;最后72℃延伸10 min。PCR反应结束后,取出扩增产物5.0L 进行琼脂糖凝胶电泳检测。
1.5 一步式RT-PCR优化
反应程序:42℃60 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,72℃延伸10 min。反应结束后,取出扩增产物5.0L进行琼脂糖凝胶电泳检测。
1.6 RT-PCR产物检测
制备琼脂糖凝胶:称取琼脂糖凝胶0.5 g,加入1 TAE缓冲液50 mL,微波炉加热至熔化后倒入制胶板,待室温冷却至凝固后除去样本梳。
电泳仪参数设置:电压120 V,时间30 min。
2 结果与分析
2.1 RNA浓度的检测与分析
预实验使用了两种RNA提取试剂盒:RNA抽提试剂盒(艾德莱生物,RN09)、植物总RNA提取试剂盒(TIANGEN,U8608),验证该前处理方法均能提升两种试剂盒的总RNA提取率;综合比较两种试剂盒的价格和提取效果,最终选择RNA抽提试剂盒(艾德莱生物,RN09)进行实验。
通过表1设计的正交实验条件对叶片进行预处理,每组研磨条件均进行3组平行实验,取其平均值,最终实验结果见表3。

表3 正交试验设计Table 3 Orthogonal experimental design and intuitive analysis
通过方差分析(表4)可以看出,研磨时间和频率具有显著性,说明研磨的时间和频率对总RNA的提取率影响较大;从效应曲线图(图2)可以发现,随着时间的增加,提取率先增加后趋于平稳,提取率不再随时间的增加而增加;随着研磨频率的增大,提取率也随之升高,但由于该实验用的研磨仪最大额定研磨频率为30(1/s),因此无法探究继续增加频率是否能提升提取率,但可以推测的是,若研磨频率过高,可能会因摩擦产热在一定程度上导致RNA的降解;钢珠个数对提取率的影响并不大,因此从经济和便利的角度上选择1个钢珠即可。通过该正交实验结果可以得出液氮联合组织研磨仪提取芋叶总RNA的最佳条件为:时间20 min,研磨频率30(1/s),钢珠个数1个。
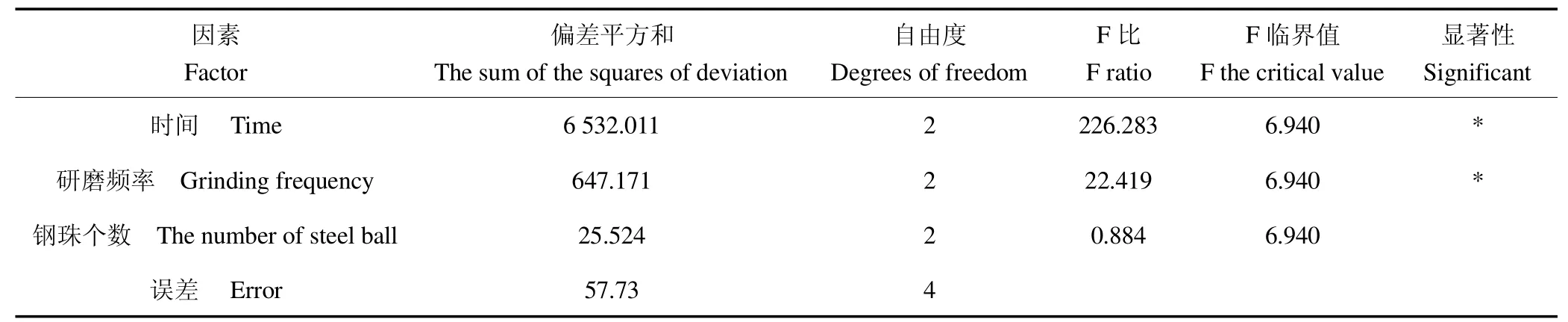
表4 正交试验方差分析Table 4 Orthogonal test analysis of variance
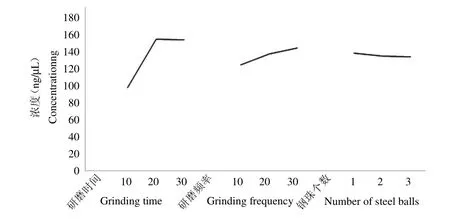
图2 效应曲线图Fig.2 The effect curve
2.2 引物筛选
根据NCBI GenBank中收录的DSMV病毒外壳蛋白(CP)基因核苷酸序列的保守区域设计5对引物,通过RT-PCR扩增,经琼脂糖凝胶电泳检测后筛选最佳引物,5对引物的阴性对照(未加模板的RT-PCR扩展产物)均无条带,实验组中引物2得到与预期片段大小一致的目标基因扩增产物(图3),因此,引物2为所设计的5对引物中的最佳引物。

图3 最佳引物的筛选Fig.3 The screen of the best primers
2.3 琼脂糖凝胶电泳检测
以最佳研磨条件提取的芋叶病毒总RNA为模板,反转录后进行常规两步式RT-PCR扩增,经1%琼脂糖凝胶电泳可见一条清晰的约为357 bp特异扩增条带,大小与预期一致。
以最佳研磨条件提取的芋叶病毒总RNA为模板,经一步式RT-PCR扩增,经1%琼脂糖凝胶电泳可见一条清晰的约为357 bp特异扩增条带,大小与预期一致。
以上结果进行3组重复验证实验,结果一致,见图4。两种方法均能获得条带清晰的目标产物,但两步式RT-PCR的反转录和PCR反应在两个管中进行,所加入的试剂多、成本高、过程操作步骤繁琐、费时费力、易污染且效率低;而一步式RT-PCR的反转录和PCR反应在一个管中进行,步骤简便、省时、成本低、结果重复性好且高效快速。

图4 一步式与两步式RT-PCR对比实验Fig.4 Comparison experiment of one-step and two-step RT-PCR
2.4 一步式条件优化结果
根据对Mg2+浓度(图5)、dNTPs浓度(图6)、逆转录酶浓度(图7)、Taq酶浓度(图8)的优化,通过电泳图可判断出一步式RT-PCR体系的最终优化结果为:模板为芋叶总RNA 1.0L,10 PCR buffer 2.5L,25 mM Mg2+1.0L,2.5 mM dNTPs 1.0L,10mol/L上游引物和下游引物各1.0L,200 U/L逆转录酶0.5L,5 U/L Taq DNA聚合酶1.0L,ddH2O补足25.0L。阴性对照模板为1.0L ddH2O。

图5 Mg2+浓度变化Fig.5 The concentration change of Mg2+

图6 dNTPs浓度变化Fig.6 The concentration change of dNTPs
图7 逆转录酶浓度变化Fig.7 The concentration change of MMLV

图8 Taq酶浓度变化Fig.8 The concentration change of Taq
2.5 测序结果
将两步式RT-PCR和一步式RT-PCR的产物送到生工生物工程(厦门)有限公司进行测序,由于实验酶制剂有一定错配率,二者同源性稍有差异,通过序列同源性比较显示该产物核甘酸序列与目标序列之间的同源性分别为82.12%及82.40%,皆具有较高的一致性,表明该两步式RT-PCR及一步式RT-PCR的扩增产物是DSMV的特异产物。
3 结论与讨论
在植物提取RNA的过程中,植物组织总RNA的提取是基因体外翻译、构建cDNA文库、研究基因的表达和调控[18],所得总RNA的质量高低直接影响到后续实验的结果,而样本的研磨效果对其提取浓度有较大的影响,因此对RNA提取试剂盒中研磨叶片这一步骤进行条件优化,能大大提升RNA的提取浓度,对后续的反转录扩增起到极为关键的作用。通过液氮与组织研磨仪联用的前处理方法,能极大的改善植物RNA提取过程中徒手研磨不完全,RNA释放量不足或因研磨时间过长造成RNA降解损失的缺点,本研究还进一步通过正交实验方法找到最佳的组织研磨仪使用参数为20 min,研磨频率为30(1/s),钢珠为1个,研磨效果最好,且研磨频率对实验结果影响较大。
目前国内对植物RNA提取的优化多在提取所用试剂的选用上,对过程方法的优化研究较少,本研究从植物叶片研磨过程的角度通过正交实验确定了一条高效提取芋叶总RNA的前处理方法,以获得高纯度和浓度的芋叶总RNA;且少有研究在此基础上构建并优化针对DSMV的快速、简便、灵敏度高、特异性强的一步式RT-PCR病毒检测体系,以获得最为经济实惠、实用性强且高效简便的DSMV的快速检测手段,可为芋病毒快速检测提供具有参考意义的研究分析与比较,对后续农作物相关的脱毒快繁、抗病毒育种及种性提质方面的实验研究提供基础依据。

