抛射剂四氟乙烷中杂质CFC115和HFC1243zf的吸入毒理安全性评价
赵燕君,杨会英,仪忠勋,孙会敏,林 飞
(中国食品药品检定研究院,国家药品监督管理局药用辅料质量研究与评价重点实验室,北京 100050)
药物吸入气雾剂指药物及辅料与抛射剂共同装封于具有定量阀门系统和一定压力的耐压容器中,形成溶液、混悬液或乳液,使用时借助抛射剂的压力,将内容物呈雾状喷出而用于呼吸道局部治疗的制剂[1]12。吸入气雾剂直接接触呼吸道黏膜或破损组织并迅速被毛细血管吸收,是风险等级“最高”的品种之一[2]。抛射剂是气雾剂药液雾化的动力,也是溶解或分散药物及辅料的介质[3],临床使用时会随药液直接吸入体内,其质量的优劣直接影响到药品的安全性和有效性。
1,1,1,2-四氟乙烷(HFA-134a)是目前药用气雾剂尤其是药用吸入气雾剂中使用最为广泛的抛射剂,由于合成路线复杂,生产过程会产生很多未知的杂质[4],这些杂质结构的确定和含量的变化是HFA-134a 质量控制的重点。本实验室在质量抽检中发现,国内某企业6批次HFA-134a产品均含有五氟氯乙烷(CFC115)和3,3,3-三氟丙烯(HFC1243zf)这两种杂质,最高分别可检出0.015‰和0.006‰,而进口产品中未检出。这两种杂质是否存在临床吸入后毒理学危害,目前还未见安全性文献报道。
为此,本研究应用6 种试验方法对CFC115 和HFC1243zf 高浓度混合气体(按照HFA-134a 中实际检出比例混合)进行动物体内、外毒理学安全性检测,为制定吸入用四氟乙烷标准及国产产品的吸入安全性风险评估提供技术支撑。
1 材料与方法
1.1 材 料
1.1.1 受试样品高浓度混合气体:五氟氯乙烷(CFC115,CAS 登记号76-15-3),相对分子质量154,室温无色气体,沸点-39~-37.7 ℃,含量>99.9%,由中化蓝天贸易有限公司提供;3,3,3-三氟丙烯(HFC1243zf,CAS 登记号677-21-4),相对分子质量96,室温无色气体,沸点-18~-16 ℃,含量>99.9%,由北京宇极科技发展有限公司提供;CFC115 与HFC1243zf 按体积比7∶3 混合,再与洁净空气和氧气混合后直接进入全身暴露装置内,对动物进行吸入给样,体外试验进行接触给样。
1.1.2 主要仪器和试剂HRH-7981 口鼻式给药装置购于北京慧荣和科技有限公司,CHT-24 口鼻式染毒装置购于美国CHT 公司,HP1712 吸入全身暴露装置购于北京汇普仪器设备科技有限公司,NE-C28 医用雾化器购于日本欧姆龙公司,TVA-1000B挥发性有毒气体检测仪购于美国热电公司,BS-220全自动生化分析仪和BC-5000VET 全自动血液分析仪购于深圳迈瑞生物医疗电子股份有限公司,CBS-400 电解质分析仪购于烟台卓越生物技术责任有限公司,PUN-2048B半自动凝血分析仪购于北京普朗新技术有限公司,2 L、40 L Tedlar®PVF 采样袋购于大连德林气体包装有限公司,5 L/min 流量计购于美国德威尔公司,37XB 倒置生物显微镜购于上海光学仪器厂,ELx808酶标仪购于美国伯腾仪器有限公司,IP-20T真空泵购于日本SIBATA公司。
血液或生化测定试剂盒购于深圳迈瑞生物医疗电子股份有限公司,凝血酶测定试剂盒购于上海太阳生物技术有限公司。苏木素染色液、伊红染液、四甲基噻唑蓝(dimethylthiahiazo phenytetrazoliumromide,MTT)溶液等购于北京索来宝科技有限公司,99.99%高纯氧、人造空气购于北京亚南伟业气体有限公司。
1.1.3 实验动物及细胞株SPF级SD大鼠100只,普通级Hartley 豚鼠24只,雌、雄各半,由斯贝福(北京)生物技术有限公司提供,生产许可证号:SCXK(京)2016-0002。实验动物使用许可证号:SYXK(京)2018-0009。
Ames 试验菌株TA 系列购于美国Molecular Toxicology 公司,小鼠成纤维细胞(L929)购于中国医学科学院基础医学研究所。
1.2 试验方法
1.2.1 细胞毒性试验[5-6]L929 细胞传代培养,试验设空白对照组、阳性对照组、阴性对照组和受试样品组。空白对照组常规操作不放入采样袋;阳性对照组常规操作另加入10% DMSO不放入采样袋;阴性对照组将无菌空气和5%二氧化碳气体混合置于2 L密闭真空采样袋中;受试样品组将3 263 g/m3(CFC115)+872 g/m3(HFC1243zf)、无菌空气、氧气和5%二氧化碳气体混合,置于2 L密闭真空采样袋中(根据空气中含氧量占21%计算)。96 孔细胞培养板置密闭真空采样袋中37 ℃开盖4 h接触气体,闭盖后置CO2培养箱中37 ℃继续培养44 h,移除培养液,每孔加50 μL MTT 溶液,继续于37 ℃培养2 h。弃去MTT 溶液,每孔加100 μL异丙醇溶液,洗脱贴壁细胞,用酶标仪测定吸光度D(570)和D(630)值,根据如下公式计算细胞相对增殖率(relative growth rate,RGR)。

细胞毒性分级判定:RGR≥100 为0 级;RGR 在80~99 为1 级;RGR 在50~79 为2 级;RGR 在30~49 为3 级;RGR 在0~29 为4 级。若阴性对照组的RGR <80,阳性对照组的RGR>30,本次试验结果不成立,应重新试验。
1.2.2 Ames试验[6-7]采用组氨酸缺陷型鼠伤寒沙门氏菌株TA97a、TA98、TA100、TA102 和TA1535,在有或无代谢活化条件(±S9)下采用平板掺入法进行。试验设空白对照组、阳性对照组、阴性对照组和受试样品5 个浓度组,每组设3 个平行皿。空白对照组和阳性对照组常规操作不放入采样袋;阴性对照组和受试样品5 个浓度组在常规操作至顶层培养基固化后,平皿开盖置40 L无菌真空采样袋中,最高浓度分别为3 483 g/m3(CFC115)和931 g/m3(HFC1243zf),以1.7 倍组距稀释4 个染毒浓度,按空气氧含量21%导入不同浓度的受试样品、氧气和空气进行37 ℃密闭气态染毒4 h,闭盖取出平皿置37 ℃继续培养48 h,计数回变菌落数。
1.2.3 急性吸入毒性试验[6,8]取7~9 周龄大鼠20只,雌、雄各半,全部大鼠口鼻暴露染毒持续4 h,吸入受试样品CFC115 (3 115 g/m3)和HFC1243zf (832 g/m3)混合气体,在染毒期间及染毒结束4 h 内不间断临床观察,以后每天观察1 次,连续14 d,观察动物被毛、眼睛和黏膜、呼吸、神经、肢体活动和行为的改变,记录有无流涎、腹泻、震颤、惊厥、昏睡、昏迷等体征出现和消失的时间。试验前后称量大鼠体质量。试验结束全部存活动物处死,大体解剖,观察脏器变化,发现异常组织器官按病理组织学5级法(见表1)观察、判定。
1.2.4 重复吸入局部刺激性试验[6,9]取7~9 周龄大鼠40 只,随机分为空白对照组和受试样品组,每组雌、雄各10 只。空白对照组吸入洁净空气;受试样品组吸入受试样品CFC115 (3.59 g/m3)和HFC1243zf (0.96 g/m3)混合气体,口鼻暴露染毒每天4 h,连续染毒7 d。末次染毒结束后4 h和24 h,每组取雌、雄各5只存活大鼠进行大体剖检,观察呼吸道局部(鼻、喉、气管、肺脏),口腔,咽,食道黏膜及其他组织脏器有无充血、红肿等体征,观察呼吸道组织器官病理组织学变化,发现异常组织器官按5级法(见表1)对病变进行观察、判定。

表1 病理组织学观察病变分级
1.2.5 全身主动过敏试验[6,9]取6~9 周龄Hartley 豚鼠24只,随机分为空白对照组、阳性对照组、受试样品低、高浓度组,每组雌、雄各3 只。空白对照组吸入洁净空气;阳性对照组雾化吸入卵白蛋白60 mg(诱导浓度10 mg/mL)或120 mg(激发浓度20 mg/mL);低浓度组吸入诱导浓度为2.80 g/m3的CFC115 和0.75 g/m3的HFC1243zf,激发浓度为5.77 g/m3的CFC115 和1.54 g/m3的HFC1243zf;高浓度组吸入诱导浓度为9.43 g/m3的CFC115和2.52 g/m3的HFC1243zf,激发浓度 为18.82 g/m3的CFC115 和5.03 g/m3的HFC1243zf。口鼻暴露染毒每次30 min,诱导吸入,隔天1 次共5次,于第1 次染毒后的第22 天和第29 天进行激发吸入。2次激发吸入后分别观察各组豚鼠3 h,根据激发致敏后豚鼠过敏反应出现的体征(见表2,序号1~4 为弱阳性;5~10为阳性;11~19为强阳性;20为极强阳性),最终评价豚鼠致敏反应程度。
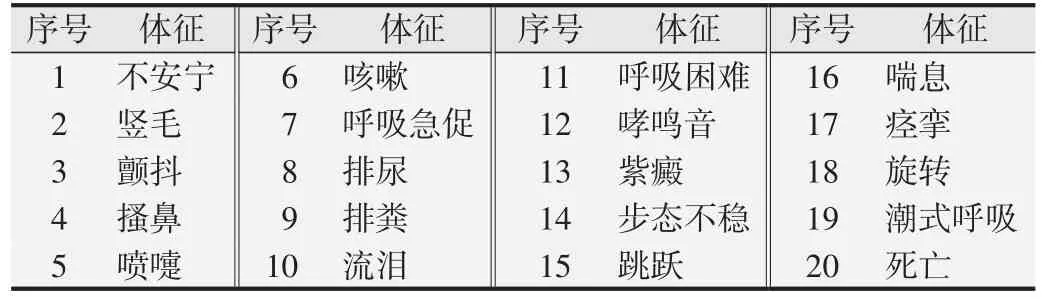
表2 豚鼠过敏反应观察体征
1.2.6 重复吸入亚慢性毒性试验[6,10]取6~8 周龄大鼠40 只,随机分为空白对照组和受试样品组,每组雌、雄各10只,空白对照组吸入洁净空气;受试样品组吸入CFC115 (3 205 g/m3)和HFC1243zf (856 g/m3)混合气体,口鼻暴露每天染毒2 h,连续染毒21 d。在染毒期间观察和检测大鼠的临床体征、进食量、体质量增长变化。染毒结束取血检测血常规:红细胞计数(RBC)、白细胞计数(WBC)及5 项分类、红细胞容积(HCT)、血红蛋白(HGB)、血小板计数(PLT)及凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)共12 项;血液生化学:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(CREA)、尿素氮(UREA)、碱性磷酸酶(ALP)、血糖(GLU)、总胆红素(TBil)、总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、钾离子(K)、氯离子(Cl)、钠离子(Na)共14 项;尿液:比重(SG)、酸碱度(pH)、亚硝酸盐(NIT)、尿蛋白(PRO)、潜血(ERY)、尿胆红素(BIL)、尿胆原(UBG)、酮体(KET)、尿糖(GLU)、白细胞(LEU)共10 项指标。解剖大鼠组织器官,称取脏器质量,计算脏器系数,观察病理组织学变化,发现异常组织器官按5级法(见表1)对病变进行观察、判定。
1.3 统计学分析及判定
试验动物的体质量、血常规、生化学、脏器系数和回变菌落数等指标的统计以表示,采用SPSS 19.0 软件进行回归计算和统计分析,经F检验、泊松分布或双侧t检验判定P值。大鼠重复吸入刺激性试验根据呼吸道局部大体观察和病理学观察进行级别判定;豚鼠全身主动过敏试验根据致敏反应出现的症状和程度进行级别判定。细胞毒性试验≤1级为阴性,2级为可疑阳性,≥3 级为阳性。Ames 试验受试样品各浓度组与阴性对照组比较,各试验菌株的平均回变菌落数≥2倍判定为阳性。
2 结果
2.1 细胞毒性试验
空白对照组细胞生长良好;阳性对照组细胞毒性反应均为4 级,判定为强阳性,表明本试验敏感、有效;阴性对照组和受试样品组细胞毒性反应均为0级。见表3。
表3 细胞毒性试验结果(,n=8)
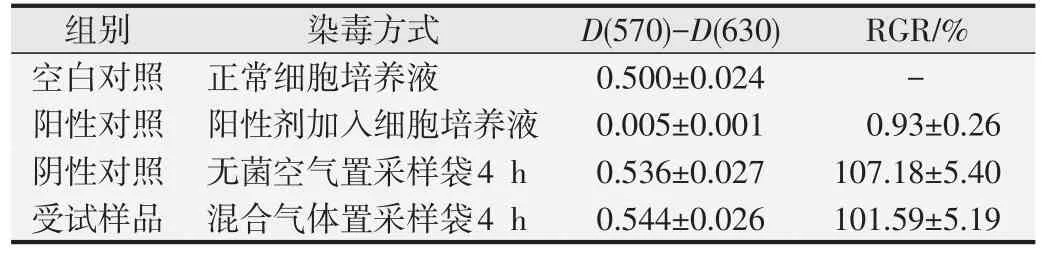
表3 细胞毒性试验结果(,n=8)
2.2 Ames试验
空白对照组与阴性对照组各试验菌株的平均回变菌落数均在正常范围内;阳性对照组各试验菌株的平均回变菌落数为阴性对照组的2 倍以上,判定为阳性结果;受试样品各浓度组各试验菌株的平均回变菌落数与阴性对照组基本一致,未见明显升高。见表4。
表4 Ames试验回变菌落数观察(,n=3)
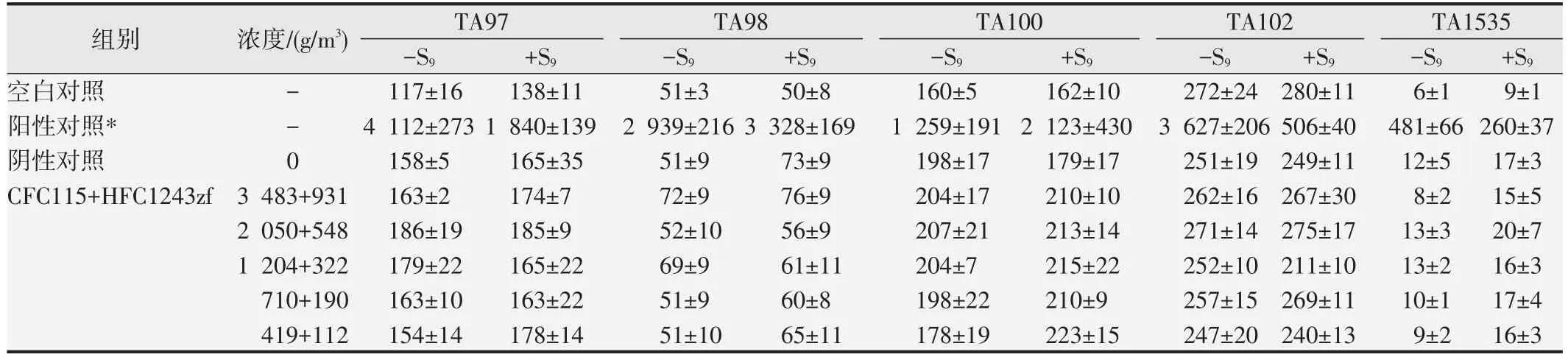
表4 Ames试验回变菌落数观察(,n=3)
*-S9:TA97、TA98(敌克松,50 mg/皿);TA100、TA102(甲基磺酸甲酯,2.5 mg/皿、4.0 mg/皿);TA1535(叠氮钠,1.5 mg/皿).+S9:TA97、TA98、TA100(2-氨基芴,20 mg/皿);TA102(1,8-二羟基蒽醌,100 mg/皿);TA1535(2-氨基蒽,20 mg/皿).
2.3 急性吸入毒性试验
持续染毒4 h和14 d观察期,大鼠均未发现毒性反应,观察期结束全部存活大鼠体质量平均增长46~115 g,大体剖检无异常发现。其半数致死浓度(LC50)大于口鼻暴露染毒实际浓度,即3 115 g/m3的CFC115和832 g/m3的HFC1243zf。见表5。
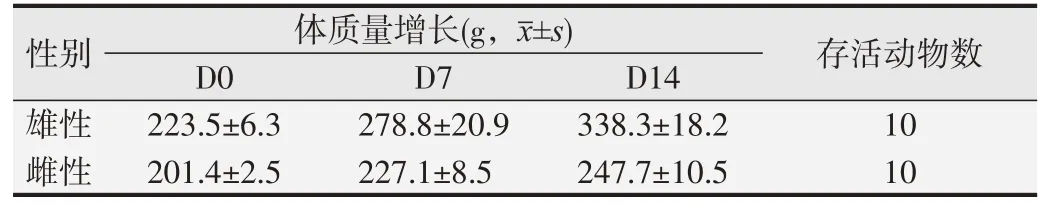
表5 急性吸入毒性试验结果(n=10)
2.4 重复吸入局部刺激性试验
口鼻暴露染毒期间,大鼠未见异常,末次染毒后4 h 和24 h,分别处死半数大鼠,大体剖检观察呼吸道、上消化道黏膜未发现红肿、充血和出血等现象,体表和内脏器官未见组织异常改变。组织病理学检查气管、支气管、肺脏、食管、咽喉、鼻腔、口腔黏膜等各层组织结构清晰,细胞形态、数量比例未见异常,未见变性、水肿、坏死、出血、异常增生、炎症等组织病理学改变,按5级法对病变分级均为0~1级。
2.5 全身主动致敏试验
豚鼠口鼻暴露染毒激发致敏第22 天和第29 天分别大体观察:空白对照组和受试样品组,未出现过敏反应体征;阳性对照组全部动物则出现颤抖、搔鼻、呼吸急促、呼吸困难、步态不稳、喘息及痉挛等强过敏反应。见表6。
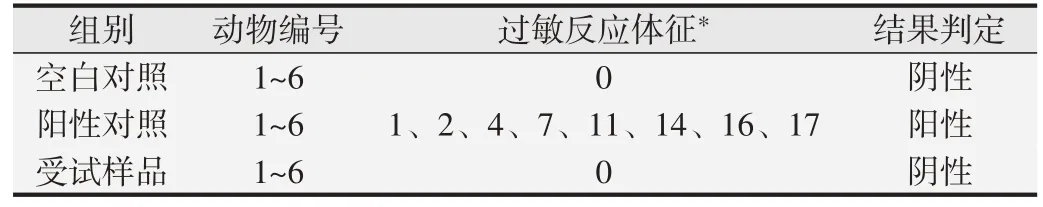
表6 豚鼠激发致敏后全身致敏反应观察
2.6 重复吸入亚慢性毒性试验
口鼻暴露染毒期间,大鼠精神好、行为正常、反应敏捷、被毛润泽、棕黑色软便,未见明显中毒体征,与空白对照组比较,大鼠饲料摄入量和体质量降低(P<0.05 或P<0.01),血液Bas、AST、UREA 和脑系数值升高(P<0.05或P<0.01),尿液还出现NIT、KET和PRO 升高(P<0.05 或P<0.01)等;另外,雄性大鼠血液Mon、Eos、ALT、ALP和尿液pH升高,肺脏湿质量和系数降低(P<0.05 或<0.01);雌性大鼠血液RBC、HGB、HCT、TBiL、K 和肾上腺系数值升高(P<0.05 或P<0.01),血液WBC、尿液pH 和卵巢湿重值降低(P<0.05 或P<0.01)。见表7~10。组织病理学观察(见图1)发现,受试样品组5 只大鼠可见心内膜灶性或多灶性坏死,单核细胞浸润,病变等级在1~3 级,未见呼吸系统器官和其他组织脏器与受试样品暴露染毒相关病变。
表7 受试样品对大鼠体质量增长及摄食量的影响(,g)
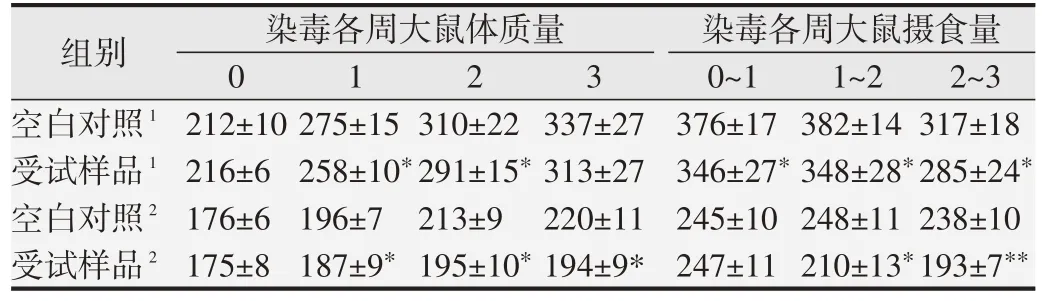
表7 受试样品对大鼠体质量增长及摄食量的影响(,g)
1:雄鼠;2:雌鼠.与同一周次对照组比较,*P<0.05;**P<0.01.
表8 受试样品对大鼠血液学部分指标的影响()
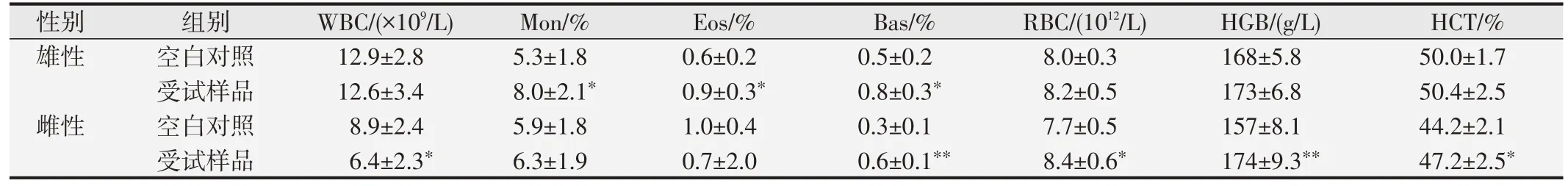
表8 受试样品对大鼠血液学部分指标的影响()
与空白对照组比较,*P<0.05;**P<0.01.
表9 受试样品对大鼠血液生化学部分指标的影响()
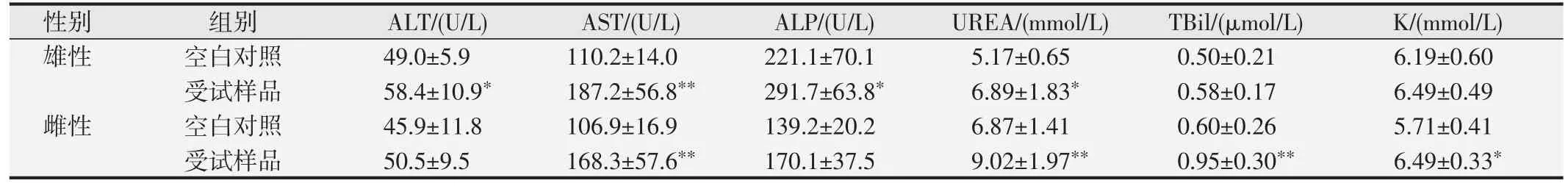
表9 受试样品对大鼠血液生化学部分指标的影响()
与空白对照组比较,*P<0.05;**P<0.01.
表10 受试样品对大鼠尿液及脏器部分指标的影响()
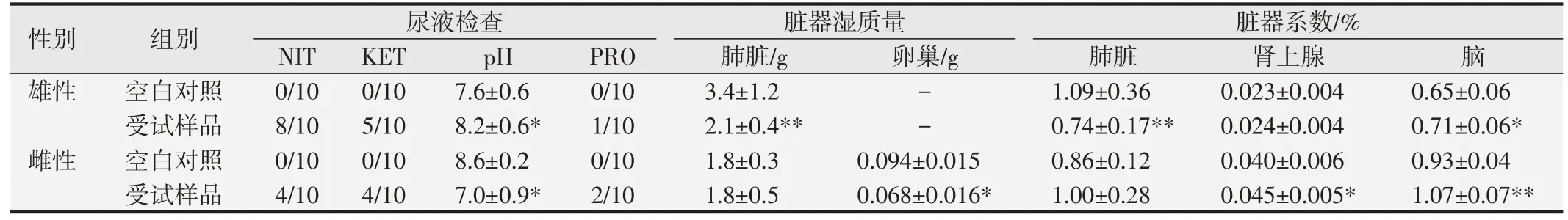
表10 受试样品对大鼠尿液及脏器部分指标的影响()
与空白对照组比较,*P<0.05;**P<0.01.
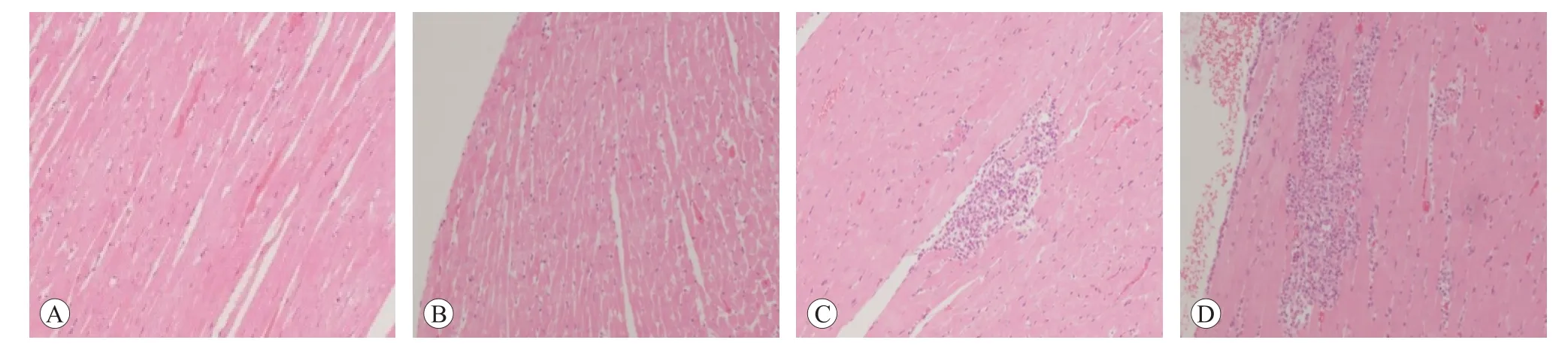
图1 心肌组织病理学观察
3 讨论
HFA-134a 是国际公认的氟利昂抛射剂替代物,对其安全性已有多方面的研究,LC50>3 114 g/m3[11],与多数氢氟烷烃类相似属于毒性较低物质[12]。然而,在不同厂家、不同工艺所生产的产品中杂质的成分和含量差别较大,这些杂质的结构类似氟碳化合物,不同氟碳组合的化合物毒性有很大区别,如全氟烷酸类化合物对水生生物和哺乳动物均可产生广泛的毒性效应,包括肝脏毒性、免疫毒性、生殖和发育毒性以及神经毒性,甚至有可能诱发肝、睾丸、胰脏和乳腺癌[13],2,2,2-三氟乙醇也被证实可导致急性肾衰竭[14],HFA-134a 在3 340 g/m3以上浓度可导致心脏对肾上腺素敏感性增加[11]。CFC115 和HFC1243zf 这两种杂质是国产HFA-134a 中的主要杂质,欧洲药典[15]和FDA计量吸入器(MDI)和干粉吸入器(DPI)产品-质量考量工业指南草案[16]规定两种杂质的含量均不得超过0.005‰,而《中国药典》2020年版收录的标准中只规定杂质总量不应超过0.05%[1]649。由于CFC115 和HFC1243zf 这两种杂质的毒理学安全性评价尚未见文献报道,因此为制定更加科学的吸入用四氟乙烷标准及杂质的含量限度值范围,需要依据生物安全性风险评估数据为国产产品的吸入安全性提供技术支撑。
体外毒理学试验各规程或方法中,对受试样品的检测均使用溶液或混悬液融入培养基直接接触细胞或细菌等,本研究的受试物是气体,无法溶入液体中,故细胞毒性试验和Ames 试验染毒方式采用密闭真空采样袋置37 ℃培养箱中,每袋按比例充入不同浓度受试样品气体[6-7],打开96孔培养板或培养皿顶盖,让受试样品气体在无菌环境下,较长时间直接接触染毒细胞或细菌(4 h),闭盖后置培养箱中37 ℃继续培养至试验结束,用最大染毒限度观察测定结果,未发现体外细胞毒性作用、Ames试验未发现遗传毒性;体内试验在口鼻式染毒装置中高气体浓度下染毒,大鼠急性吸入毒性试验结果显示其LC50大于本实验设计的染毒浓度;大鼠重复吸入7 d 未见呼吸道局部刺激性;豚鼠5 次诱导吸入后激发致敏未见全身致敏反应。大鼠连续吸入染毒21 d的亚慢性毒性试验,在3 205 g/m3的CFC115和856 g/m3的HFC1243zf混合气体染毒后出现统计学差异的指标如下:摄食量减少、体质量增长缓慢,血液白细胞分类Bas、Mon 百分数增高,生化AST、ALT、T-BIL、ALP、UREA 平均值增高,尿液NIT、KET、个别PRO 和LEU 平均值增高,脑系数值增高和卵巢湿质量值降低,组织病理学发现心内膜灶性或多灶性坏死、单核细胞浸润的改变,另外雄性大鼠肺脏湿质量值和系数值降低等。其他升高或降低的各指标平均值在各组性别之间出现差异,并无相同项目指标的辅证,认为无毒理学意义。提示该混合气体在高浓度、连续染毒后,对大鼠机体及脏器器官(肝脏、肾脏、肺脏、心脏、卵巢及脑)具有一定的毒性作用。
四氟乙烷(HFA-134a)的成人每日临床最大使用量为0.048 g/(kg·d)[17],中国药典规定杂质总量≤0.05%[1]649,故五氟氯乙烷(CFC115)和3,3,3-三氟丙烯(HFC1243zf) 的成人每日最大暴露量为0.024 mg/(kg·d)。根据大鼠暴露浓度换算大鼠吸入剂量[(样品物质的量×样品体积)/气体标准物质的量]×大鼠的呼吸频率/大鼠体质量],换算出CFC115的大鼠无可见有害作用剂量(NOAEL)为37.26 g/(kg·d),HFC1243zf 的大鼠NOAEL 为9.96 g/(kg·d),按人体等效剂量=大鼠NOAEL/6.3计算,CFC115 的人等效剂量为5.91 g/(kg·d),HFC1243zf 的大鼠吸入剂量为1.58 g/(kg·d),分别为每日临床最大暴露量的2.5×105倍和6.6×104倍。以上两种杂质结果显示:体外试验或短期动物试验在高浓度接触或吸入染毒下未见安全性风险,但较长期反复高浓度吸入染毒对大鼠机体存在多种毒性靶器官,相关内容未见文献报道。故控制杂质成分及含量,在临床使用量较大时(如哮喘等患者使用吸入气雾剂的频次较高),须进行严格安全性论证及综合性风险评估。
[本文在2021 年北京环境诱变剂学会“环境中毒物综合效应与控制高端学术交流会议”青年优秀论文评选中获一等奖,感谢汇智泰康生物技术(北京)有限公司对本研究的支持]

