白木香2种外植体的组织培养
张 燕,孟 慧,吕菲菲,魏建和,樊小红,何 欣,袁白雪,陈 波,杨 云*
白木香2种外植体的组织培养
张 燕1,2,孟 慧1,2,吕菲菲1,魏建和1,2,樊小红1,何 欣1,2,袁白雪1,陈 波1,杨 云1,2*
1. 中国医学科学院北京协和医学院药用植物研究所海南分所/海南省南药资源保护与开发重点实验室/国家中医药管理局沉香可持续利用重点研究室,海南海口 570311;2. 中国医学科学院北京协和医学院药用植物研究所/中草药物质基础与资源利用教育部重点实验室/濒危药材繁育国家工程实验室,北京 100193
沉香是国际上极负盛名的药用和香料资源之一。在亚洲许多国家,沉香产业既是传统行业也是发展迅猛的新兴产业。沉香优良种质的大规模应用对沉香产业的可持续发展具有重大意义。因此优良沉香种质资源是近年沉香产业关注的重点和热点,但一些优良种质的品质特性无法通过有性繁殖遗传,大规模繁育存在技术障碍。植物组织培养技术在品种优良性状保持、种子资源保存、快速繁殖等方面具有非常突出的优越性,被广泛应用于中药资源保护和中药产业发展。为建立工业化生产的沉香广谱再生体系,本文以白木香无菌苗和成龄植株的枝条为材料从外植体消毒、丛生芽诱导和生根培养三方面进行组织培养研究。结果表明,通过0.1%多菌灵溶液浸泡3 min,流动水冲洗3 h处理,对采摘自大田的白木香枝条有较好的除菌效果。0.1%升汞溶液消毒6~8 min,可有效保持外植体的成活率。在培养基中适当添加灭菌剂也能有效控制材料染菌。无菌苗茎段丛生芽诱导较易,大田枝条的丛生芽诱导较难。WPM + 20 g/L蔗糖+0.5 mg/L 6-BA+0.2 mg/L NAA (G4)有利于无菌苗的丛生芽诱导;1/2 MS+25 g蔗糖+2 mg/L 6-BA+0.01 mg/L NAA (I3),1/4 MS+20 g/L蔗糖+ 2 mg/L 6-BA+0.5 mg/L NAA (J2)和WPM+20 g蔗糖+1 mg/L 6-BA+0.01 mg/L NAA (K2)有利于成龄植株枝条外植体的丛生芽诱导,将膨大的丛生芽团切割后转接于不含植物生长调节剂的WPM培养基中可促进丛生芽伸长。WPM培养基中添加10~20 g/L蔗糖,并加入0.1~0.5 mg/L NAA可诱导无菌苗和茎段外植体的新芽生根。本研究以沉香2种外植体进行组织培养,成功获得再生植株,为沉香优良种质的无性繁殖提供技术参考。
白木香;组织培养;外植体消毒;丛生芽诱导;生根培养
沉香是瑞香科(Thymelaeaceae)沉香属()植物受伤后形成的含树脂的木材,是传统名贵中药和重要香料,有“药中黄金,香中之王”之美称[1]。《本草纲目》中记载“海南沉香,一片万钱”,并依沉水程度将沉香分为沉水香、栈香和黄熟香三级[2]。奇楠沉香作为沉香中的珍品,不仅香味袭人,更是药物中的珍宝[3]。沉香作为药用具有行气止痛、温中止呕、纳气平喘之功效,自古以来医家都选用上等沉香入药。沉香作为香料在日本、中东、欧美等国家和地区也被广泛应用于香道、宗教用香和香水产业等[4]。沉香野生资源由于品质良好深受人们追捧,但多年来遭到过度开发,资源濒临灭绝[5]。天然沉香的稀缺导致沉香价格居高不下,品质较好的沉香市场价格高到万元每克[6]。
白木香[(Lour.) Gilg]是国产中药沉香的基原物种[7-8]。为了解决沉香资源少,优质沉香资源匮乏的问题,我国沉香主产区广东、海南、云南、广西和福建等地大面积种植白木香树[9],同时开展结香技术研究[10-12]。魏建和团队创造发明的通体结香技术具有“三高一稳定”的特点[13],解决了沉香产业化生产中的结香技术瓶颈问题,为沉香市场提供了大量的沉香药材,基本解决了沉香资源的供应问题。但面临市场对高品质沉香的需求量持续上涨,优质沉香的价格仍然高企。
沉香优良结香种质是决定沉香品质的重要因素之一,优质种质资源的选育和应用是沉香高质量发展的有效途径。近年来,许多研究者和种植农户在沉香优良种质资源的选育和繁殖做了大量工作,在研究和实践中发现传统有性繁殖存在种子存活时间短、种子(种苗)来源不清、后代性状分离的问题[14-17]。历史上有“有奇楠香,没有奇楠树”的说法,即野生高品质白木香树实生苗未能遗传母本结香优良性状[2],而将母树枝条嫁接至白木香可结出高品质沉香[18]。因此,无性繁殖方式是沉香优质种质资源的最佳繁育方式。现有的无性繁殖方式有扦插、嫁接、高空压条、组培等[19-20],已证实沉香属植物扦插成活率很低[21];高空压条繁育速度慢,无法大规模生产[22];实践中发现嫁接虽然在沉香优质种苗方面有大规模应用,但也存在种质混杂、代数退化及成活率不高等问题,在一定程度上也造成了白木香砧木的浪费。
植物组织培养技术的发展依据植物细胞的全能性理论和植物生长调节剂的应用,组织培养具有繁殖速度快、周期短、环境条件可控和经济效益高等特点,在品种优良性状保持、种质资源保存、快速繁殖方面等具有非常突出的优越性[23],广泛应用于中药资源保护和中药产业发展[24]。利用植物组织培养技术繁殖白木香优良种质,对沉香产业的可持续发展和白木香野生资源的保护有十分重要的意义。前人对白木香组织培养繁殖方式研究取得一定的进展,但大部分研究者选择采用苗圃或温室栽培的幼嫩小苗或种子培养的无菌苗作为材料进行组织培养[25-28],所建立的再生体系不具有广谱性,且无法保证再生植株为结香优良种质。以成龄植株枝条为外植体能够保证优良种质遗传的稳定性,但以自然生长环境下的植株为材料受生长环境、生长季节、光照、水分等因素影响,材料消毒和培养难度较大。植物组织培养中,污染主要来自外植体,除了表面的污染外,内生菌也普遍存在于植物组织中,难以采用常规方法彻底消灭[29]。大量研究表明,白木香植株体内携带一定数量的内生真菌和细菌[30],对白木香的组织培养消毒影响重大。其次,木本植物增殖、生根困难也是阻碍组培苗产业化的关键问题。因此,本研究针对外植体消毒、丛生芽诱导和生根培养进行了研究,旨在为白木香优良种质的育种工作和沉香优质种苗生产提供技术支持。
1 材料与方法
1.1 材料
本研究所用的材料均来自中国医学科学院药用植物研究所海南分所海口研发中心试验田种植的3年生白木香树。分别以其种子培养的无菌苗和当年萌发枝条为外植体。
1.2 方法
1.2.1 成龄植株枝条外植体消毒方式研究 ①外植体前处理方式研究:将采摘自大田的枝条做不同前处理。枝条基部老茎和叶片剪除后分为含有2~3个腋芽的小段。采用50%的多菌灵(0.1 g/L)分别处理3、5、10 min(分别对应处理A1、A2、A3),流动水冲洗30 min;采用多菌灵溶液浸泡3 min,流动水分别处理1、2、3 h(分别对应处理B1、B2、B3)。前处理完成后将外植体转移至超净工作台,75%乙醇浸泡30 s,无菌水冲洗1次。0.1%升汞溶液浸泡8 min,无菌水冲洗5次。将外植体取出置于滤纸上吸干水分,切除与消毒剂接触部分后,接种于WPM培养基中,每种前处理方式接种15个外植体,重复3次,7 d后统计接种外植体的染菌数量和存活数量,分别计算染菌株数和存活株数占总接种外植体数量的比例,取3次重复的平均值作为3种前处理方式的染菌率和存活率。
②外植体消毒方式研究:修剪好的枝条外植体在洗洁精水溶液中浸泡搅拌15 min,多菌灵溶液浸泡3 min,流动自来水冲洗30 min,完成预处理后转入超净工作台。75%乙醇浸泡30 s,无菌水冲洗1次,分别做单一升汞(HgCl2)溶液不同时长处理和升汞(HgCl2)溶液配合过氧化氢(H2O2)溶液不同时长处理。0.1%升汞溶液处理时长分别为6、8、10 min(分别对应处理C1、C2、C3);10%过氧化氢溶液处理时长分别为2、5、10 min(分别与0.1%升汞溶液处理5 min配合使用,对应处理D1、D2、D3)。消毒液处理后,无菌水冲洗5次。将外植体取出置于滤纸上吸干水分,切除与消毒剂接触部分后,接种于WPM培养基中,每种消毒方式接种15个外植体,重复3次,7 d后统计接种外植体的染菌数量和存活数量,分别计算染菌株数和存活株数占总接种外植体数量的比例,取3次重复的平均值作为3种外植体消毒方式的染菌率和存活率。
③灭菌药剂筛选:枝条外植体在洗洁精水溶液中浸泡搅拌15 min,多菌灵溶液浸泡3 min,流动自来水冲洗30 min;在超净工作台中使用75%乙醇浸泡30 s,无菌水冲洗1次,0.1%升汞溶液处理8 min,无菌水冲洗5次;将外植体取出置于滤纸上吸干水分,切除与消毒剂接触部分后,接种于添加灭菌药剂的WPM培养基中,添加卡松处理浓度为:100 μL/L、1 mL/L、5 mL/L(分别对应处理E1、E2、E3);添加植菌清处理浓度为:2、2.5、3 mL/L(分别对应处理F1、F2、F3)。每种消毒方式接种15个外植体,重复3次,7 d后统计接种外植体的染菌数量和存活数量,分别计算染菌株数和存活株数占总接种外植体数量的比例,取3次重复的平均值作为使用灭菌药剂处理方式的染菌率和存活率。
1.2.2 丛生芽诱导研究 ①无菌苗丛生芽诱导:以种子培养的无菌苗为材料,截取茎段,接种于不同培养基中(表1),温度为(25±2)℃,湿度为60%,光照/黑暗时间为13 h/11 h的条件下培养。每种培养基接种30个无菌苗茎段,50 d后统计丛生芽的数量和生长丛生芽茎段的株数,计算新萌发丛生芽的数量与生长丛生芽的茎段数比例作为丛生芽诱导率。
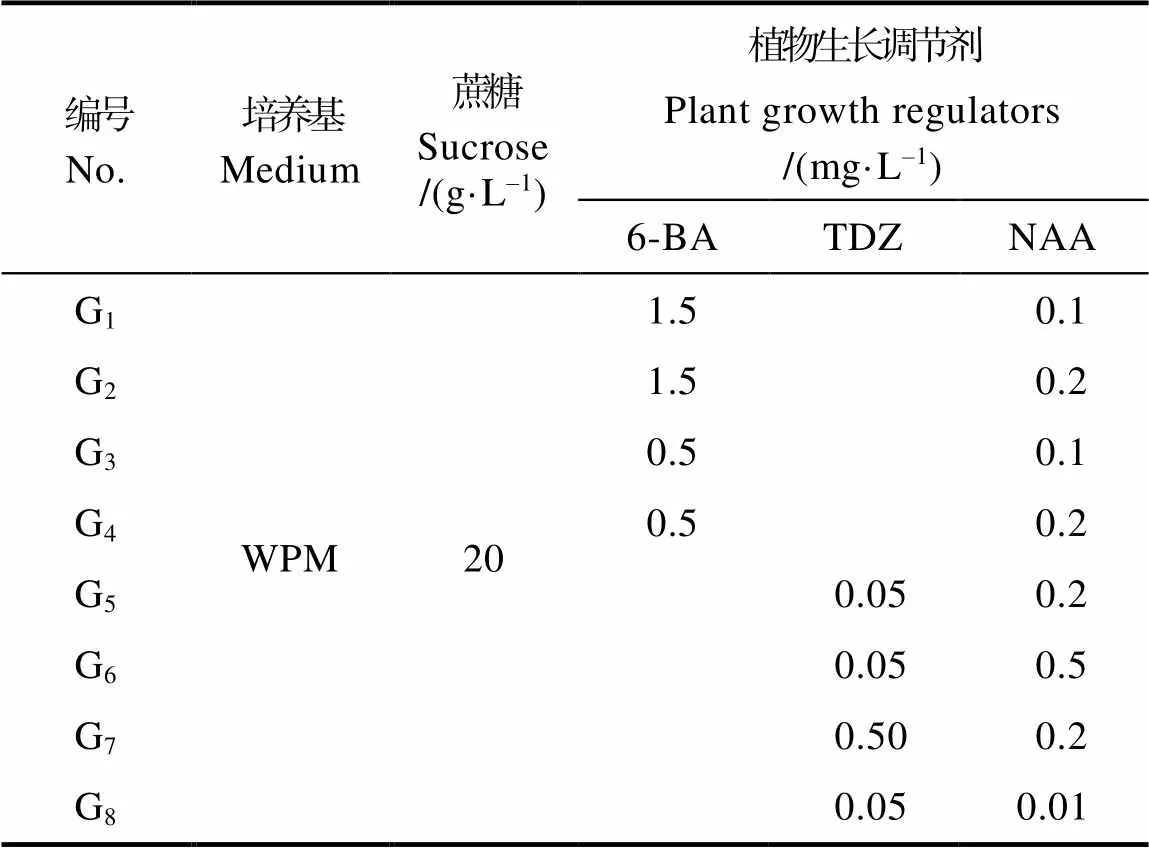
表1 无菌苗茎段丛生芽诱导培养基
②成龄植株枝条丛生芽诱导:以大田采集的成龄植株幼嫩枝条为材料,灭菌消毒后修剪为含有2~3个腋芽的小段,接种于不同培养基中(表2),温度为(25±2)℃,湿度为60%,光照/黑暗时间为13 h/11 h的条件下,培养基接种30个无枝条茎段,50 d后统计丛生芽的数量和生长丛生芽外植体株数,计算新萌发丛生芽的数量与生长丛生芽的外植体数量比例作为丛生芽诱导率。

表2 枝条茎段外植体丛生芽诱导培养基
1.2.3 生根诱导 分别以无菌苗的茎段和枝条诱导的丛生芽为材料,接种于不同生根培养基中(表3),培养条件:温度为(25±2)℃,湿度为60%,光照/黑暗时间为13 h/11 h。45 d后统计存活株数和生根株数,计算生根植株的数量与存活的材料数量比例为生根率。
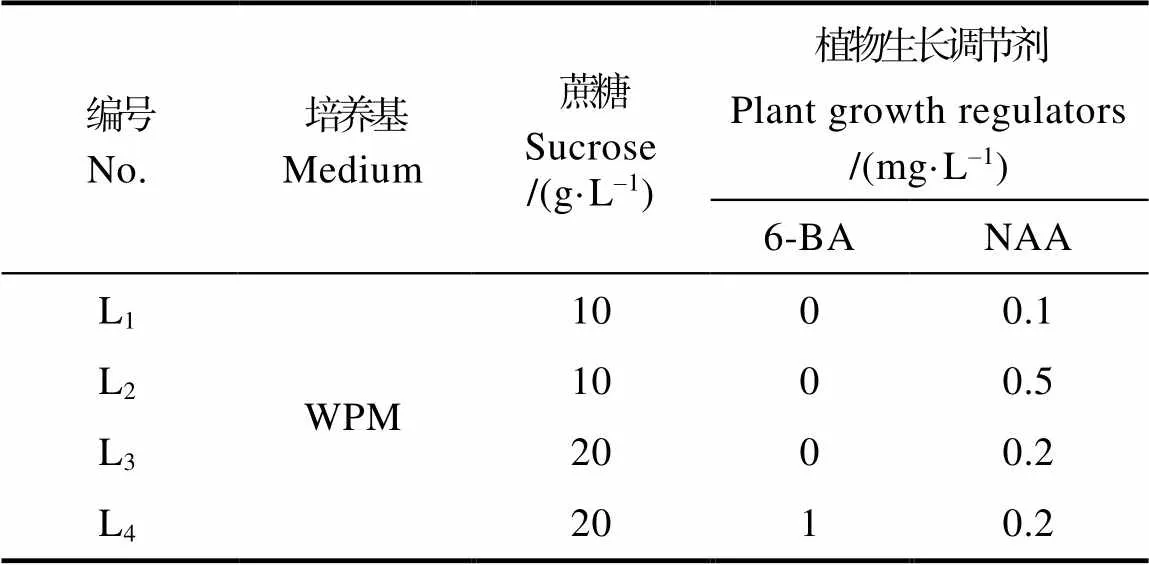
表3 生根培养基
2 结果与分析
2.1 茎段外植体消毒方式研究
①茎段外植体前处理方式。采用多菌灵溶液浸泡和流动水冲洗2种前处理方式对白木香茎段外植体进行灭菌实验,结果如图1。延长流动水冲洗时间的前处理方式下外植体染菌率总体低于延长多菌灵溶液浸泡时间的前处理方式,且存活率高于多菌灵溶液浸泡的前处理方式。随着多菌灵溶液浸泡时间延长,外植体的存活率下降,采用多菌灵浸泡处理3 min,外植体存活率为57.78%。而随着流动水冲洗时间延长,外植体的染菌率明显下降,流动水冲洗3 h时,存活率达到73.77%,染菌率下降到6.67%。
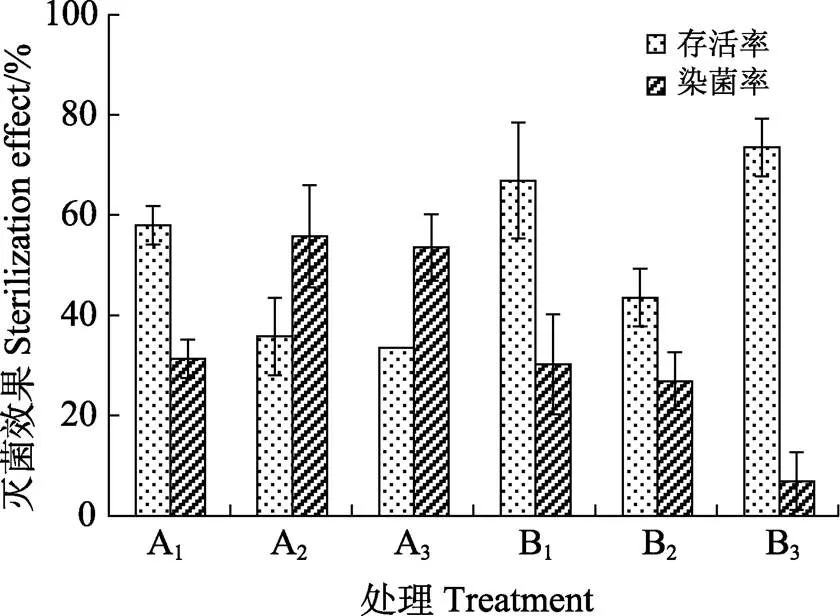
图1 不同消毒前处理方式对茎段外植体的灭菌效果
②茎段外植体消毒方式。以过氧化氢(H2O2)溶液配合升汞(HgCl2)溶液处理方式和单独使用HgCl2溶液方式分别对白木香茎段外植体进行消毒实验,结果如图2。延长HgCl2溶液浸泡时间的消毒方式外植体染菌率显著低于延长H2O2溶液浸泡时间的处理方式,且存活率远高于延长H2O2溶液浸泡时间的处理方式。H2O2+HgCl2处理方式下,外植体存活率极低,将H2O2浸泡的时长增加至10 min,其外植体的存活率仅有20%。而单独使用HgCl2溶液处理后,外植体的存活率高达83.33%,染菌率最低仅为13.33%。
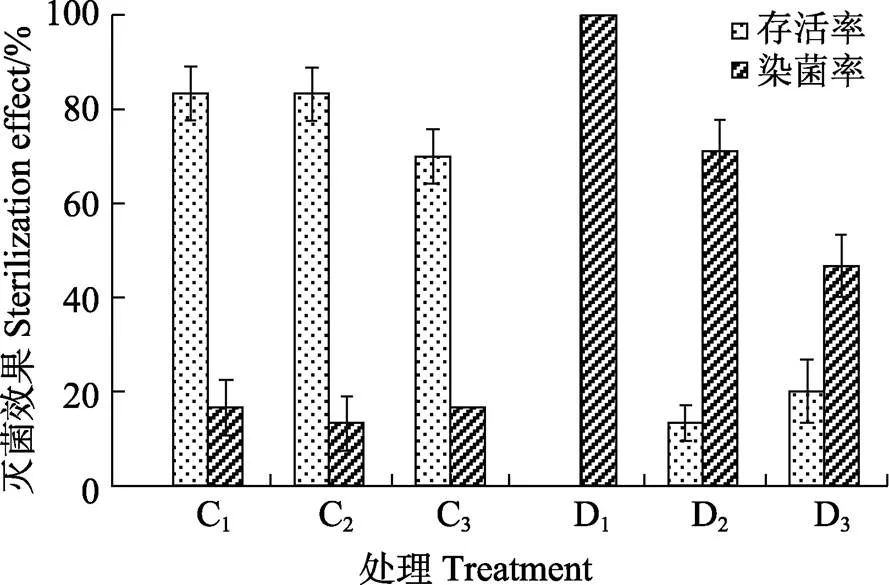
图2 不同消毒方式对茎段外植体的灭菌效果
③灭菌剂最佳利用方式。在培养基中添加卡松和植菌素2种抑菌剂的处理方式对白木香茎段外植体进行灭菌实验,结果如图3。在培养基中添加2种抑菌剂均能获得较高的外植体存活率和较低的染菌率。卡松添加量为1 mL/L时,外植体的存活率达到73.33%,植菌素添加量为2~2.5 mL/L时,存活率高达76.67%,染菌率降低至6.67%。
2.2 丛生芽诱导
①无菌苗丛生芽诱导。无菌苗茎段为材料诱导丛芽实验结果如表4和图4。添加6-BA和NAA两种植物生长调节剂的WPM培养基中可诱导丛芽。添加TDZ和NAA的WPM培养基中愈伤组织生长较好,而丛芽诱导效果较差。G1~G4培养基中均可诱导丛芽,G3培养基中的增殖率最高,增殖倍数达到6倍,但增殖芽的叶片细短;而G4培养基中增殖率较高,增殖倍数为5.5,叶片大且舒展,植株生长健壮,G1培养基中次之。G5~G8培养基中外植体产生大块愈伤组织,诱导的丛生芽难以伸长。
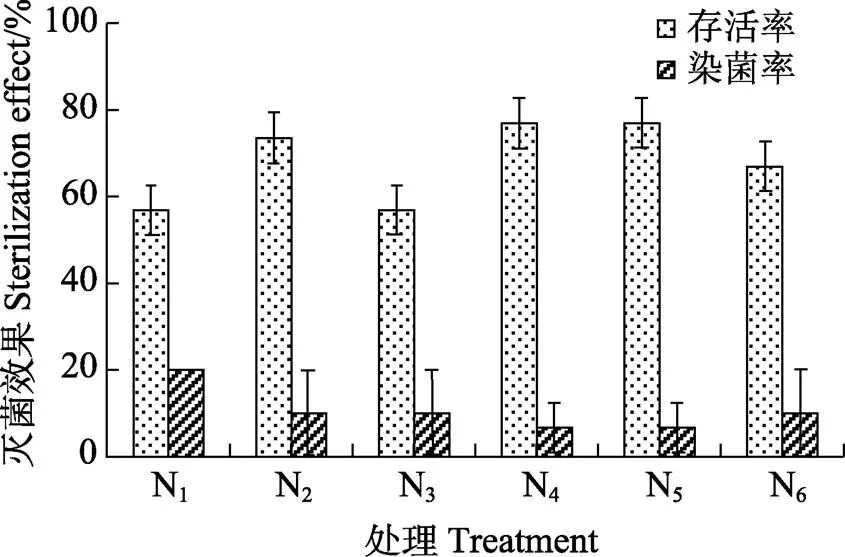
图3 添加不同抑菌剂对茎段外植体的灭菌效果

图4 无菌苗茎段诱导丛芽过程
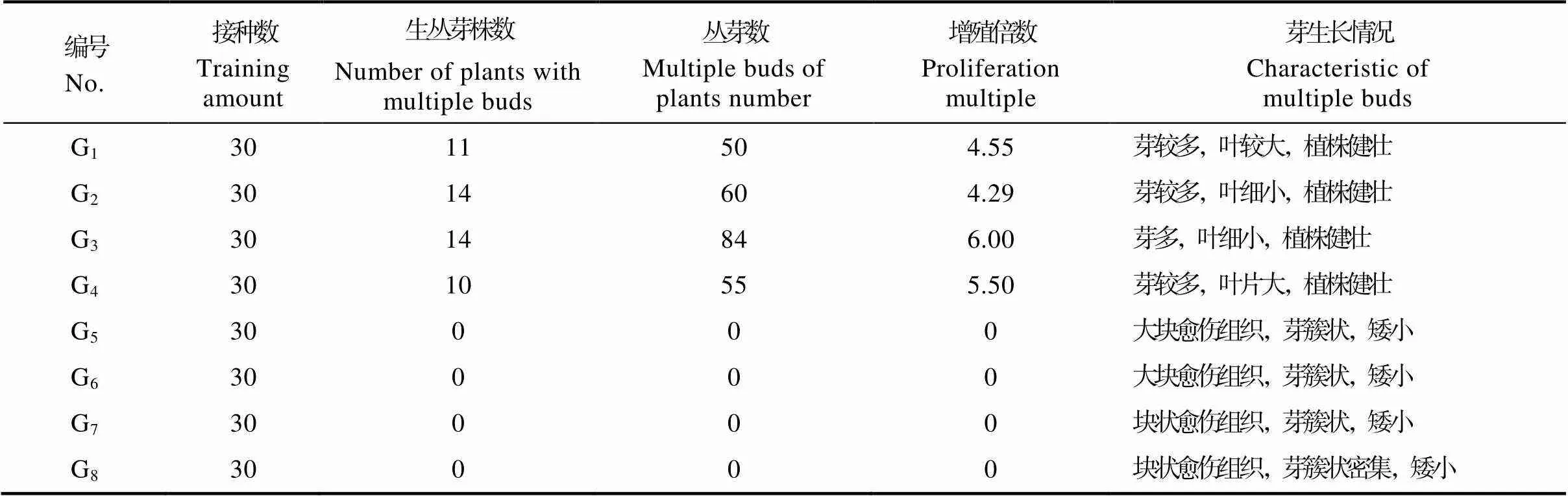
表4 无菌苗丛生芽诱导效果
注:增殖倍数=从芽总数/生长丛芽总株数。
Note: Proliferation multiple=The total number of multiple buds/ The total number of plants with multiple buds.
②成龄植株枝条丛生芽诱导。成龄植株枝条的茎段为外植体丛生芽诱导实验结果如表5和图5,在1/2 MS培养基、1/4 MS培养基和WPM培养基中茎段外植体均可存活,而在MS培养基中,外植体出现黄化、萎蔫、枯死的情况。在I3、J2、K2培养基配方中丛生芽生长良好,在I2、J3、K4培养基配方中能诱导腋芽伸长、在K3培养基配方中茎段基部产生愈伤组织。将茎段获得丛芽团块整体切下后转接至不含植物生长调节剂的WPM培养基中,不定芽伸长,植株健壮,可用于继续增殖或生根培养。
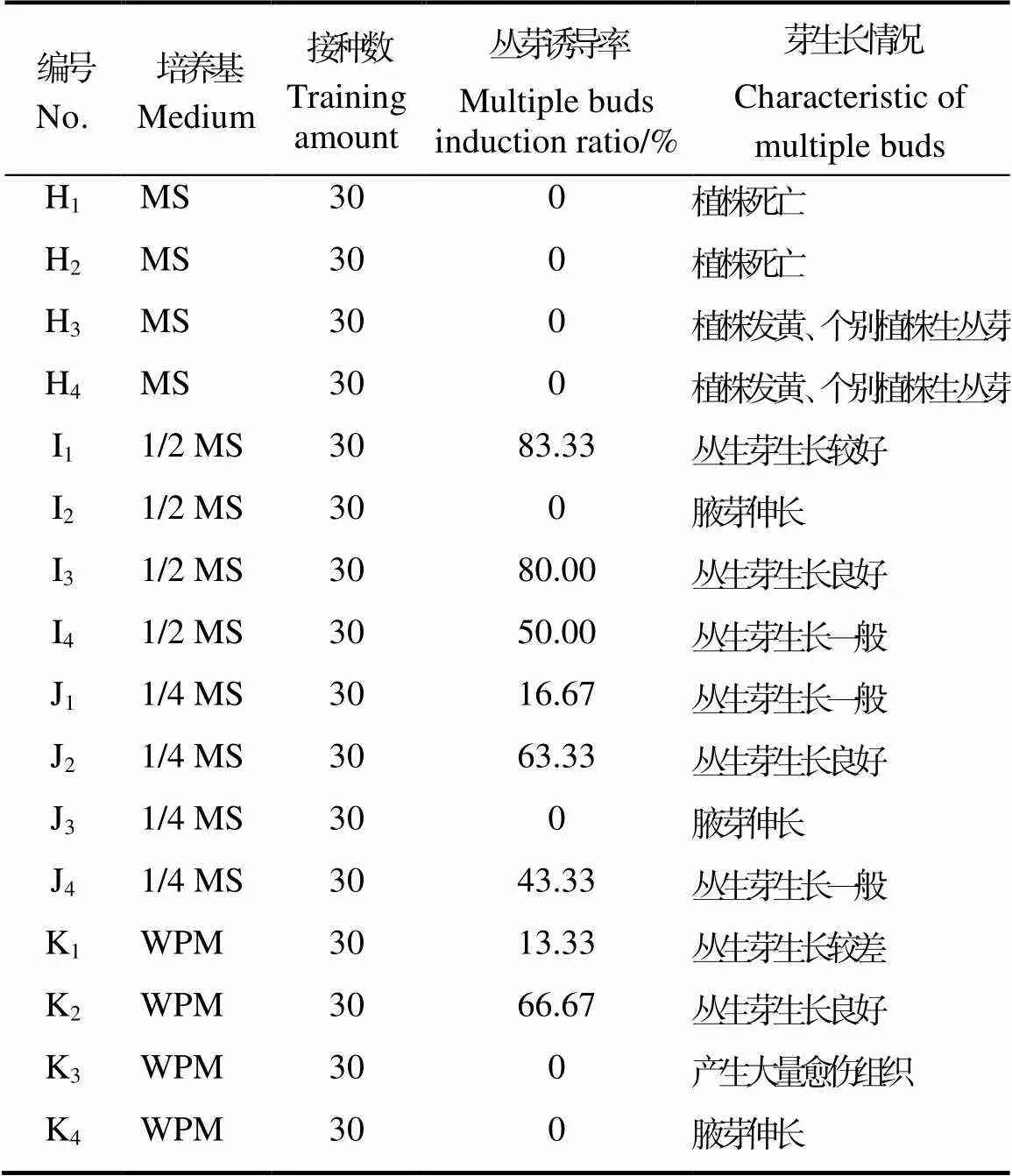
表5 茎段外植体丛生芽诱导效果

图5 成龄植株枝条丛生芽诱导过程
2.3 生根诱导
无菌苗茎段生根培养实验结果如表6和图6。L1~L3培养基中均可生根,且培养至30 d时,3个培养基中均有根萌发。培养45 d后统计生根结果如表6,在L1~L3培养基中,生根率分别达到66.67%、76.47%、70.59%,而在L4培养基中无新根产生。
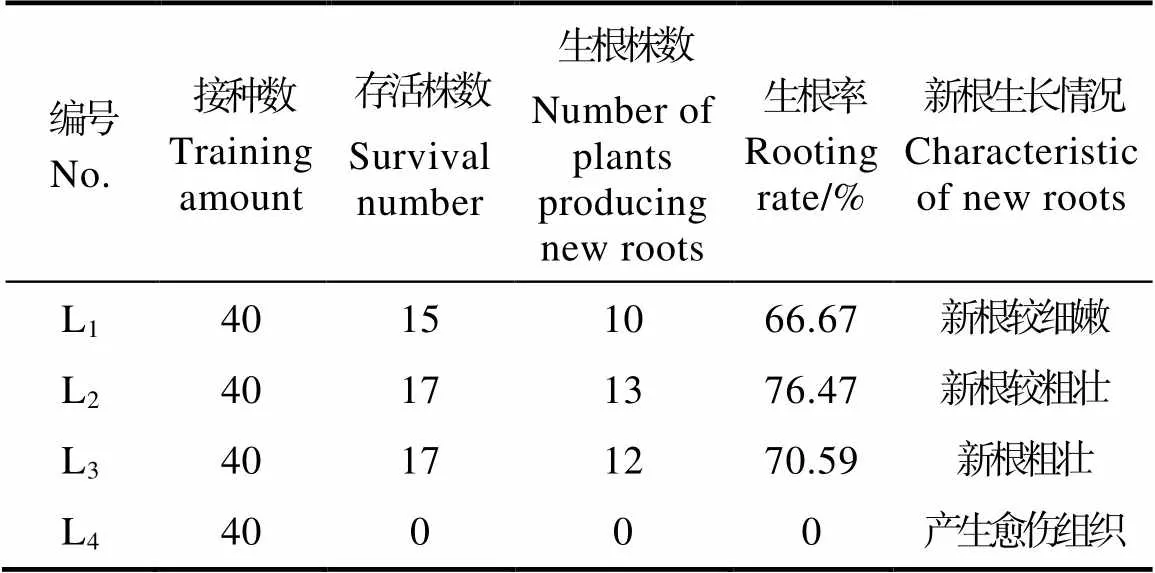
表6 无菌苗生根效果

图6 无菌苗茎段生根过程
将成龄植株枝条茎段诱导的丛生芽分离单枝,在L1~L3培养基中也获得根,但生根数量较少,生根所需时间长(图7)。
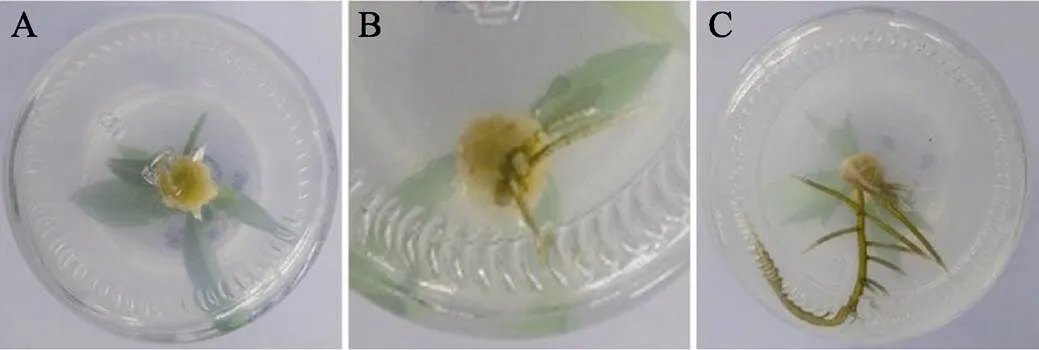
图7 成龄植株枝条生根过程
3 讨论
3.1 外植体的选择和灭菌
外植体选择在一定程度上决定植株再生途径,且生长环境能对其消毒难易程度产生影响。通常情况下生长在自然环境或大田的成龄植株容易在外部和内部感染微生物,且木本植物会随着植物年龄的增加,再生能力下降,因此不作为组织培养的首选外植体材料[23]。而面临物种濒危、种质顽拗性及种子繁育后代性状分离的情况下[31],生长在室外的成龄植株作为组织培养外植体可发挥其数量多、采摘便利、不影响植株整体生长、最大程度上保持物种的遗传稳定性的优势。但目前在沉香属植物组织培养中,由于种子或室内小苗为材料有培养方式简单,成活率高的特点,因此被许多研究者用作首选材料[32-33]。沉香属组织培养一般采用常规两步消毒方式处理获得无菌外植体材料,即先用洗洁精溶液浸泡和清水流动冲洗0.5~1 h,除去表面污垢,其次在超净工作台中用70%~75%的乙醇浸泡30 s、0.1%~0.2%升汞溶液处理5~10 min,以消除外植体表面微生物等[33-34]。但在组织培养研究选择大田植株为材料时需要进行严格的前处理[32]。本研究中发现,成龄植株枝条外植体经多菌灵溶液浸泡3 min,流动水冲洗3 h,0.1%升汞(HgCl2)溶液消毒6~8 min,才能有效提高外植体的存活率。在培养基中添加1 mL/L卡松或2~3 mL/L植菌清也可有效降低大田的枝条外植体的染菌率。
通过外植体消毒研究得出适当的消毒方式能有效的降低外植体的染菌率,多种消毒方式的综合利用能有效提高外植体的存活率。生长在自然环境下的植株,受环境条件影响,且容易受到病虫害侵袭。成年白木香植株枝条嫩茎采用适当的前处理和消毒方式能够有效除菌。
3.2 丛生芽和生根诱导
腋芽从生法以其操作简便,繁殖速度快,可保持遗传稳定性的优势广泛用于园艺、农林果树等林木植物的组培繁殖。高等植物的每一个叶片的叶腋部位都有一个或几个腋芽,以带芽的茎段作为外植体材料,通过促进腋芽最大限度生长,产生的多芽为丛生芽[32]。丛生芽的诱导和生长主要受植物生长调节剂的调控,添加细胞分裂素可促进丛生芽产生,添加植物生长素和赤霉素可诱导茎轴伸长[35]。有研究表示,在沉香属植物组织培养中,添加较高浓度的细胞分类素和较低的生长素有利于芽的分化[36-39]。本研究结果显示,无菌苗诱导丛生芽对植物生长调节剂的要求较低,添加0.5~1.5 mL/L的6-BA和0.1~0.2 mL/L的NAA,均可获得丛生芽;以枝条为材料的丛生芽诱导较复杂,在培养基中添加1~2 mL/L的6-BA和0.01~0.5 mL/L的NAA有利于丛生芽的诱导,将丛生芽转移至不含植物生长调节剂的培养基中有利于芽生长。针对沉香属植物组织培养生根困难问题,许多研究者采用两步生根法在1/2 MS培养基中进行生根培养,并成功生根[39-41]。也有研究者通过直接生根法获得再生植株,在空白WPM培养基中添加NAA/IBA(0.3~0.5 mL/L),生根率可达到65%[40]。本研究结果显示,在WPM培养基中添加0.1~0.5 mL/L NAA,可诱导无菌苗和枝条诱导的丛生芽生根;但成龄植株枝条的芽生根数量较少,生根所需时间长。这可能与材料的复幼程度有关,幼嫩材料与成年阶段的材料相比,生根能力较高。
通过丛生芽诱导研究得出针对不同的外植体材料选择合适的培养基和植物生长调节剂对芽的诱导至关重要。无菌苗为材料诱导丛生芽培养较易,成龄植株的枝条诱导丛生芽较困难,且在生根诱导中成龄植株枝条所获得的丛生芽生根也较困难,这可能与材料的复幼程度有关,幼嫩材料与成年阶段的材料相比,分化能力较高。
4 结论
沉香属植物是全球濒危物种中贸易量最多的物种之一,也是全球最具有商业价值的植物物种之一[41]。面临沉香野生资源破坏严重,栽培种质参差不齐的现状,良种选育和苗木培育工作势在必行。离体组培技术繁殖速度快、效率高,对满足市场需求、提高沉香产业经济效益有重要意义,利用组织培养技术培养的无性系遗传特性一致,对沉香属植物优良种质选育和野生资源保护具有特殊作用[32]。白木香组织培养技术经过多年的探索和研究获得了一定的成果,种子无菌苗再生植株技术已趋于成熟,但在实际生产中发现白木香种子存在性状分离情况,因此以种苗作为组培材料并不能完全保证再生的植株为优良种质量,需要在结香完成后才能辨别。而直接以成龄植株枝条为外植体能够最大程度上保证优良种质,且外植体材料充足。但以自然生长环境下的植株为材料受生长环境、生长季节、光照、水分等因素影响,材料消毒和培养难度较大,所建立的再生体系还不能满足大规模种苗生产,因此还需要进一步完善。建立稳定的白木香植株再生体系,可解决白木香优良种苗的供应问题,将会成为白木香种质资源保护及生产的有效途径,并有望解决目前沉香产业发展中优质沉香资源缺乏的问题。
[1] 杨 云. 沉香: 香药文化酝酿千亿元消费产业[J]. 生命世界, 2020, 370(8): 48-49.
YANG Y. Agarwood: incense and medicine culture brewing a 100 billion consumption industry[J]. Life World, 2020, 370(8): 48-49. (in Chinese)
[2] 刘洋洋. 通体结香技术产沉香的质量特征研究[D]. 北京: 北京协和医学院, 2018.
LIU Y Y.Research on quality chara.cteristics of agarwood produced by whole tree agarwood-inducing technique[D]. Beijing: Peking Union Medical College, 2018. (in Chinese)
[3] 张玉秀, 杨 云, 吕菲菲, 康 勇, 刘洋洋, 陈旭玉, 刘培卫, 魏建和. 基于ISSR技术的白木香奇楠种质遗传多样性分析[J].分子植物育种, 2021, 19(15): 5204-5212.
ZHANG Y X, YANG Y, LYU F F, KANG Y, LIU Y Y, CHEN X Y, LIU P W, WEI J H. Genetic diversity analysis offrom Qinan germplasms by ISSR technology[J]. Molecular Plant Breeding, 2021, 19(15): 5204-5212. (in Chinese)
[4] LÓPEZ-SAMPSON A, PAGE T. History of use and trade of agarwood[J]. Economic Botany, 2018, 72(1): 107–129.
[5] 周亚非, 魏建和, 孙佩文, 刘洋洋, 杨 云, 刘培卫, 丁宗妙, 王 帅, 王灿红. 中国沉香科技创新与产业发展的现状及思考[J]. 中国现代中药, 2017, 19(8)1051-1056.
ZHOU Y F, WEI J H, SUN P W, LIU Y Y, YANG Y, LIU P W, DING Z M, WANG S, WANG C H. The development situation and consideration of agarwood scientific & technological innovation and industrial development[J]. Chinese Journal of Modern Applied Pharmacy, 2017, 19(8): 1051-1056. (in Chinese)
[6] 刘继云, 陈海东. 基于价格形成机制的沉香产业发展问题研究[J]. 海派经济学, 2019, 17(4): 135-143.
LIU J Y, CHEN H D. Mechanism of aquilaria industry development studies based on the price forming[J]. Journal of Economics of Shanghai School, 2019, 17(4): 135-143. (in Chinese)
[7] 董梦妤, 焦立超, 姜笑梅, 张淑娟, 李改云, 殷亚方. 沉香的资源分布、识别与贸易现状[J]. 木材工业, 2016, 30(4): 20-24.
DONG M S, JIAO L C, JIANG X M, ZHANG S J, LI G Y, YIN Y F. Resources, identification and utilization of agarwood[J]. China Wood Industry, 2016, 30(4): 20-24. (in Chinese)
[8] 孟 慧, 张 争, 杨 云, 陈 波. 白木香种子质量分级标准研究[J]. 种子, 2014, 33(5): 114-117.
MENG H, ZHANG Z, YANG Y, CHEN B. Study on quality classification standard of(Lour.) gilg seed[J]. Seed, 2014, 33(5): 114-117. (in Chinese)
[9] 刘 娟. 全球沉香资源的分布与结香方法的研究现状[J].中国食品药品监管, 2020, 203(12): 100-104.
LIU J. The distribution of global agarwood resources and the research status of the method of forming agarwood [J]. China Food and Drug Administration Magazine, 2020, 203(12): 100-104. (in Chinese)
[10] WU Z Q, LIU S, LI J F, LI M C, DU H F, QI L K, LIN L. Analysis of gene expression and quality of agarwood using Agar-bit in[J]. Journal of Tropical Forest Science 2017, 29, 380-388.
[11] 陈 媛, 晏婷婷, 尚丽丽, 王 茜, 李改云. 人工诱导结香技术所产沉香的质量评价[J]. 木材工业, 2018, 32(6): 18-22
CHEN Y, YAN T T, SHANG L L, WANG Q, LI G Y. Quality evaluation of agarwood produced with cultivated agarwood-inducing technology[J]. China Wood Industry, 2018, 32(6): 18-22. (in Chinese)
[12] 何 访. 白木香倍半萜合酶基因的克隆及其启动子功能分析[D]. 海口: 海南大学, 2014.
HE F. Cloning of the sesquiterpene synthase gene inand the function analysis of its promoters[D]. Haikou: Hainan University, 2014. (in Chinese)
[13] LIU Y Y, CHEN H Q, YANG Y, ZHANG Z, WEI J H, MENG H, CHEN W P, FENG J D, GAN B C, CHEN X Y, GAO Z H, HUANG J Q, CHEN B, CHEN H J. Whole-tree agarwood-inducing technique an efficient novel technique for producing high-quality agarwood in cultivatedtrees[J]. Molecules, 2013, 18(3): 3086-3106.
[14] 裘珍飞. 沉香优树嫁接成活率研究[J].热带作物学报, 2014, 35(7): 1262-1266.
QIU Z F. Grafting survival rate ofspp. plus tree[J]. Chinese Journal of Tropical Crops, 2014, 35(7): 1262-1266. (in Chinese)
[15] 刘柏余. 沉香种植现状及发展研究[J]. 乡村科技, 2018(22): 90-91.
LIU B Y. Research on current situation and development of agarwood planting[J]. Rural Technology, 2018(22): 90-91. (in Chinese)
[16] 刘培卫, 张玉秀, 杨 云. 白木香不同种质的表型特征与苗木生长特性研究[J].种子, 2018, 37(3): 60-62, 67.
LIU P W, ZHANG Y X, YANG Y. The study on phenotypic features of different germplasm and growth characteristics of(Lour.) Spreng[J]. Seed, 2018, 37(3): 60-62, 67. (in Chinese)
[17] 张 燕, 孟 慧, 吕菲菲, 魏建和, 杨 云, 李浩凌, 陈 波, 黄良明. 沉香属植物组培快繁研究进展[J].中国现代中药, 2021, 23(12): 2164-2171.
ZHANG Y, MENG H, LV F F, WEI J H, YANG Y, LI H L, CHEN B, HUANG L M. Tissue culture of: a review[J]. Modern Chinese Medicine, 2021, 23(12): 2164-2171. (in Chinese)
[18] 王宇光, 王 军, 段瑞军, 覃和业, 梅文莉, 戴好富. 白木香良种‘热科2号’的芽接繁育[J]. 热带农业科学, 2019, 39(10): 34-41.
WANG Y G, WANG J, DUAN R J, QIN H Y, MEI W L, DAI H F. Bud grefting for propagation of‘Reke2’[J]. Chinese Journal of Tropical Agriculture, 2019, 39(10): 34-41. (in Chinese)
[19] 黄玮婷, 孔凡芹, 王海燕, 方中明. 沉香属植物繁殖研究进展[J]. 世界林业研究, 2017, 30(1): 44-48.
HUANG W T, KONG F Q, WANG H Y, FANG Z M. Research progress inspp. propagation[J]. World Forestry Research, 2017, 30(1): 44-48. (in Chinese)
[20] 陈平先. 土沉香的繁殖栽培及应用[J]. 农业与技术, 2015, 35(4): 8-9.
CHEN P X. Propagation, cultivation and application of[J]. Agriculture and technology, 2015, 35(4): 8-9. (in Chinese)
[21] 王亚沉, 王玉英, 肖楚楚, 杨石有, 赵庆杰, 徐诗涛. 珍贵树种沉香繁育技术及产业化[J]. 现代园艺, 2015(17): 60-62.
WANG Y C, WANG Y Y, XIAO C C, YANG S Y, ZHAO Q J, XU S T. Propagation technology and industrialization of precious tree species agarwood[J]. Xiandai Horticulture, 2015(17): 60-62. (in Chinese)
[22] 廖维华, 刘 杰, 石晓东, 彭建国, 柏子奎. 林木高空压条生根率影响因素分析[J]. 四川林业科技, 2018, .39 (2): 103-107.
LIAO W H, LIU J, SHI X D, PENG J G, BAI Z K. Analysis of influencing factors of the rooting rate by air layering[J]. Journal of Sichuan Forestry Science and Technology, 2018, 39 (2): 103-107. (in Chinese)
[23] 巩振辉, 申书兴. 植物组织培养[M]. 第2版. 北京: 化学工业出版社, 2013.
GONG Z H, SHEN S X. Plant tissue culture[M]. Second edition. Bejing: Chemical Industry Press, 2013. (in Chinese)
[24] 冯婷婷, 郭九峰, 宋天磊, 春 霞, 王 冶. 药用植物组织培养研究综述[J]. 安徽农学通报, 2019, 382(24): 23-27.
FENG T T, GUO J F, SONG T L, CHUN X, WAN Y. Overview of tissue culture of medicinal plants[J]. Anhui Agricultural Science Bulletin, 2019, 382(24): 23-27. (in Chinese)
[25] 林 超. 白木香组织培养及多倍体诱导研究[D]. 广州: 广州中医药大学, 2013.
LIN C. Studies on tissue culture and polyploidy induction of[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2013. (in Chinese)
[26] 贾 贤. 土沉香组织培养再生体系的建立[D]. 海口: 海南大学, 2014.
JIA X. Studies on tissue culture and plant regeneration of(Lour.) spreng[D]. Haikou: Hainan University, 2014. (in Chinese)
[27] 都明理, 徐 娇, 朱楚然, 王丽红, 隋 春, 魏建和. 白木香的组织培养快速繁殖研究[J]. 中国农学通报, 2019, 35(26): 80-83.
DU M L, XU J, ZHU C R, WANG L H, SUI C, WEI J H. Rapid propagation ofsinensis by tissue culture technology[J]. Chinese Agricultural Science Bulletin, 2019, 35(26): 80-83. (in Chinese)
[28] 董 闪, 李 明, 唐 堃, 赵 盼, 赵 冬, 潘雪峰. 白木香愈伤组织的诱导及培养[J]. 湖北农业科学, 2014, 53(15): 3673-3677.
DONG S, LI M, TANG K, ZHAO P, ZHAO D, PAN X F. Callus induction and tissue culture of(Lour.) Gilg[J]. Hubei Agricultural Sciences, 2014, 53(15): 3673-3677. (in Chinese)
[29] 温璐华, 武瑞娜. 植物组培内生菌污染的防治措施[J]. 防护林科技, 2020, 197(2): 83-85.
WEN L H, WU R N. Control measures for endophyte contaminant for tissue culture[J]. Protection Forest Science and Technology, 2020, 197(2): 83-85. (in Chinese)
[30] 张苗苗. 白木香中内生菌的分离鉴定及其分布规律的初步研究[D]. 南宁: 广西中医药大学, 2017.
ZHANG M M. A preliminary study on the of isolation and identification of endophytic bacteria in white fragrant and dstribution[D]. Nanning: Guangxi University of Chinese Medicine, 2017. (in Chinese)
[31] 黄崇才. 白木香(Lour.) Gilg种质形态学与细胞学研究[D]. 广州: 广州中医药大学, 2009.
HUANG C C. Study on morphology and cytology of(Lour.) Gilg[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2009. (in Chinese)
[32] 郑成木, 刘进平. 热带亚热带植物微繁殖[M]. 长沙: 湖南科学技术出版社, 2001.
ZHENG C M, LIU J P. Micropropagation of tropical and subtropical plants[M]. Changsha: Hunan Science and Technology Press, 2001. (in Chinese)
[33] 张 健, 王 颖, 吴坤鑫, 陈雄庭. 白木香组织培养研究进展[J]. 中国园艺文摘, 2011, 27(6): 42-44.
ZHANG J, WANG Y, WU K X, CHEN X T. Progress in the research of tissue culture of[J]. Chinese Horticulture Abstracts, 2011, 27(6): 42-44. (in Chinese)
[34] 汪腾越. 土沉香组织培养再生体系的研究[D]. 北京: 中国林业科学研究院, 2012.
WANG T Y. Regeneration system of(Lour.) Gilg by tissue culture techniques[D]. Beijing: Chinese Academy of Forestry, 2012. (in Chinese)
[35] 高 燕, 张 婷, 奉树成. 木本植物的无性繁殖方法[J].现代农业科技, 2018, 714(4): 129-130.
GAO Y, ZHANG T, FENG S C. Asexual reproduction method of woody plants[J]. Modern Agricultural Science and Technology, 2018, 714(4): 129-130. (in Chinese)
[36] 何旭君, 蔡乙东, 陈永镇, 林晓萍, 张华通. 沉香树组织培养快速繁殖技术研究[J]. 林业建设, 2006(4): 10-12.
HE X J, CAI Y D, CHEN Y Z, LIN X P, ZHANG H T. Study on the rapid propagation technology of tissue culture of agarwood[J]. Forestry Construction, 2006(4): 10-12. (in Chinese)
[37] 徐强兴, 吴妃华, 周立赖. 土沉香的组培快繁技术研究[J].广东农业科学, 2006, 33(8): 44-46.
XU Q X, WU F H, ZHOU L L. Research on tissue culture and rapid propagation technology of[J]. Guangdong Agricultural Sciences, 2006, 33(8): 44-46. (in Chinese)
[38] MINH V T. Application of tissue culture techniques in woody species conservation, improvement and development in Vietnam agarwood (Pierre ex lecomte) via shoot-tip culture[J]. Acta Horticulturae, 2005(692): 37-42.
[39] DEBNATH B, SINHA S, SINHA R K.multiplication of shoot buds ofRoxb (Thymelaeaceae)[J]. CIBTech Journal. Biotechnolgy, 2013, 2(2): 7-10
[40] 黄玮婷, 孔凡芹, 王海燕, 方中明. 沉香属植物繁殖研究进展[J]. 世界林业研究, 2017, 30(1): 44-48.
HUANG W T, KONG F Q, WANG H Y, FANG Z M. Research progress inspp. propagation[J]. World Forestry Research, 2017, 30(1): 44-48. (in Chinese)
[41] NAZIZ P S, DAS R, SEN S. The scent of stress: evidence from the unique fragrance of agarwood[J]. Frontiers in Plant Science, 2019(10): 840.
Tissue Culture with Two Different Organs of
ZHANG Yan1,2, MENG Hui1,2, LYU Feifei1, WEI Jianhe1,2, FAN Xiaohong1, HE Xin1,2, YUAN Baixue1, CHEN Bo1, YANG Yun1,2*
1. Hainan Branch Institute of Medicinal Plant, Chinese Academy of Medical Sciences & Peking Union Medical College / Hainan Provincial Key Laboratory of Resources Conservation and Development of Southern Medicine / Key Laboratory of State Administration of Traditional Chinese Medicine for Agarwood Sustainable Utilization, Haikou, Hainan 570311, China; 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Science & Peking Union Medical College / Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education / National Engineering Laboratory for Breeding of Endangered Medicinal Materials, Beijing 100193, China
Agarwood,(Lour.) Gilg, is one of the most famous medicinal and spice resources in the world. In many Asian countries, the agarwood industry is both a traditional and rapidly developing emerging industry. As we all know, the large-scale application of high-quality agarwood germplasm resources is of great significance for the sustainable development of the agarwood industry. Therefore, high quality agarwood germplasm resources have been the focus and hotspot of the agarwood industry in recent years. However, the characteristics of some high quality germplasm cannot be inherited through sexual reproduction, and the technical barriers for large-scale breeding exist in now. Tissue culture has outstanding advantages in aspects of maintaining excellent traits of varieties, preservation of seed resources, and rapid propagation, which is widely used in Chinese medicine resources conservation and traditional Chinese medicine industry development. In order to establish a broad-spectrum agarwood regeneration system for industrial production, aseptic seedlings and mature plant branches were used to plant regeneration techniques research from explant disinfection, cluster bud induction and rooting culture in this study. The results showed that the tender stems picked in the field were effectively sterilized by soaked in 0.1% carbendazim solution for 3 min and rinsed with flowing water for 3 h. The survival rate of explants could be maintained by disinfecting with 0.1% mercury liter solution for 6~8 min. In addition, appropriate addition of sterilizer into the culture medium could also control material contamination effectively.The stems of aseptic seedlings were easier to induce new buds, while the stems of branch were more difficult to induce secondary shoots as explants. The multiple shoots of aseptic seedlings could induced in WPM medium supplemented with 0.5 mg/L 6-BA, 0.2 mg/L NAA and 20 g/L sucrose (G4). The three advisable multiplication media for branches were 1/2 MS + 25 g/L sucrose + 2 mg/L 6-BA + 0.01 mg/L NAA (I3), 1/4 MS+20 g/L sucrose + 2 mg/L 6-BA + 0.5 mg/L NAA (J2) and WPM + 20 g/L sucrose + 1 mg/L 6-BA + 0.01 mg/L NAA (K2). Then the enlarged clump bud clusters were cut and transferred to WPM medium without plant growth additives which helped grow buds to become rootless shoots.New shoots could be induced to root in the WPM medium with adding 20–30 g/L sucrose 0.1–0.2 mg/L NAA. In this paper, two explants of agarwood were used for tissue culture and successfully obtained regenerated plants, which provided a technical reference for the asexual reproduction of high-quality agarwood germplasm.
(Lour.) Gilg;culture; explant disinfection; multiple bud induction; rooting culture
S567.19
A
10.3969/j.issn.1000-2561.2022.07.018
2021-08-09;
2022-01-05
国家重点研发计划项目(No. 2018YFC1706401)。
张 燕(1993—),女,硕士研究生,研究方向:药用植物资源可持续利用。*通信作者(Corresponding author):杨 云(YANG Yun),E-mail:yangyun43@aliyun.com。

