基于Illumina Miseq 测序技术分析剁辣椒产地预加工过程中菌群变化
陈梦娟,蒋立文,2, ,刘 洋,王蓉蓉,周 辉,2,赵玲艳,覃业优
(1.湖南农业大学食品科学技术学院,湖南长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙 410128;3.湖南坛坛香生物科技有限公司,湖南长沙 410128)
辣椒(Capsicum annuumL.)为木兰纲茄科辣椒属草本植物果实,原产于南美洲的热带地区。目前,辣椒已成为世界上最重要的农业经济作物之一,尤其是在中国和墨西哥[1]。而中国是世界上第一大辣椒生产国和消费国[2]。辣椒自明朝传入我国以来,其接受程度、加工方式和食用方法逐步形成了地域性差异。剁辣椒是湖南的特色辣椒加工产品,传统加工一般是以新鲜红辣椒为原料,经清洗、晾干、去梗、剁碎,拌料及密封盐渍发酵而成的产品,以香辣咸鲜而著名。
近年来,我国剁辣椒产业的发展趋势稳定,产业产值稳步增加,但其产业的发展却受到许多限制。首先,我国辣椒的主产区集中于山东、河北、山西等地北方地区,但南方地区才是主流的消费地区[3-5]。由于新鲜辣椒果实的含水量较高,采收后辣椒易霉烂变质,且在运输过程中还存在自然蒸发脱水引起的果实失重、失鲜、机械损伤以及生理性病害等问题[6],损耗大,进而导致剁辣椒的生产成本升高。其次,由于辣椒为季节性蔬菜,因此生产时还需要考虑原料的季节性问题。此外,剁辣椒产业的发展还受到制作工艺与加工机械的限制。为了产业链对接紧密,一般剁辣椒加工采取异地收购辣椒并产地腌渍处理,再输送到生产企业加工等待发酵和加工,盐渍辣椒半成品更便于运输及贮藏,满足维持工厂全年生产的需求。因此,产地处理效果好坏直接影响到产品品质。
目前,剁辣椒厂家在辣椒产地预加工方式是以18%~25%的盐度盐渍新鲜红辣椒制成大量的盐渍辣椒半成品,装袋密封备用。但绝大部分厂家在产地加工过程中存在生产工艺落后、经验性加工、原料未清洗、粗放管理、添加剂使用不规范等问题[7],直接影响盐渍辣椒半成品的质量与产品的后续生产。此外,高盐盐渍辣椒在后续生产时需进行脱盐处理,产生大量高盐废水,给环保带来极大压力。随着人们对食品安全和环境保护的高度重视,产地加工的卫生加工条件引起生产企业的极大关注。并且根据国家对农产品加工环节减损增效的要求[8],辣椒产地加工必将成为未来的发展趋势。因此,对辣椒产地加工工艺优化、建立标准化管理、辣椒保脆保鲜方法研究和配套加工设备优化等方面的研究显得尤为重要。剁辣椒生产中最重要的盐渍辣椒半成品的产地预加工环节缺乏加工方法考察、配套设备适用性考察、技术规范、食品安全性以及产品品质变化等多方面的研究。
目前,规范企业在产地加工标准化、连续化方面做了大量的工作,也开发非标准设备包括:分选、清洗、振动脱水、分流斩拌、分级、拌料、包装等连续性较强的半自动化生产线,但具体控制要求尚不明晰。本文针对不同产地盐渍辣椒半成品产地预加工过程中影响品质和安全的生物学问题开展研究,采用Illumina MiSeq 高通量测序技术对山东、山西不同产地及不同品种辣椒样品在预加工为盐渍辣椒过程中的细菌和真菌菌群进行分析,考虑辣椒产地预加工中关键的工艺步骤对微生物的影响,探讨加工过程中的工艺合理性和科学性,为提升产地加工水平以及工艺及设备改进提供科学依据。
1 材料与方法
1.1 材料与仪器
新鲜辣椒 源于山东曹县和山西忻州辣椒种植加工基地,品种分别是线椒和朝天椒。样品采集时间为2020 年9 月中旬,两种红辣椒均为新鲜、成熟状态。样品采集见表1;平板计数琼脂培养基(PCA 培养基)、孟加拉红琼脂培养基 广东环凯微生物科技有限公司;食品级焦亚硫酸钠 山东凯龙化工科技发展有限公司;异抗坏血酸钠 湖南明瑞祥盛贸易有限公司;柠檬酸 山东顾诚化工科技有限公司;食盐中盐皓龙盐化有限责任公司;Pusion Hot start flex 2X Master Mix 上海仪涛生物仪器有限公司;DL2000 DNA Maker 宝日医生物技术(北京)有限公司;Gene colour 核酸染料 北京金博益生物技术有限公司;Qubit dsDNA HS Assay Kit 赛默飞世尔科技(中国)有限公司;Biowest Agarose G-10 西班牙BIOWEST;50×TAE Buffer 上海生工生物工程股份有限公司;AxyPrep PCR Cleanup Kit AXYGEN 美国Bio-Rad Laboratories Inc.;Soil DNA Kit 美国OMEGA bio-tek Inc.。

表1 产地加工辣椒样品采集信息Table 1 Collection information of processed pepper samples from origin
5424 型常温离心机 Eppendorf Centrifuge;Microfuge 22R 型冷冻离心机 美国Beckman Coulter公司;WH-861 型旋涡震荡仪 太仓市华利达实验设备有限公司;A200 型PCR 仪 杭州朗基科学仪器有限公司;MiSeq pe300 测序仪 Illumina 公司;Tanon-2500 型凝胶成像仪 上海天能科技有限公司;JY300 型电泳仪 北京君意东方电泳设备有限公司;DW-HL388 型超低温冷冻储存箱 中科美菱低温科技有限责任公司。
1.2 实验方法
1.2.1 样品的处理和采集 新鲜红辣椒经采收后送至当地工厂采用相同加工流程与机械,具体操作见图1。取样时间点分别为原料采收、一级清洗、二级清洗、切分过筛及拌料(盐渍半成品)步骤,完成后立即取样,每个环节随机取样4 袋,每袋1 kg,低温保藏运输至实验室进行试验。
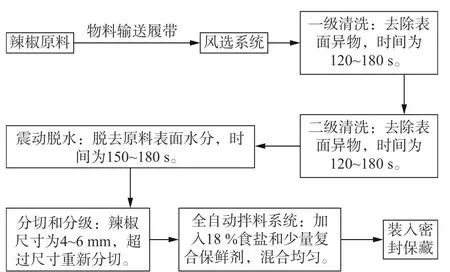
图1 辣椒产地预加工流程图Fig.1 Flow chart of pepper origin pre-processing
1.2.2 细菌及真菌计数 霉菌和酵母菌的菌落计数根据GB/T 4789.15-2016 进行操作[9];菌落总数的测定则根据GB 4789.2-2016 进行操作[10]。进行微生物计数时,每个样品设置4 个重复。
1.2.3 细菌16S rDNA 序列及ITS 2 序列分析 使用OMEGA 的土壤DNA 提取试剂盒对各关键工序的辣椒样本的总DNA 进行提取,提取步骤均按照试剂盒说明书完成,然后将总DNA 加入到50 μL 缓冲液中并储存在-80 ℃备用。
扩增细菌16S rDNA V3~V4 区域。引物为:338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。PCR 扩增体系:25 μL 包含DNA 模板25 ng、上下游引物各为2.5 μL、12.5 μL PCR 预混合物。PCR 扩增条件:98 ℃预变性30 s;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,循环35 次;最后72 ℃延伸10 min。
扩增真菌ITS 2 区所选用的引物为:ITS1FI2(5'-GTGARTCATCGAATCTTTG-3')和 ITS2(5'-TCC TCCGCTTATTGATATGC-3')。PCR 体系为25 μL包含DNA 模板25 ng、上下游引物各为2.5 μL、12.5 μL PCR 预混合物。PCR 条件:98 ℃预变性30 s;98 ℃变性10 s,52 ℃退火30 s,72 ℃延伸45 s,循环35 次;最后72 ℃延伸10 min。
取PCR 产物10 μL 用2%琼脂糖凝胶电泳进行检测。将检测合格的样品送至杭州联川生物技术有限公司进行高通量测序。按照生物学样品处理基本要求,所有样品均有4 个技术重复样品。
1.2.4 测序数据分析 对下机数据进行拆分,使用PEAR 合并成对端读数,对原始标签进行质量过滤,以获得符合FastQC(V 0.10.1)的高质量tags[11]。通过Verseach(V2.3.4)将具有97%以上相似性的序列分配给相同的可操作分类单元(operational taxonomic unit,OUT)[12-13]。利用PyNAST 软件对不同类群优势种群的差异进行多序列比对。以Chao 1、Shannon、Simpson 和Observed species 为指标,用QIME(1.8.0 版)计算所有样品的各项指标并进行聚类,来分析各个样品中的Alpha 多样性,以及进行主成分分析和主坐标分析分析[14-16]。同时,根据每个OTU 代表序列与RDP 数据库和Unite 数据库的比对,得到各个样本所有OTU 的物种注释[17],经分类和统计后以R 语言绘制各分类水平物种丰度表及热图。
1.3 数据处理
采用SPSS 22.0 的Duncan 多区间检验方法进行单因素方差分析。数据绘图使用了Origin 2018。利用OmicStudio 工具进行生物信息学分析(https://www.omicstudio.cn/tool)。平均值和标准差通过使用Excel 2019 从3 个独立实验获得的数据并进行计算。
2 结果与分析
2.1 线椒和朝天椒加工过程中细菌群落结构的变化
2.1.1 加工辣椒样品细菌α-多样性 本次16S 测序共获得的3035040 条有效数据,进行OTU 聚类分析后两种产地加工辣椒中的细菌群落多样性指数结果见表2。由表2 可知,Goods coverage 指数均≥0.99,测序结果可反映样品中细菌群落的真实情况。由α-多样性结果可知,线椒样品中的Observed Species显著高于朝天椒中的(P<0.05)。在朝天椒样品中,根据Observed Species、Shannon 以及Simpson 指数可以看出,细菌的物种数量、丰富度及均匀度在清洗两次的过程中呈现显著降低趋势(P<0.05)。但在分切过筛的过程中Observed Species 又呈现升高的趋势,可能与相应设备中残留的细菌有关。而在线椒样品中,在原料清洗经第二次后,Observed Species 和Shannon 指数均显著上升(P<0.05),说明线椒的第二次清洗没有达到清洗的效果。但随着线椒在分切过筛和拌盐过程,Shannon 和Simpson 逐渐降低,表明在此过程中细菌菌群的丰富度和均匀度是逐渐降低的,且变化规律与朝天椒中的相似。

表2 加工辣椒样品中细菌群落多样性指数统计Table 2 Alpha diversity index of bacterial community in processed pepper samples
2.1.2 加工辣椒样品细菌β-多样性 细菌群落的主成分分析(Principal Component Analysis,PCA)见图2。由图2 可知,朝天椒样品点与线椒的样品点的距离较远,说明在两种辣椒在相同的加工流程中细菌菌群结构差异大,这种差异主要与朝天椒(CYL)和线椒(XYL)原料所附着细菌菌群的差异相关。此外,随着加工的进行,朝天椒样品中的细菌菌群结构的变化明显大于线椒样品中的。
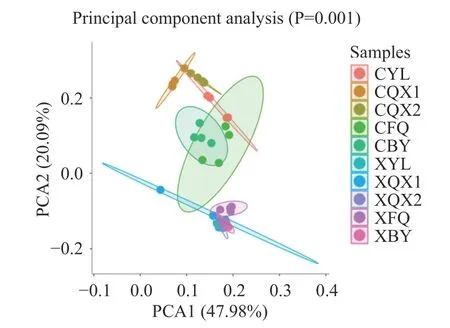
图2 加工辣椒样品中细菌群落的主成分分析Fig.2 Principal component analysis of bacterial community in processed pepper samples
2.1.3 辣椒样品中细菌物种注释及分类 图3A 和图3B 分别为产地加工辣椒样品中细菌在门水平和属水平上的物种注释结果。在朝天椒和线椒的样品中门水平上共注释到17 个菌门,主要优势菌均为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),在所有样品中这两门类相对丰度之和均超过了95%。而厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)也经常作为优势门类出现在发酵辣椒制品中[18-19]。此外,还有拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝细菌(Cyanobacteria)等。
由图3B 可知,在属水平上原料上优势菌属种类差异明显,朝天椒原料附着的优势菌为乳球菌属(Lactococcus,相对丰度为14.21%)、假单胞菌属(Pseudomonas,13.30%)、芽孢杆菌属(Bacillus,12.39%)、不动杆菌属(Acinetobacter,10.37%)以及肠球菌属(Enterococcus,11.02%)。而线椒原料表面附着的优势菌为假单胞菌属(Pseudomonas,18.48%)、泛菌属(Pantoea,13.94%)、肠球菌属(Enterococcus,13.72%)和沙雷氏菌属(Serratia,10.36%)。
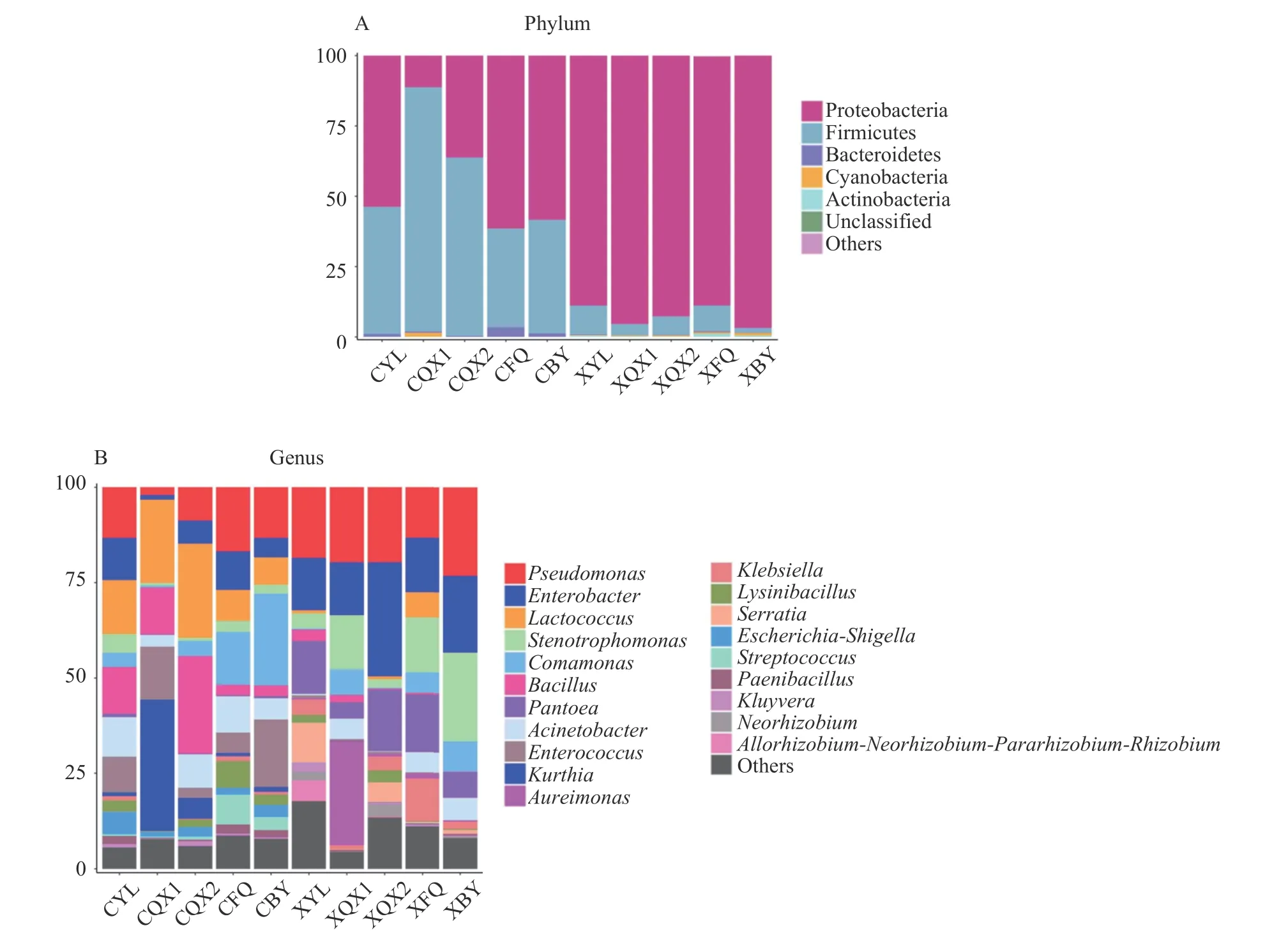
图3 门和属分类水平上细菌菌群相对丰度Fig.3 Relative abundance of bacterial community at the phylum and genus classification level
其次,在经过两次清洗后,朝天椒样品中乳球菌属(Lactococcus)和芽孢杆菌属(Bacillus)以及线椒样品中的肠球菌属(Enterococcus)的相对丰度显著增加(P<0.05)。但在对比CQX2 和CFQ 后发现,朝天椒样品中乳球菌属(Lactococcus)和芽孢杆菌属(Bacillus)的相对丰度分别降低至8.19%和2.93%。线椒样品中肠球菌属(Enterococcus)的相对丰度也由二次清洗后的29.91%降低至14.26%,这可能与二次清洗后的振动脱水工序有关。
在朝天椒的半成品(CBY)中,丛毛单胞菌属(Comamonas)、肠球菌属(Enterococcus)和假单胞菌属(Pseudomonas)3 种菌属相对丰度最高;而线椒半成品(XBY)中假单胞菌属(Pseudomonas,23.17%)、寡养单胞菌属(Stenotrophomonas,23.20%)和肠球菌属(Enterococcus,20.12%)为优势菌,均与原料中优势菌种类和结果有较大差异。本研究中XBY 的细菌注释结果与赵玲艳等[20]采用454 焦磷酸测序对同品种同产地的盐渍线椒中细菌菌群部分相似。此外,两种辣椒样品前30 的菌属中,常见的乳酸菌菌属有乳球菌属(Lactococcus)和明串珠菌属(Leuconostoc),但盐渍半成品中乳酸菌的相对丰度均低于原料。
2.2 线椒和朝天椒产地加工过程中真菌群落结构的变化
2.2.1 产地加工辣椒样品真菌α-多样性 本次ITS测序共获得的3337111 条有效数据,进行分析后两种产地加工辣椒中的真菌群落多样性指数结果见表3。由真菌α-多样性的结果可知,线椒与朝天椒原料上的真菌种类数量上无明显差异。并且两种辣椒中真菌的Observed Species 均呈现出先降低后增高的规律,与16S 的结果呈现出的规律一致。根据Observed Species、Shannon 以及Simpson 指数可以看出,朝天椒和线椒样品中微生物的多样性及均匀度在第二次清洗后显著降低(P<0.05)。在分切过筛时,CFQ 和XFQ 样品中真菌Observed Species 显著高于CQX2 和XQX2 的(P<0.05)。
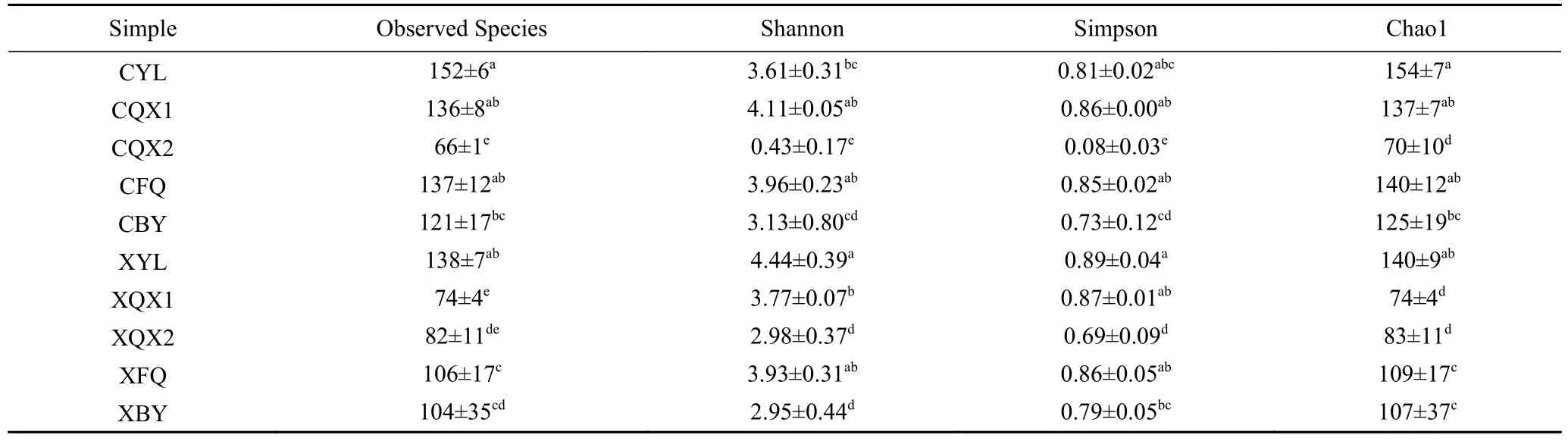
表3 加工辣椒样品中真菌群落多样性指数统计Table 3 Alpha diversity index of fungi community in processed pepper samples
2.2.2 产地加工辣椒样品真菌β-多样性 在真菌群落的PCA 分析中(见图4),两坐标轴的贡献率之和为70.55%。由图4 可知,朝天椒(CYL)和线椒(XYL)原料附着的真菌也具有显著差异(P<0.01),但随着加工的进行,两种辣椒中的真菌菌群结构的差异性在逐渐的减小。
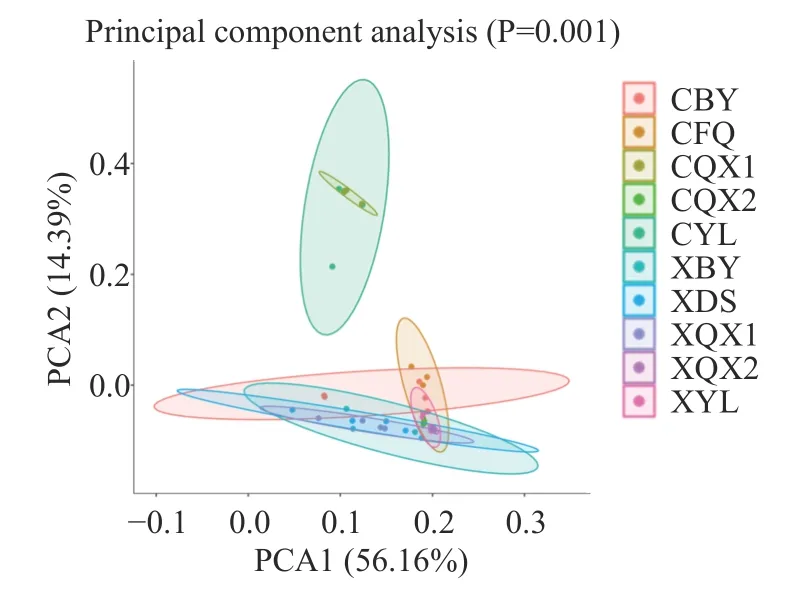
图4 加工辣椒样品中真菌群落的主成分分析Fig.4 Principal component analysis of fungi community in processed pepper samples
2.2.3 产地加工辣椒样品中真菌物种注释及分类图5A 和图5B 分别为产地加工辣椒样品中真菌在门水平和属水平上的物种注释结果。在门水平上共注释到6 个菌门,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为绝对优势菌门,所有样品中二者相对丰度的总和均超过99.7%。此外,还检测到接合菌门(Zygomycota)、被孢霉菌门(Mortierellomycota)、壶菌门(Chytridiomycota)以及Fungi unclassified。
由图5B 可知,朝天椒原料上真菌的优势菌属为拟酵母属(Pseudozyma,相对丰度为36.24%)、Gibellulopsis(相对丰度为13.44%)以及链格孢属(Alternaria,12.13%)。而线椒原料上的优势菌为链格孢属(Alternaria,相对丰度29.39%)、织球壳菌属(Plectosphaerella,19.43%)、腥掷孢菌属(Tilletiopsis,11.63%)。
在朝天椒的清洗二次(CQX2)样品中,链格孢属(Alternaria)的相对丰度高达96.05%,并且在线椒清洗二次(XQX2)的样品中,该菌属的相对丰度也增高至55.51%。链格孢属(Alternaria)是植物上常见的腐生菌,易引果实细胞壁坍塌且色泽变暗,对辣椒保脆保鲜不利[21-22]。在朝天椒和线椒的半成品中,链格孢属(Alternaria)的相对丰度仍然较高,分别为29.62%和24.20%。此外,还存在织球壳菌属(Plectosphaerella)、赤霉菌属(Gibberella)以及镰刀菌属(Fusarium)等植物致病菌或致腐真菌属[23-25]。
2.3 可培养微生物的变化
从图6 可以看出,在加工过程中细菌与霉菌数量级在102~106CFU/g 之间。在盐渍朝天椒半成品中可培养细菌数量由原料的2.2×105降至1.2×104CFU/g,可培养真菌则由原料中8.3×103降至8.4×102CFU/g,但第一次清洗后样品中的在由8.3×103升高至1.6×104CFU/g,第二次清洗后降至6.6×103CFU/g。而在线椒原料在两次清洗后,可培养细菌数量由2.6×104升高至2.6×106CFU/g,并且真菌数量也由1.4×104上升至1.6×106CFU/g。在拌盐后可培养细菌和真菌的数量才分别降低至1.4×103和2.3×103CFU/g。结合菌落计数和测序结果发现,现有机械的清洗效果较差,尤其是在红线椒加工中,这可能是由于两次清洗均使用自来水冲洗且进水和出水的速率不一致导致在清洗环节中辣椒表明微生物出现积累。其次,线椒果实较长且表面积更大,因此同样的清洗工艺无法满足不同品种原料的清洁要求,需要采取延长清洗工序时间或改善清洗过程中换水的频率才有利于微生物降低。

图6 加工辣椒样品中可培养微生物的变化Fig.6 Changes of culturable microorganisms in samples of processed pepper
3 讨论
本研究利用高通量测序探讨山东、山西的朝天椒和线椒在盐渍辣椒加工过程中微生物的变化规律,结果表明两种辣椒产地原料上附着的细菌和真菌菌群差异显著,经盐渍加工后,两种辣椒中细菌菌群仍存在显著差异(P<0.05),而真菌菌群差异性则随着加工是进行逐步减小,且细菌和真菌的丰富度、均匀度均极显著降低(P<0.01)。根据计数结果,在盐渍朝天椒半成品中可培养细菌数量由原料的2.2×105降至1.2×104CFU/g,可培养真菌则由原料中8.3×103降至8.4×102CFU/g;而盐渍线椒样品中可培养细菌和真菌的数量分别降至1.4×103和2.3×103CFU/g。预加工过程中两种辣椒样品中微生物数量呈现下降趋势,产地预加工效果较好。
剁辣椒的最大特点就是脆辣酸爽,产地加工是保持辣椒原料脆度是重要前提,除品种差异外,微生物分泌果胶酶和内源酶对辣椒果实软化也是影响脆度的重要因素,因而,在产地加工过程中,降低微生物数量是必要的,同时也降低了条件致病菌带来的风险。本研究结果表明,相较于朝天椒样品中菌群和计数结果的变化,线椒样品在两次清洗的效果较差,清洗后反而出现微生积累现象,需采取延长清洗工序时间或改善清洗过程中换水的频率等方法来减少微生物数量。所以,现有的产地加工工艺是可行的,但应结合辣椒原料的特点进行差异化设计,并关注清洗阶段的效果可能对后期加工的影响,进行下一步研究和探讨。若产地预加工清洗处理可有效降低微生物污染,则可适当降低拌入的食盐含量,对后期加工及环境保护具有重要的影响。从产地预加工环节控制辣椒的质量,充分研究辣椒加工过程的内在品质变化,可为稳定产品品质提供支撑。本文主要针对产地预加工环节中微生物多样性及数量上进行研究,不同盐度及产地预处理对产品品质的影响则需要进一步研究、验证。

