超声波预处理酶解制备茶渣蛋白ACE 抑制肽及其活性分析
代 成,谭梓铭,张 阳,李 璐,李 雁,解新安,2,
(1.华南农业大学食品学院,广东广州 510642;2.广东省功能食品活性物重点实验室,广东广州 510642)
血管紧张素转化酶(ACE)是治疗心血管疾病的重要靶点,控制其活性有利于维持血压平衡[1]。心血管疾病是全球最常见的死亡原因之一,导致全球每年约1730 万人死亡[2]。目前合成的血管紧张素转换酶抑制药物如卡托普利,作为降压药虽具有良好的降压效果,但同时伴随着过敏、心悸等的副作用。因此,人们将目光投向作用温和、安全、特异、持久的食源性ACE 抑制肽[3]。
我国作为世界上生产及消费茶叶最多的国家之一,在茶叶加工过程中产生了大量茶渣。目前茶渣的再利用主要是制作生物吸附剂,制作有机无机复合肥以及动物饲料等[4-5],未能充分利用茶渣资源。茶渣营养成分丰富,其中茶渣蛋白占茶渣干21%~28%[6-7],氨基酸含量占干物质总量的1%~4%[7]。研究发现,茶蛋白在抗氧化、降血脂、抗肿瘤及预防辐射方面等具有积极的作用,对抗氧化功能研究比较充分,而降压功能却鲜有报道。
目前ACE 抑制肽的制备方法主要有发酵法、微生物酶解法、基因重组法、化学合成法[8-9],可依据不同ACE 抑制肽制备原料选择合适的制备方法,而植物蛋白大多采取酶解法制备ACE 抑制肽。传统酶解法制备生物活性肽存在一些弊端,如酶解效率低、产物活性低以及酶解时间长等问题[10-11]。超声波是一种新型的清洁、绿色提取技术,产生的高剪切力和机械能会引起空化,空化气泡在材料表面的剧烈内爆可能引起微射流,导致表面剥落、侵蚀和颗粒破碎[12-13]。这些效应可能有助于增加底物的溶解度,使其更容易被酶利用,从而加快化学反应。Habinshuti等[14]研究发现,超声辅助碱性蛋白酶法可以提高甘薯蛋白酶解产物水解度和抗氧化活性。李莹等[15]采用超声波辅助菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽,结果显示超声波辅助有效提高了其ACE 抑制率。
本研究旨在通过超声波预处理酶解法制备ACE抑制肽,利用响应面法优化工艺参数,并对制备的多肽进行分子量分布和稳定性分析,以期为茶渣高值化利用提供理论基础。
1 材料与方法
1.1 材料与仪器
茶渣 馒头岭茶厂提供;茶渣蛋白 实验室自制[16],纯度为52.5%±0.03%;氢氧化钠、氯化钾、胰蛋白酶(10.17×104±5.30×103U/g)、风味蛋白酶(9.59×103±0.23×102U/g)诺维信生物技术有限公司;复合蛋白酶(12.41×104±7.25×103U/g)、碱性蛋白酶(6.53×104±1.46×103U/g)、木瓜蛋白酶(2.28×104±0.65×103U/g)、胃蛋白酶(1.2×103±0.55×102U/g)广州光华科技有限公司;正辛醇、异辛烷 天津市大茂化学试剂厂;血管紧张素转化酶(ACE)美国Sigma 公司,生化级。
PL203 电子天平 梅特勒-托利多仪器有限公司;78-1 磁力加热搅拌器 金坛市富华仪器有限公司;754 紫外-可见光分光光度计 上海菁华科技仪器有限公司;TL-650CT 多用途恒温超声波提取机江苏天翎仪器有限公司;PHS-3C 数显pH 计 上海精科;DL-5 高速离心机 上海安亭科学仪器厂;KDY-9810 凯氏定氮仪 北京市通润源机电技术有限公司;OAPMP220 超滤装置 美国PALL 公司。
1.2 实验方法
1.2.1 ACE 抑制肽的制备 茶渣蛋白ACE 抑制肽的酶解工艺流程:茶渣蛋白→超声波预处理→酶解→灭酶活→超滤→离心取上清液。具体步骤:茶渣蛋白粉按比例(w/v)加蒸馏水溶解,调节pH,经超声波预处理后,加入蛋白酶,待酶解完成后沸水浴10 min灭酶活,冷却至室温,在4000 r/min 离心10 min 后调节上清液至中性,经1 μm 滤膜除杂,收集滤液经10、5、3 kDa 滤膜分离进行冷冻干燥,并测定ACE抑制活性。
1.2.2 蛋白酶的筛选 以茶渣蛋白为原料,选取胰蛋白酶、木瓜蛋白酶、风味蛋白酶、碱性蛋白酶和复合蛋白酶在最适条件下进行酶解,底物质量浓度为2.5%,加酶量6000 U/g,酶解时间3 h。酶解过程中每隔0.5 h 取一次样,测定酶解产物ACE 抑制率。
1.2.3 超声方式的确定 通过超声波预处理(超声处理茶渣蛋白后加酶)、不超声和超声前加酶(加酶处理茶渣蛋白后进行超声)三种处理方式对比,其反应条件一致,以确定超声方式。超声条件:功率300 W,温度50 ℃,时间20 min;酶解条件:底物浓度2%,pH8.5,温度60 ℃,加酶量8000 U/g。以ACE 抑制率为指标,于酶解反应开始的第0、0.5、1、1.5、2、2.5、3 h 时取样,测定其抑制率。
1.2.4 超声波预处理单因素实验 以ACE 抑制率为指标,考察超声功率、超声时间、超声温度对ACE 抑制活性的影响。固定考察因素:底物浓度2.5%,温度61 ℃,加酶量8310 U/g,pH8.5,超声功率300 W,超声时间20 min,超声温度50 ℃。每个参数变化如下:超声功率200、250、300、350、400 W;超声时间10、20、30、40、50、60 min;超声温度30、35、40、45、50、55、60 ℃。
1.2.5 超声波预处理工艺优化 根据单因素实验的结果,采用Box-Behnken 设计确定超声波预处理酶解的最佳条件。以ACE 抑制率为响应值,超声功率为因子A,超声时间为因子B,超声温度为因子C。试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Variables and levels used for central composite design
1.2.6 ACE 抑制活性的测定 采用紫外分光光度法,操作简单、反应快速[17]。简而言之,以血管紧张素转化酶为底物,蛋白质酶解物为阳性对照。由于试剂加入顺序的不同,实验分为空白组b、对照组c、测定组a。测定组:5.0 mmol/L 的HHL 溶液120 μL,10 μL 0.1×103U/L ACE,在37 ℃水浴1 h,反应结束后迅速加入150 μL 的1 mol/L HCl 以终止反应;接着向样品中加入1 mL 冰冻乙酸乙酯,旋涡混合后离心(4000 r/min,l5 min);吸取上层脂溶液750 μL,置于120 ℃烘箱烘干;待冷却后加入3 mL 去离子水,旋涡半分钟,在228 nm 波长处测定吸光度。空白组在加入盐酸后再加入抑制剂,对照组c 最先添加ACE 之后立刻加入HCl。
计算公式如下:

式中:Aa样品a 的吸光值;Ab样品b 的吸光值;Ac样品c 的吸光值。
1.2.7 茶渣ACE 抑制肽的分离 采用响应面法确定的最佳工艺条件,通过超声预处理制备茶渣蛋白酶解液。首先,将制备的酶解液通过1 μm 滤膜过滤去除大分子物质和杂质。采用截留分子量分别为10、5和3 kDa 的超滤膜进行超滤。超滤条件:滤液浓度5%,pH7.0,压力0.10 MPa,室温操作。按分子量分为4 个部分:分子量>10 kDa(简称为Tpep-1)、5~10 kDa(Tpep-2)、3~5 kDa(Tpep-3)、<3 kDa(Tpep-4)。然后旋转蒸发浓缩,冻干,待测。
将所得样品溶于去离子水中,配制浓度为2 mg/L的肽浓缩液,按照本文1.2.6 方法测定其ACE 抑制率。
1.2.8 茶渣ACE 抑制肽的活性研究 进一步对Tpep-4 进行了表征,并对其稳定性进行了如下研究。
1.2.8.1 温度对ACE 抑制肽活性的影响 将Tpep-4溶于100 mL 去离子水中配制成1 mg/mL 的多肽溶液,调节pH7.0,分别置于30、40、50、60、70、80、90 ℃中静置5 h,间隔1 h 取样,测定ACE 抑制率。
1.2.8.2 pH 对ACE 抑制肽活性的影响 将Tpep-4溶于100 mL 去离子水中,配制成1 mg/mL 的多肽溶液,用盐酸和氢氧化钠溶液调节多肽溶液的pH 分别为2.0、4.0、6.0、8.0 和10.0,37 ℃保持2.5 h,间隔0.5 h 取样,测定ACE 抑制率。
1.2.8.3 盐溶液对ACE 抑制肽活性的影响 将Tpep-4 溶于0.2、0.4、0.6、0.8、1.0、1.2 mol/L 的NaCl 溶液中,保证肽质量浓度为1 mg/mL。在室温下放置2 d测定ACE 的抑制率。
1.2.8.4 体外消化实验对ACE 抑制肽活性的影响体外消化是根据文献[18]描述的方法进行的,并稍加修改。胃消化过程的体外实验:将Tpep-4 配置成2 mg/mL 的ACE 抑制肽溶液,随后用盐酸将肽溶液的pH 调至2.0,加入样品含量5%的胃蛋白酶,37 ℃水浴4 h,间隔1 h 采样,水浴结束后100 ℃沸水浴使酶失活5 min,待冷却至室温,测定消化液的ACE抑制率。肠道消化过程的体外实验:取一定剂量的上述消化液,用氢氧化钠调节pH 至8.0;按样品量加入5%的胰蛋白酶,在37 ℃水浴中继续消化4 h,同样间隔1 h 取样,消化结束后将消化液在100 ℃下放置5 min 使酶失活,待冷却至室温,测定消化液ACE 抑制率。
1.3 数据处理
数据分析使用Origin 8.5、Design-Expert.8.0.6和SPSS 19.0 等软件进行。获得的实验数据是三次平行测试的平均值。
2 结果与分析
2.1 蛋白酶筛选结果
由于不同种类蛋白酶的作用位点不同,酶解获得的多肽片段也不相同,表现出的体外ACE 抑制活性存在差异[19-20]。由图1 可知,五种蛋白酶的ACE抑制率大小为碱性蛋白酶>胰蛋白酶>复合酶>风味蛋白酶>木瓜蛋白酶。其中,木瓜蛋白酶水解产物的ACE 抑制率最低,水解2.5 h 后仅为17.9%。碱性蛋白酶水解的产品对ACE 的抑制率最高,水解2.5 h后ACE 抑制率达到50.0%。因此,选择碱性蛋白酶解制备茶叶渣的ACE 抑制性肽。杨晨等[21]等筛选出碱性蛋白酶作为酶解南瓜籽制备南瓜籽ACE 抑制肽的最佳酶,所得的ACE 抑制率和水解度均为最高。Bhaskar 等[22]采用碱性蛋白酶酶解马豆粉,获得一个具有降低ACE 活性的肽段序列:TVGMTAKF,并发现其C 端含有Phe。研究发现,当ACE 抑制肽C 末端倒数3 个氨基酸残基中含有Trp、Tyr、Phe和Pro 时,ACE 抑制率大大提高[23],这可能是碱性蛋白酶酶解茶渣蛋白的酶解产物活性较强的原因。
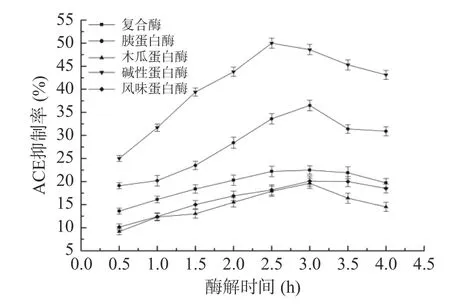
图1 不同蛋白酶处理对酶解产物ACE 抑制率的影响Fig.1 Effects of different enzymes on ACE inhibitory rate of tea residue proteins
2.2 超声方式的确定
蛋白质分子、细胞壁和细胞内多糖之间的离子相互作用会影响蛋白质的提取[24]。因此,提取过程中细胞壁的破坏是提高蛋白质提取率的关键步骤[25]。图2 显示了不同超声方法下ACE 抑制肽抑制率随时间的变化,超声波预处理显著提高了茶渣中ACE抑制肽的抑制率,这可能是因为超声预处理破坏了植物细胞细胞壁,使碱性蛋白酶更好的与蛋白质发生作用。
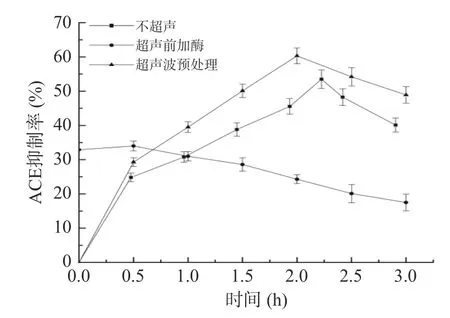
图2 不同超声方式对茶渣ACE 肽抑制率的影响Fig.2 Effect of different ultrasonic methods on ACE peptide inhibition rate of tea residue
2.3 单因素实验结果
2.3.1 超声功率对ACE 抑制率的影响 实际生产过程的成本和目标产物的传质效率与超声功率有着密切的联系,需选择合适超声功率进行提取。在茶渣蛋白酶解过程中测试了五种不同水平的超声功率,结果如图3 所示。随着超声功率的增加,ACE 抑制率呈现先增加后下降的趋势,最高达62.3%±0.6%。适当的超声功率能够破坏细胞壁,为蛋白酶提供更多结合位点增多,更易使茶渣蛋白酶解生成小分子肽段[26]。但超声功率增加到一定程度出现过饱和现象,形成音障,阻碍超声波传递,使ACE 抑制率出现下降[27]。综合考虑,选择超声功率300 W 为佳。

图3 超声功率对ACE 抑制率的影响Fig.3 Influence of ultrasonic power on ACE inhibitory rate
2.3.2 超声温度对ACE 抑制率的影响 即使是同一个物种,不同温度会刺激不同蛋白质溶解。如图4所示,ACE 抑制率随着温度的升高而增加,在45 ℃时达到最大值62.8%±0.3%。但当进一步升高时,ACE 抑制率开始下降,空话作用逐渐明显,一方面,由于温度升高导致酶发生热变性导致酶活性降低;另一方面,高温、高压环境会导致自由基形成,自由基破坏酶分子构象,酶活性受到抑制[28]。因此,选择超声温度45 ℃为佳。

图4 超声温度对ACE 抑制率的影响Fig.4 Influence of ultrasonic temperature on ACE inhibitory rate
2.3.3 超声时间对ACE 抑制率的影响 如图5 所示,随着超声时间的延长,ACE 抑制率先升高后降低,在30 min 达到最大值62.7%±0.6%,超声带来的声波震动、空化效应和机械剪切作用,对茶渣蛋白提供更多酶切位点[29]。超声时间过长可能将蛋白质结构破坏,影响ACE 抑制肽的提取,降低ACE 抑制率。因此,选择超声时间30 min 为佳。
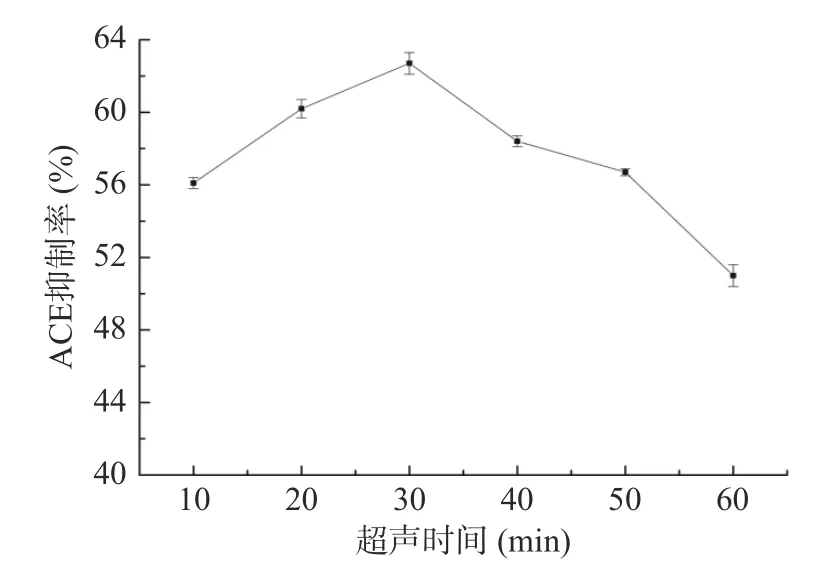
图5 超声时间对ACE 抑制率的影响Fig.5 Influence of ultrasonic time on ACE inhibitory rate
2.4 响应面优化试验结果
根据单因素实验结果,以超声功率、超声温度、超声时间为响应值,采用Box-Behnken 法进行酶解工艺优化。实验数据用软件Design-Expert 8.0.6 进行设计,试验设计方案及结果见表2。
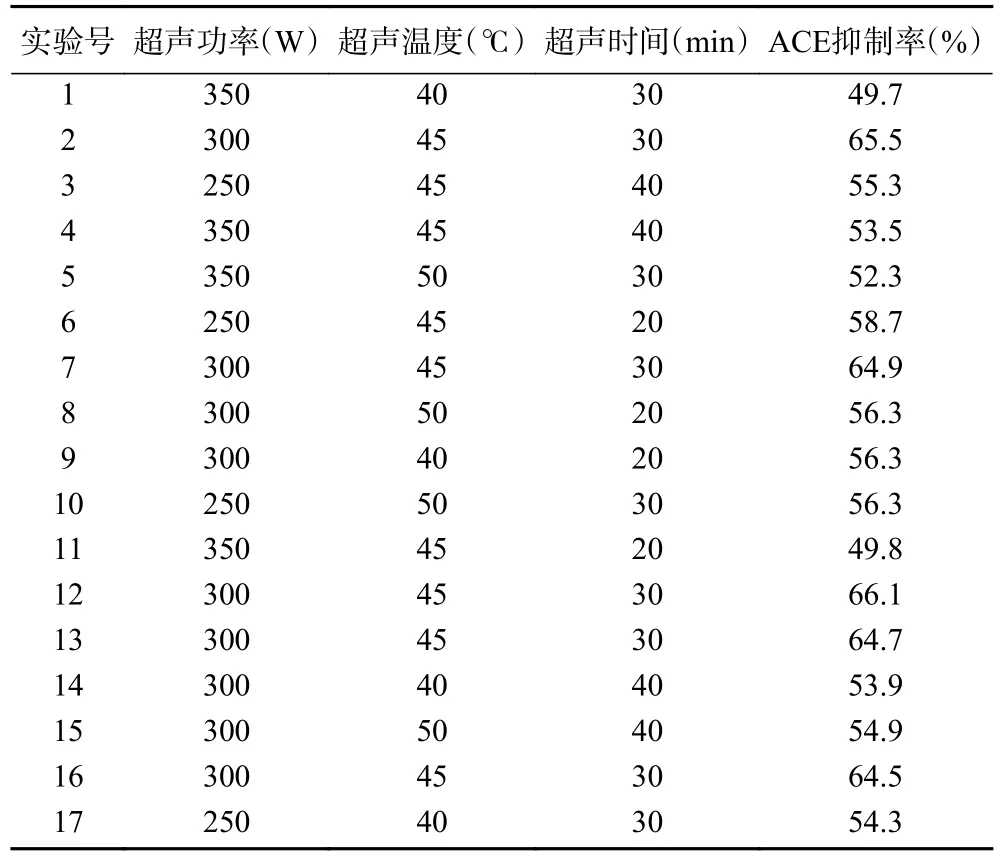
表2 Box-Behnken 试验设计及结果Table 2 Experimental design and results for Box-Behnken
利用Design-Expert.8.0.6 对实验结果进行多元回归拟合,得到多元二次响应面回归模型方程为:
Y=0.38-6.500E-003A-3.625E-003B-1.375E-003C+3.250E-003AB-1.250E-003AC+2.500E-003BC-0.020A2-0.012B2-9.800E-003C2
模型P值极显著(P<0.0001),失拟项不显著(P=0.1379>0.05),表明模型稳定。表3 中,该模型的决定系数R2为0.9880,这表明该模型与实际实验拟合效果理想。一次项(A)和二次项(A2、B2、C2)对响应值影响极其显著(P<0.01),说明超声功率、超声温度和超声时间对酶解效果的影响并非一元的简单线性关系。交互项AB 对响应值影响极其显著(P<0.01),说明超声功率和超声温度之间的交互作用很好。通过F值比较得到了各因素对ACE 抑制率的影响,依次为超声功率>超声温度>超声时间。综上所述,该模型拟合度较好,可以用超声波预处理茶渣蛋白酶解制备茶渣蛋白ACE 抑制肽。
年青的姑娘们,她们三两成双,坐着马车,去选择衣料去了,因为就要换春装了。她们热心地弄着剪刀,打着衣样,想装成自己心中想得出的那么好,她们白天黑夜地忙着,不久春装换起来了,只是不见载着翠姨的马车来。
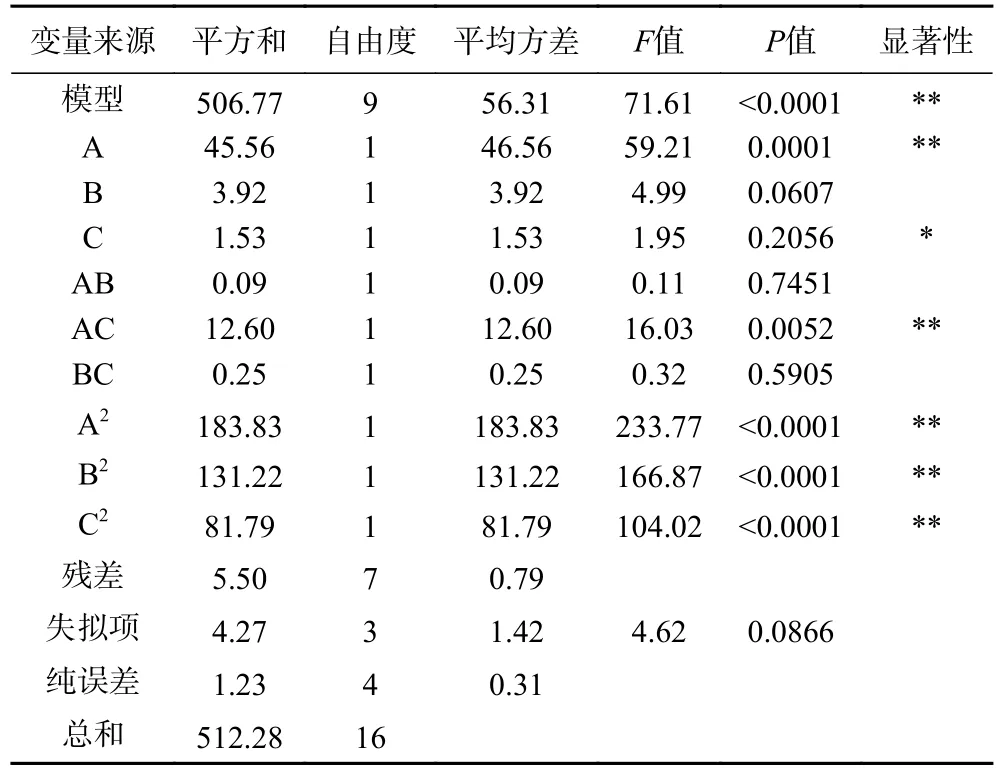
表3 回归方程方差分析表Table 3 Analysis of variance of regression model
如图6A、图6C 所示,响应面的斜率趋势平缓,说明超声功率和超声温度以及超声功率和超声时间的交互作用不显著,对应表3 中AB 的P值为0.7451>0.05,BC 为0.5905>0.05。由图6B 可知,响应面斜率趋势陡峭,等高线图呈椭圆形,表明超声温度和超声时间的交互作用极显著,与表3 中AC(P=0.0052<0.01)的P值相对应。

图6 各因素交互作用对ACE 抑制率影响的响应面图Fig.6 Response surface map of interaction of factors on ACE inhibition rate
通过分析和响应面模型预测得到超声预处理酶解制备ACE 抑制肽的最佳条件为:底物浓度2%,加酶量8000 U/g,pH8.5,超声功率300 W,超声温度45.29 ℃,超声时间24.56 min(考虑到实际操作,将超声功率、超声温度和超声时间调整为300 W、45 ℃和25 min),此条件下的ACE 抑制肽的抑制率为64.8%±0.2%,与预测结果65.61%接近,表明回归模型能够反映酶解制备ACE 抑制肽的过程。
2.5 分子量对茶渣ACE 抑制肽活性的影响
本实验分别采用截留分子量为10、5、3 kDa 的超滤膜对茶渣ACE 抑制肽进行分离,得到>10 kDa(TPep-1)、5~10 kDa(TPep-2)、3~5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,分别配制成2 mg/mL的ACE 抑制肽溶液,其ACE 抑制率如表4 所示。结果表明随着分子量的减少其ACE 抑制率明显升高,说明小分子量范围的茶渣ACE 抑制肽具有更强的活性,这可能是由于高分子质量肽段结构复杂,具备抑制活性的氨基端没有暴露,无法起到降低ACE抑制率的作用[30]。章禹航等[31]在鲅鱼加工副产物制备ACE 抑制肽研究时得出类似结论,分子量小于3 kDa的超滤组分具有最高的ACE 抑制率。
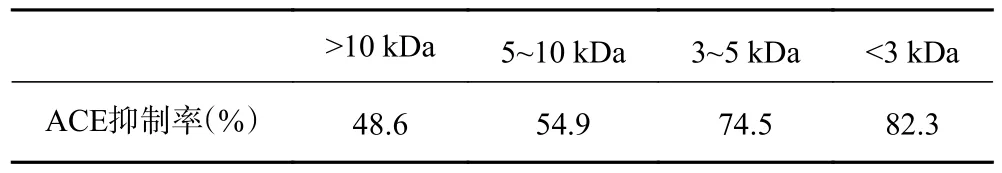
表4 不同分子量范围的茶渣ACE 肽的抑制率Table 4 Comparison of ACE inhibitory peptides from tea residue with different molecular weight
2.6 茶渣ACE 抑制肽的稳定性
肽类物质稳定性差、体内半衰期短、生物膜渗透性差,其稳定性差是肽类药物开发的主要问题[32-33]。
2.6.1 温度对茶渣ACE 抑制肽活性的影响 经过不同温度条件处理后的ACE 抑制肽的抑制活性结果如图7 所示,温度从30 ℃上升到90 ℃,Tpep-4 的ACE 抑制率都略有下降。90 ℃时随着时间的推移,Tpep-4 的ACE 抑制率由78.3%降低至74.0%,减少了4.3%,这可能是高温使肽链被破坏从而抑制其活性。这说明,当温度保持在体温时,ACE 抑制肽是稳定的,但多肽在加工过程中应控制好温度,避免长时间高温环境。

图7 温度对Tpep-4 组分的ACE 抑制率影响Fig.7 Effect of temperature on the ACE inhibitory rate of Tpep-4
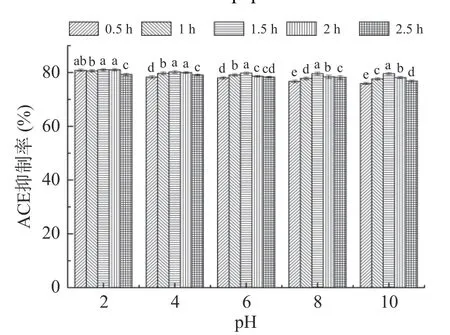
图8 pH 对Tpep-4 组分的ACE 抑制率影响Fig.8 Effect of pH on the ACE inhibitory rate of Tpep-4
2.6.3 盐溶液对茶渣ACE 抑制肽活性的影响 如图9 所示,氯化钠盐溶液的浓度从0.2 mol/L 增长至0.6 mol/L,茶渣ACE 抑制肽的ACE 抑制率无显著变化(P>0.05);当盐溶液浓度继续增大至1.2 mol/L时,ACE 抑制率出现明显下降趋势此时为69.3%,相比于刘鑫酮从皮氏蛾螺中所制备ACE 抑制仍有较高抑制[35]。表明茶渣ACE 抑制肽在不同浓度的盐溶液中均表现出良好的活性。
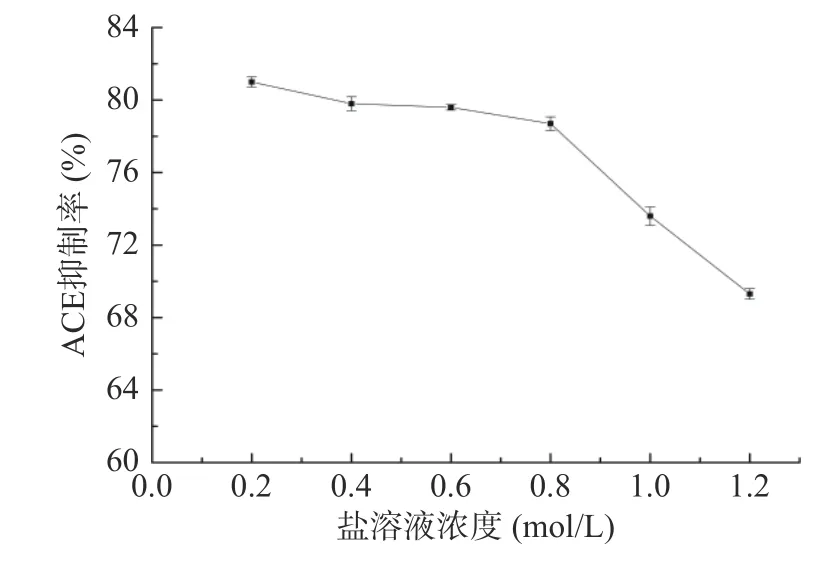
图9 盐浓度对Tpep-4 组分的ACE 抑制率影响Fig.9 Effect of salt concentration on the ACE inhibitory rate of Tpep-4
2.6.4 体外消化实验对茶渣ACE 抑制肽活性的影响 由表5 可知,茶渣ACE 抑制肽在经胃消化酶、胰蛋白酶处理后,Tpep-4 的ACE 抑制率原先的82.3%降至65.2%,其中经过胃蛋白酶处理降低9.0%,胰蛋白酶处理降低8.1%,这可能是因为在消化酶作用下,Tpep-4 进一步进行酶解,生成了ACE 抑制较弱的片段,其结果相较于刘文颖等[36]研究乳清低聚肽对ACE 抑制作用体外消化影响保持较高活性。这说明消化前后茶渣ACE 抑制肽都具有较好抑制率,有望在体内能够表现出良好稳定性并发挥其功能。

表5 茶渣ACE 抑制肽体外模拟消化实验结果Table 5 Results of in vitro simulated digestion of tea residue ACE inhibitory peptides
3 结论
利用超声波预处理茶渣蛋白辅助碱性蛋白酶酶解制备ACE 抑制肽。通过选择不同的超声方式辅助酶解制备茶渣ACE 抑制肽,最终确定超声预处理茶蛋白为最适的超声方式;分析比较5 种不同酶制备的茶渣蛋白ACE 肽的抑制率,选取了碱性蛋白酶进行后续试验。筛选出超声波辅助制备茶渣蛋白ACE 抑制肽的最佳提取工艺条件是超声功率300 W、超声温度45 ℃、超声时间25 min、底物浓度2%、酶添加量8000 U/g、酶解pH8.5、酶解时间2.5 h、酶解温度60 ℃,ACE 抑制率为64.8%±0.2%。采用超滤法将酶解液分离成>10 kDa(TPep-1)、5-10 kDa(TPep-2)、3-5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,当茶渣蛋白ACE 抑制肽的分子量范围<3 kDa、时,ACE 抑制率最高达到82.3%±0.6%。TPep-4 组分茶渣ACE 抑制肽不仅具有良好的热稳定性、pH稳定性和盐溶液稳定性,同时具有较强的抵抗胃蛋白酶和胰蛋白酶消化能力。本试验不仅确定超声波预处理技术可作为制备茶渣蛋白ACE 抑制肽的有效方法,也为其进一步研究提供了基础。

